基于RNA的疫苗是COVID-19大流行的英雄。他们创造了历史上收入最高的药物发布记录,他们的应用在今年的诺贝尔生理学或医学奖中得到了认可。但人们早就知道这项技术有一个关键的缺点:线性形式RNA通常是短命的。在几个小时内,细胞中的核酸酶降临到这些分子上,将其咀嚼成碎片。
Why rings of RNA could be the next blockbuster drug (nature.com)
对于疫苗来说RNA的短命性并不是大问题:它只需要在短时间内编码蛋白质即可引发免疫反应。但对于大多数治疗应用来说,拥有可以停留更长时间的RNA会好得多。
这就是环状RNA或circRNA的用武之地。将RNA的末端绑在一起,许多RNA分解酶就没有办法进行降解。环状RNA获得了稳定性和寿命,理论上可以增加其治疗潜力,即使在低剂量水平下也是如此。
“通过一次递送,你可以获得相当持久的蛋白质生产,”加利福尼亚州斯坦福大学医学院的分子遗传学家,马萨诸塞州剑桥市Orbital Therapeutics的科学联合创始人Howard Chang说 - 这是现在正在寻求基于工程环状RNA的治疗的十几家生物技术公司之一。
在过去三年中,这些生物技术公司总共筹集了超过1亿美元的风险投资资金,许多大型制药公司现在也涉足这项技术。他们相信无论线性RNA能做什么,其更具弹性的环状对应物都可以做得更好。
支持者预计circRNA将成为制药行业的首选RNA平台,并可能导致从下一代疫苗和罕见疾病治疗到抗癌剂等产品。此类药物的首次人体试验于8月开始。
但是,正如一家初创公司所预测的那样,环状RNA距离开启一场革命或实现到十年末100个新药项目的承诺还有很长的路要走。circRNA增加的弹性是否使其能够超越其他持久的治疗方法 - 如传统的基因疗法或新兴的基因编辑技术 - 仍然是一个正在进行的研究和科学探究领域。
“不要误会我的意思,我认为循环RNA是垃圾,”马萨诸塞州波士顿的合成生物学公司Strand Therapeutics的联合创始人兼首席执行官Jake Becraft说,该公司正在一些药物项目中使用circRNA。“但是,人们完全掩盖了令人难以置信的挑战。
研究人员在1976年发现了自然界中的第一个环状RNA,当时德国的一个研究小组在植物中描述了一系列小的病毒样RNA病原体,这些病原体呈闭合的环形形式。15年后,研究人员在人类和其他哺乳动物细胞中发现了环状RNA分子。2.
然而,直到2010年代,研究人员才能真正了解环形RNA在各种细胞类型中的程度,并发现它们在指导生物活动方面的多方面作用。
在大多数情况下,它们的作用是与调控分子结合以介导基因表达。但一些circRNA也可以编码蛋白质 - 科学家们很快意识到这种功能可能具有治疗潜力,只要他们有办法从头开始制造RNA圆圈。
在细胞中,圆圈通过一种称为反向剪接的非常规信使RNA处理模式产生。通常,RNA剪接的操作与胶片编辑非常相似,非编码片段被切除,其余编码部分连接在一起。但在某些情况下,RNA会发生意想不到的转变,自行折叠,捏断并形成一个独立的环。
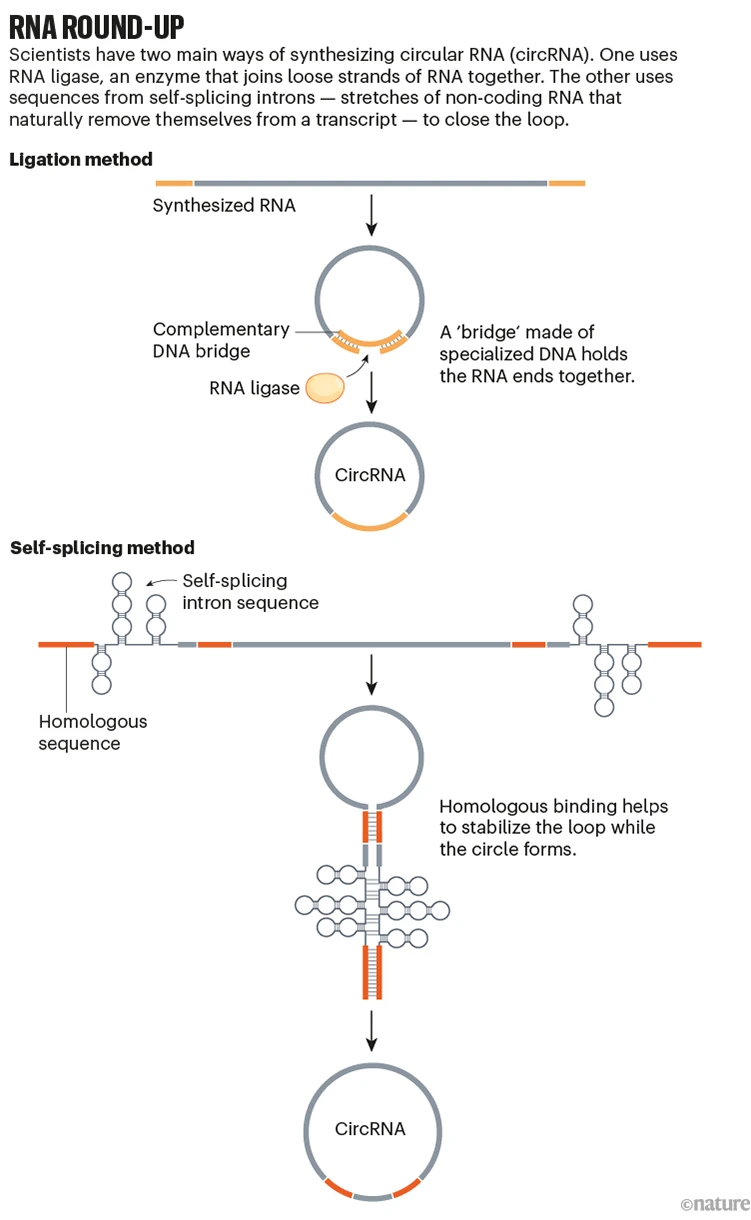
反向剪接需要在各种蛋白质之间错综复杂的舞蹈,所有这些蛋白质都天然存在于细胞内,但在实验室工作台上不容易获得。因此,在1990年代初期,研究人员提出了两种可能的解决方法来创建合成环状RNA。
一种使用DNA桥将RNA链的末端固定在一起,而另一种酶将其密封,这一过程称为连接3.另一种利用特殊RNA序列本身的酶特性4,5.当两个这样的序列以发夹形式配对时,它们可以引发交叉连接反应,形成环。
1995年,丹佛科罗拉多大学的一个小组研究如何从这种实验室制造的圈子中合成蛋白质,使用一种称为IRES的特殊序列。6.IRES是内部核糖体进入位点的缩写,它允许核糖体与环状RNA转录本结合并开始连续产生蛋白质。“核糖体永远不需要弹出,”康涅狄格州纽黑文耶鲁大学医学院的RNA生物学家Grace Chen说。
然而,研究人员只能创建短的环状序列 - 通常最多只有几百个核苷酸。在接下来的20年里,该领域一直受到这种规模限制,因此无法生成解决囊性纤维化或血友病等疾病所需的长蛋白质编码转录本。
作为剑桥麻省理工学院(MIT)的研究生,Wesselhoeft从连接方法开始,但事实证明,对于较大的分子来说效率低下。与将长丝带绑成蝴蝶结一样,随着RNA大小的增加,处理末端的挑战变得更加明显,这使得实现良好形成的环结构变得更加困难。
切换到自剪接方法,Wesselhoeft设计了具有蛋白质编码区和IRES元件的RNA链,两侧是自剪接序列,就像其他人以前所做的那样。但是,他与现在爱尔兰科克大学学院的生物工程师Piotr Kowalski和麻省理工学院的Dan Anderson合作,他还在分子的不同点添加了RNA和间隔序列的互补位,这有助于稳定实现循环化的发夹结构。
合成RNA现在可以有效地循环化,即使使用更长的序列也是如此7.在小鼠中进行的实验表明,这些circRNA可以在数天内引发蛋白质产生,而线性mRNA仅在约24小时内产生蛋白质。8.这种循环化技术于2018年首次报道,并迅速成为该领域体外circRNA合成的首选方法。
“这真的让事情变得更有效率,”马里兰州弗雷德里克美国国家癌症研究所的RNA生物化学家Jason Rausch说,他在自己的circRNA项目中采用了这项技术。
2019年,Wesselhoeft和Anderson与生物技术企业家Raffaella Squilloni一起成立了一家公司,将该平台商业化。最初被称为Oroboros Bio,以神话中的蛇形成一个环来吞噬自己的尾巴,这家初创公司后来更名为Orna Therapeutics。
作为Orna的分子生物学负责人,Wesselhoeft继续完善和优化这一过程。最终,他制作了一种超长的circRNA编码肌营养不良蛋白,这是一种杜氏肌营养不良症中缺乏的巨大蛋白质。转录本包含近12,000个核苷酸。Wesselhoeft说,肌营养不良蛋白“是人类基因组中你想要表达的最大的东西”。
然而,Orna并不是唯一一家磨练其循环化工艺的初创公司,其他公司也采取了不同的方法来构建circRNA。
一些公司将产生circRNA的指令包装到病毒载体或DNA盒中,然后让剪接在细胞中发生。“我们的病毒在这里为我们做了肮脏的工作,”北卡罗来纳州达勒姆杜克大学的合成病毒学家,北卡罗来纳州三角研究园Torque Bio的联合创始人Aravind Asokan说。“它实际上是从原子核内部形成圆圈。
另一家公司,纽约市的Chimerna Therapeutics,正在使用基因工程细菌来制造其circRNA,首席执行官Brian Pickering表示,与完全实验室生成的分子相比,“节省了大量成本和节省时间”。
但大多数都是建立在Wesselhoeft的协议之上的。八月,韩国城南生物技术公司Rznomics的一个团队描述了一种循环化RNA的系统,该系统避免在circRNA中留下任何不需要的自剪接序列。9.中国两家公司——上海的CirCode Biomedicine和苏州CureMed Biopharma Technology——的研究人员去年分别发布了预印本,概述了类似的方法10,11.
“最终的circRNA只包含编码区和IRES”,没有任何不需要的序列或伪影,苏州CureMed研发负责人Chijian Zuo说。
去除这些额外的序列片段可能会确保circRNA不会引发不需要的免疫反应,这可能会破坏其治疗效果。如果你想要一种可以在一生中一次又一次给予的疗法,这一点很重要,哥本哈根Aloop Therapeutics的联合首席执行官Thomas Kirkegaard Jensen说,该公司旨在用circRNA治疗罕见的遗传疾病。
“我们真的需要考虑每一个有助于免疫原性的元素,并尽可能多地减轻它,”他说。
但关于circRNA是否触发免疫的报道各不相同。上海生物化学与细胞生物学研究所的RNA生物学家Ling-Ling Chen说:“这真的取决于你如何制作圆圈。在2021年首次在线发表的一篇论文中,她和她的同事详细介绍了自剪接基序留下的序列如何倾向于扭曲RNA折叠,导致具有不规则结构的圆圈引发免疫反应。12.
然而,大约在同一时间,德国吉森Justus Liebig大学的RNA生物化学家Oliver Rossbach及其同事报告说,污染物可能是原因,并且可以通过正确的纯化步骤最小化或消除反应。13.“它必须超级干净,”罗斯巴赫说。
然而,在某些情况下,免疫反应性可能是可取的。对于癌症和传染病的疫苗,激发免疫系统可以刺激抗体和T细胞的产生。这就是北京大学基因组编辑科学家魏文生和他的同事在使用circRNA开发冠状病毒SARS-CoV-2疫苗时发现的。
在小鼠和猴子实验中,circRNA疫苗促使产生比批准的COVID-19疫苗中相同类型的修饰mRNA制成的线性疫苗更多的病毒破坏抗体,并导致更有效的T细胞反应14.作为额外的好处,circRNA注射在室温下比mRNA更稳定,可能允许疫苗在没有冷链要求的情况下储存和运输。
Wei创立的一家公司,总部位于北京的初创公司Therorna,目前正在人体中测试这种疫苗。该试验被认为是第一个在人类中测试合成circRNA药物的试验。明年可能会看到其他一些人进入临床,包括苏州CureMed的癌症治疗药物,它编码一种叫做白细胞介素-12的免疫刺激分子。
Orna还准备在2024年开始试验一种重新编程免疫细胞以攻击血癌的circRNA。在五月的一次会议上,Orna科学家表明,即使以低剂量给药,这种circRNA候选药物也可以根除白血病小鼠模型中的肿瘤,而无需任何复杂的细胞工程或密集的预备药物方案,这是当今大多数可比免疫疗法所需的。
合成circRNA可以做的不仅仅是编码治疗性蛋白质。当折叠成某些形状时,分子可以像抗体一样作用并直接与靶标结合,从而产生一种称为适配体的药物。它们可以捕获和隔离不同种类的调节分子,有效地将它们从细胞环境中清除。
它们还可以作为“反义剂”,与基因转录本结合并阻断或改变其表达。此外,它们可以作为RNA编辑应用的指导分子,将专门的酶引导到需要校正的突变疾病基因转录物上。各种初创公司都在积极探索所有这些应用。
但最大的投资是在蛋白质表达方面,许多早期的研究和开发都集中在寻找提高circRNA平台生产效率的方法上。“如果你优化得足够,它可以更健壮,”CirCode联合创始人Zefeng Wang说,他是上海计算生物学合作伙伴研究所的RNA生物学家。
对于大多数研究团队来说,这个过程从IRES开始。例如,在去年首次发表的结果中,Chang和他的同事系统地表征了来自各种病毒的数十种IRES元件,发现了许多比科学界常用的蛋白质表达更强大的蛋白质表达。通过微调其他一些设计元素,他们还成功地将circRNA的生产力放大了数百倍,从而使蛋白质水平持续数天。15.
“这些改进是模块化的,”Chang说。“它们有点堆叠在一起。
但进展是断断续续的——随着该领域的成熟,它面临着一些成长的痛苦。
今年6月,有关Laronde数据完整性问题的消息浮出水面,Laronde是该领域资金最充裕的初创企业之一。这家总部位于马萨诸塞州萨默维尔的公司因此被迫放弃了其最先进的药物项目之一。
根据Laronde首席执行官约翰·门德莱因(John Mendlein)的说法,这些挫折“并不代表今天的公司,也不代表科学或人民”。然而,这一事件使某些观察者对circRNA的潜力产生了怀疑。
圆圈和线并不是编码基于RNA的疗法的唯一方法。许多研究人员认为,即使是更持久的技术,例如可以在细胞中复制自己的自我扩增RNA,对于将合成RNA转化为许多慢性病的可行治疗方法也是必要的。
但Wesselhoeft现在是剑桥Mass General Brigham Gene and Cell Therapy Institute的RNA治疗学主任,他仍然看好循环分子。即使线性mRNA疫苗取得了所有成功,他也将circRNA视为未来。“这将是首选的RNA治疗技术,”他说。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1404683.html?mobile=1
收藏

