双硫死亡提供了治疗癌症新策略
细胞死亡有多种形式,具体取决于触发因素。例如,在人类胚胎发育过程中,构成手指之间织带的细胞将经历有序的自我毁灭,称为细胞凋亡,从而实现手指分离。其他有计划外细胞坏死,主要由破坏细胞机器的损伤或毒素引发。无论是否程序化,细胞死亡都是癌症擅长避免的重要过程。
Cell death discovery adds fresh angle to attack cancer (nature.com)
“大多数疗法旨在通过促进细胞凋亡杀死肿瘤细胞,”德克萨斯大学MD安德森癌症中心研究细胞生死的Boyi Gan说。“但肿瘤细胞通常可以逃避细胞凋亡,导致肿瘤持续和复发。”
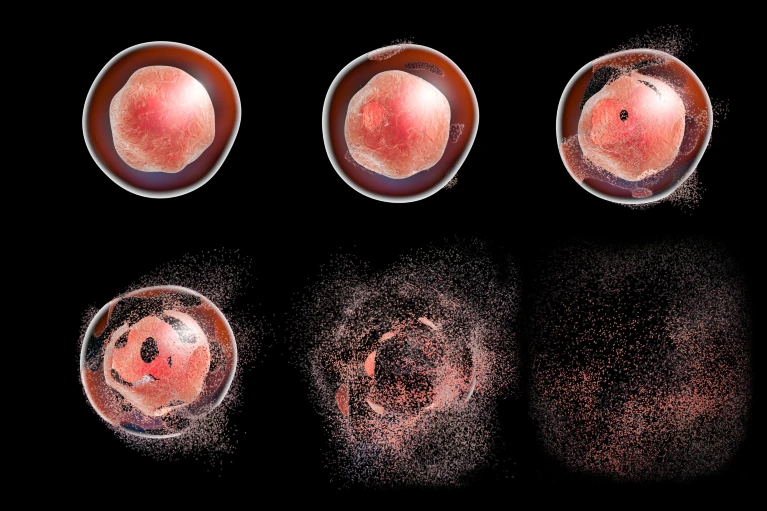
图 不同细胞死亡形式
除了机械损伤细胞被暴力撕裂导致死亡外,细胞死亡一般是由级联的酶网络进行的。恶性细胞可以通过下调死亡关键酶或抑制致死触发因素来逃避死亡过程。然而,当肿瘤细胞对一种形式的死亡产生抵抗力时,它们往往容易受到其他形式的抵抗。
在发表在《自然细胞生物学》上的一篇论文中1Gan及其同事详细介绍了一种称为二硫化物的新形式的细胞破坏,其中细胞被含二硫化合物的化合物淹没。虽然目前还不清楚正常细胞是否自然地遇到这种形式的死亡,但一些肿瘤细胞似乎已经适应了一种生存机制,使它们容易受到双硫死亡的影响。
健康的细胞会产生反应性代谢物,这些代谢物可以附着并恶化其质膜,这种现象称为脂质过氧化。为了防止这种情况,细胞会摄取胱氨酸,这有助于谷胱甘肽的形成,谷胱甘肽是一种有效的细胞抗氧化剂,可以抵消脂质过氧化。没有足够的胱氨酸,脂质过氧化会引发一种称为铁死亡的细胞死亡形式2。许多肿瘤细胞通过过表达胱氨酸转运蛋白SLC7A11来逃避铁死亡。
“当肿瘤细胞具有高水平的这种转运蛋白时,”Gan解释说,“它可以保护它们免受铁死亡,但我们发现它也存在脆弱性。”
胱氨酸含有活性二硫键,可与整个细胞中的各种蛋白质反应,具有毒性作用。细胞使用还原剂NADPH中和胱氨酸,NAPDH主要由葡萄糖提供。因此,过度表达SLC7A11的细胞对葡萄糖上瘾,缺乏这种能量来源会导致胱氨酸的毒性积聚并引发双硫死亡。
Gan的研究小组发现胱氨酸的积累导致肌动蛋白细胞骨架中二硫键的积累,最终导致细胞死亡。细胞凋亡、铁死亡和其他细胞死亡机制的抑制剂对这一过程没有影响,这表明双硫死亡是一种独特的途径。
双硫死亡的发现为破坏对铁死亡产生抵抗力的肿瘤细胞提供了一条新的途径,同时最大限度地减少了附带毒性。研究人员在临床前模型中观察到,当葡萄糖摄取受到抑制时,过表达SLC7A11的细胞迅速死于双硫死亡。“这表明在某些癌症中触发这种细胞死亡的治疗潜力,”甘说。
关于双硫死亡的机制还有很多需要了解的地方。因为已知SLC7A11在一系列肿瘤类型中过表达3,如果这项工作可以在临床上得到验证,那么通过这种新发现的细胞死亡途径进行破坏可能会成为许多肿瘤学家工
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1388790.html?mobile=1
收藏

