博文
Green Carbon绿碳创刊号 │ 亲和诱导的蛋白质邻近连接系统
|

英文原题:Affinity-induced covalent protein-protein ligation via the SpyCatcher-SpyTag interaction
作者:Jacob O. Fierer, Omar E. Tovar-Herrera, Jonathan Y. Weinstein, Amaranta Kahn, Sarah Moraïs, Itzhak Mizrahi, Edward A. Bayer*
01 论文信息
论文信息
J.O. Fierer, O.E. Tovar-Herrera, J.Y, Weinstein, et al. Affinity-induced covalent protein-protein ligation via the SpyCatcher-SpyTag interaction[J]. Green Carbon 1 (2023) 33-42.
论文关键词
Synthetic Biology; Protein Ligation; Cellulosomes; Cohesin; Dockerin; Protein Engineering; Cellulose Degradation
论文网址
https://doi.org/10.1016/j.greenca.2023.07.001
论文下载
Affinity-induced covalent protein-protein ligation via the SpyCatcher-SpyTag interaction
中文解读原链接
Green Carbon 创刊号│亲和诱导的蛋白质邻近连接系统
02 背景简介
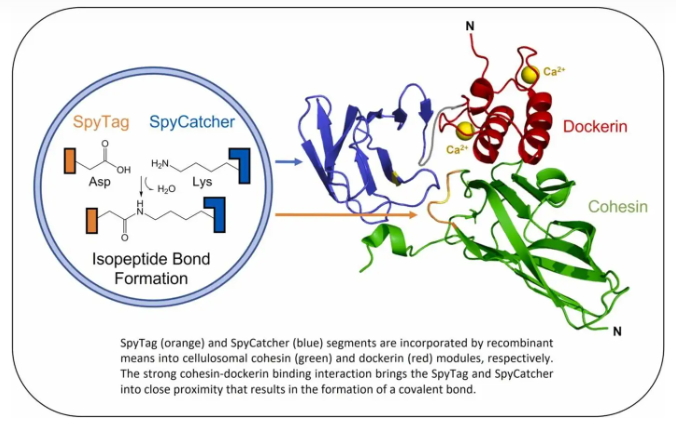
以色列魏茨曼研究所与本古里安大学研发团队近期开发了基于非共价互作模块Cohesin-Dockerin间的亲和作用以及共价交联模块SpyTag-SpyCatcher间的化学反应实现蛋白分子间近距离连接的系统。通过这一方法获得的蛋白结合复合物可耐受高温、表面活性剂SDS和尿素,同时保持相互作用模块组分的高亲和力和特异性。这种基于纤维小体的模块化蛋白复合物结构可以用于先进仿生分子机器的构建,也可应用于木质纤维素降解研究。
03 文章简介
前言
木质纤维素是地球上最丰富的可再生生物聚合物,是生产生物乙醇和其他生物基化学品的重要原料。木质纤维素具有复杂的结构和成分,因此难以高效降解成可发酵糖,进而作为非粮碳源应用于发酵领域。木质纤维素的生物转化具有重要意义,其中酶解糖化是最关键的技术环节之一。纤维小体是一种位于厌氧细菌细胞表面的大型多酶复合物,可以将多种纤维素酶、半纤维素酶等功能酶进行组装并临近底物,从而产生协作效应和局部高浓度,提高降解效率。
然而,木质纤维素的生物转化通常需要先经过基于机械粉碎或化学反应的物理、化学预处理,这些条件通常会使蛋白质变性。因此,预处理和酶解步骤通常是分开进行,从而增加了过程的成本和复杂性。纤维小体利用黏连模块(Cohesin)以及与Cohesin特异性非共价相互作用的对接模块(Dockerin)之间特异性的非共价相互作用实现不同功能元件的组装。Cohesin-Dockerin相互作用具有高亲和力、高种属特异性和高稳定性,因此被应用于仿生纳米分子机器的构建。但由于这些模块的稳定性一般以60-65 °C为温度上限,且种类有限。因此,如果有一种新方式在保证其亲和特异性的前提下进一步锁定Cohesin-Dockerin配对,从而进一步提高稳定性将具有工业应用价值。
研究内容
以色列魏茨曼研究所Edward A. Bayer教授是纤维小体的发现者之一,长期致力于纤维小体调控、组装等机制和应用研究,建立了人工纤维小体这一仿生纳米分子机器的研究体系。前期研究中,Bayer教授团队已经从两种细菌物种Clostridium thermocellum和Clostridium clarifavum以及古生菌Archaeoglobus fulgidus在不同的物种中发现了热稳定的Cohesin-Dockerin配对,创建了模块化的、热稳定的重组纤维小体。
在本研究中,该研究团队为进一步提高纤维小体的工业应用价值,将一种形成自发异肽键的SpyCatcher-SpyTag蛋白连接技术与Cohesin-Dockerin非共价连接技术进行了有机的结合。通过将SpyTag插入到Cohesin内部的loop区,并将截短的SpyCatcher融合到Dockerin的C-末端,开发出了一组嵌合的*Coh-*Doc。获得的嵌合*Coh-*Doc具有不同的亲和相互作用,其中Coh-Doc组合在生化层面上的相互作用使纤维小体的催化组分得以组装,而SpyCatcher-SpyTag间的共价互作方式进一步将Coh-Doc锁定在一起,从而创建了一种亲和诱导、邻近效应介导的连接系统。
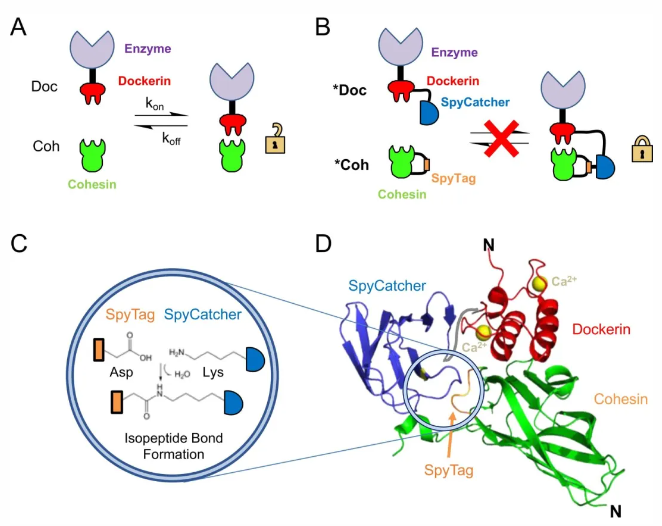
图1. 基于Cohesin-Dockerin和SpyCatcher-SpyTag的亲和诱导的蛋白质邻近连接系统示意图
此外,研究团队将两组*Coh-*Doc对融合在一起,创建了一个迷你的人工纤维小体,可耐受高温、SDS和尿素等压力环境,在保持相互作用模块组分的高亲和力和特异性的同时,体现了稳定性和鲁棒性。这也进一步证明,本研究构建的连接系统可以应用于构建更为复杂的共价锁定仿生分子机器,并为人工纤维小体的优化和开发铺平了道路。
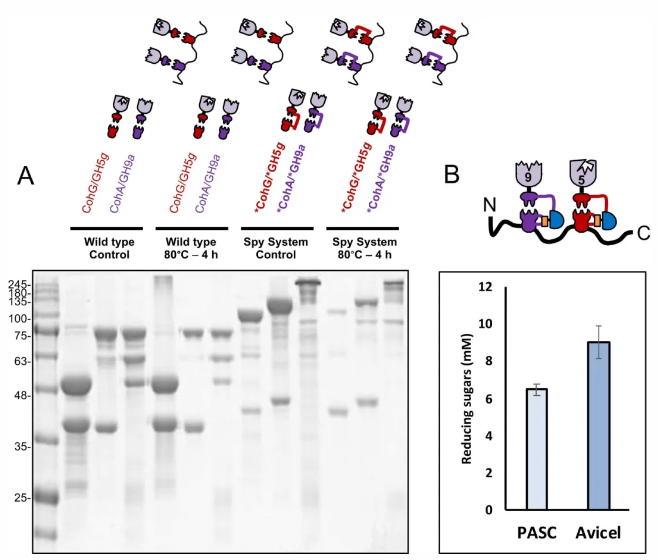
图2. 基于亲和诱导的蛋白质邻近连接系统构建人工纤维小体的概念证明
总结与展望
本研究开发的亲和诱导的蛋白质邻近连接系统有许多可能的未来应用,例如,可以集成超高温酶,根据*Coh-*Doc配对的特异性特征有选择性地协调酶的集成来增加总体特异性,并通过优化系统将预处理与木质纤维素的糖化相结合。此外,还可以将该系统扩展到木质纤维素降解以外的应用场景中,开发具有独特靶向能力和感受性的仿生分子机器。该技术为新颖的共价和非线性构架的蛋白质连接系统的改进和创建打开了新途径,即,可将其他不同的蛋白互作亲和系统和连接系统相结合(例如sortase系统和intein系统等),实现精确纳米装配的设计和制造。
04 文章摘要

Abstract
Production of economically viable bioethanol is potentially an environmentally and financially worthwhile endeavor. One major source for fermentable sugars is lignocellulose. However, lignocellulosic biomass is difficult to degrade, owing to its inherent structural recalcitrance. Cellulosomes are complexes of cellulases and associated polysaccharide-degrading enzymes bound to a protein scaffold that can efficiently degrade lignocellulose. Integration of the enzyme subunits into the complex depends on intermodular cohesin-dockerin interactions, which are robust but nonetheless non-covalent. The modular architecture of these complexes can be used to assemble artificial designer cellulosomes for advanced nanotechnological applications. Pretreatments that promote lignocellulose degradation involve high temperatures and acidic or alkaline conditions that could dismember designer cellulosomes, thus requiring separation of reaction steps, thereby increasing overall process cost. To overcome these challenges, we developed a means of covalently locking cohesin-dockerin interactions by integrating the chemistry of SpyCatcher-SpyTag approach to target and secure the interaction. The resultant cohesin-conjugated dockerin complex was resistant to high temperatures, SDS, and urea while high affinity and specificity of the interacting modular components were maintained. Using this approach, a covalently locked, bivalent designer cellulosome complex was produced and demonstrated to be enzymatically active on cellulosic substrates. The combination of affinity systems with SpyCatcher-SpyTag chemistry may prove of general use for improving other types of protein ligation systems and creating unconventional, biologically active, covalently locked, affinity-based molecular architectures.
05 作者简介

Edward A. Bayer 教授
Edward A. Bayer,教授,目前就职于以色列魏茨曼研究所与本古里安大学,是Biotechnology Advances的主编,曾任美国能源部生物能源科学中心科学顾问委员会成员十年,并当选为美国和欧洲微生物学会院士。他的研究工作主要集中在蛋白质-蛋白质和蛋白质-配体相互作用的结构和功能研究,蛋白质工程,纳米生物技术,细菌学,木质纤维素生物质降解和生物质到生物燃料的加工等。在他早期的工作中,他帮助开发了亲和素-和链亲和素-生物素系统(生物科学的通用工具);他是纤维小体的共同发现者,并组织和主持了关于这一主题的戈登研究会议,并在这些研究领域内撰写了460多篇文章和评论性论文。
06 Green Carbon
期刊官网:Green Carbon官网
投稿网址:Green Carbon投稿
公众号:Green Carbon公众号

https://wap.sciencenet.cn/blog-3620330-1489254.html
上一篇:Green Carbon绿碳创刊号 │ 合成生物技术推动新型生物基增塑剂反式乌头酸酯的开发
下一篇:Green Carbon绿碳创刊号 │ 谭天伟院士与刘子鹤教授最新研究成果:高甲酸盐浓度下的酿酒酵母耐受机制