
上海科技大学生命科学与技术学院刘冀珑教授团队的文章 “Filamentation and inhibition of prokaryotic CTP synthase with ligands”已在mLife网站正式上线,该研究详细解析了大肠杆菌胞苷三磷酸合成酶(CTP synthase,简称CTPS)的结构,并揭示了其与多种配体的相互作用及其抑制机制。该研究不仅为理解CTPS在生物体内的调控提供了新的视角,也为开发针对细菌病原体的新型治疗策略奠定了基础。

CTPS在生物体内扮演着至关重要的角色,它负责催化胞苷三磷酸(Cytidine triphosphate, 简称CTP)的合成,而CTP是RNA和DNA合成的关键前体分子。CTPS能够直接识别并与所有四种核苷三磷酸(ATP、UTP、CTP和GTP)结合,并在体内形成细胞蛇(cytoophidia)和在体外形成代谢纤维,这些结构的形成和调控在不同尺度层面上进行。
该研究团队利用冷冻电子显微镜解析了大肠杆菌CTPS(ecCTPS)与CTP、还原型烟酰胺腺嘌呤二核苷酸(Reduced Nicotinamide Adenine Dinucleotide,简称NADH)以及共价抑制剂6-Diazo-5-oxo-L-norleucine(DON)形成的复合物结构,分辨率达到了2.9埃(图1)。
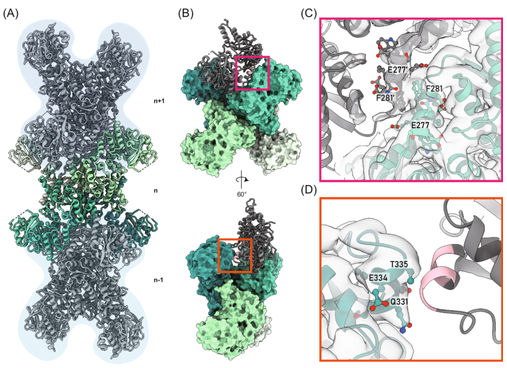
图1 细菌胞苷三磷酸合酶代谢纤维的组装和结构
通过构建基于代谢纤维形成界面差异的系统发育树,该团队发现了螺旋12对于CTPS代谢纤维形成的重要性,并设计了一种变体来验证他们的假设,从而揭示了螺旋12在CTPS代谢纤维化中的关键角色,并为CTPS代谢纤维形成提供了进化视角。在DON结合后,ecCTPS内部形成了一个溶剂可及的氨气隧道,通过比较结构分析揭示了ecCTPS与真核生物CTPS在CTP结合方式上的显著差异。结合生化分析和结构分析,该团队确定了CTP与NADH或腺嘌呤对ecCTPS的协同抑制效应。
该研究不仅丰富了对CTPS多样性调控机制的理解,而且为设计针对细菌CTPS的特异性抑制剂提供了科学基础。该研究结果具有潜在的临床应用价值,有助于开发针对细菌感染和病毒感染的新药物。
引用本论文:Guo C, Wang Z, Liu J‐L. Filamentation and inhibition of prokaryotic CTP synthase with ligands. mLife. 2024.
原文链接:
https://doi.org/10.1002/mlf2.12119

第一作者
郭陈君 博士生
作者单位:上海科技大学
作者简介:
2016-2020 上海科技大学 本科
2020-现在 上海科技大学 博士研究生

第一作者
汪紫璇 本科生
作者单位:上海科技大学
作者简介:
2020-2024 上海科技大学 本科

通讯作者
刘冀珑 教授/研究员
作者单位:上海科技大学
作者简介:
2000/07—2002/12,美国康乃狄格大学,博士后
2003/01—2007/08,美国卡内基研究所,博士后
2007/08—2012/01,英国牛津大学,MRC Programme Leader(TENURE-TRACK)
2012/01—2016/05,英国牛津大学,MRC Programme Leader(TENURED)
2016/06—至今,上海科技大学生命科学与技术学院,教授(TENURED)
mLife
期刊简介
mLife是由中国科学院主管、中国科学院微生物研究所主办(中国微生物学会为合作单位)的我国微生物学领域第一本综合性高起点英文期刊。mLife瞄准全球微生物学领域高水平科研成果和前沿进展,报道内容覆盖微生物学各个学科。mLife的办刊目标是打造微生物学领域综合性国际旗舰期刊。目前mLife已被Scopus、DOAJ、 CSCD、CAS、Google Scholar、ESCI等国内外数据库收录。
期刊网站:
http://mlife.im.ac.cn/
https://wileyonlinelibrary.com/journal/mLife
https://www.sciopen.com/journal/2097-1699
投稿网站:https://mc.manuscriptcentral.com/mlife
扫码关注mLife
mLife@im.ac.cn
010 - 64807055
转载本文请联系原作者获取授权,同时请注明本文来自SciOpen TUP科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3563286-1433656.html?mobile=1
收藏

