Section.01
常规溶剂系统的选择与优化
想要筛选既能满足溶解度要求又不引入化学干扰的溶剂体系?那就需要在工作液配制时遵循 GLP 规范,使用经计量认证的精密仪器进行精确浓度标定 (误差范围 ≤±2%),并通过超声均质化处理 (40 kHz, 300 W, 10 min) 和 0.22 μm 微孔滤膜除菌处理,确保溶液体系的物理化学稳定性。
在药物制剂研发过程中,溶剂系统的选择需建立双重评价体系:既要保证药物的充分溶解,又要确保对生物体系的相容性。根据药物理化性质的差异,可以采用差异化的溶剂策略:
水溶性药物的溶剂体系优化
水作为最经济的溶剂,适用于水溶性小分子药物 (如葡萄糖)。但是其核心挑战在于渗透压的调节,需通过添加氯化钠或葡萄糖将渗透压控制在合理范围内,以匹配生理环境 (如血液渗透压约 300 mOsm/kg)。如果渗透压异常可能会导致红细胞溶血或细胞脱水 (如注射剂需符合《中国药典》渗透压要求)。因此,为了方便我们建议首选等渗缓冲体系:
生理盐水 (0.9% NaCl):适用于多数离子型药物,但需注意某些金属离子可能引发药物沉淀。
磷酸盐缓冲液 (PBS):虽能维持生理 pH 环境,但其磷酸根基团可能与金属螯合类药物 (如铂类抗肿瘤药) 发生配位反应,此时可改用 HEPES 缓冲体系。
脂溶性药物的溶解和增溶技术
对 logP>3 的疏水性药物 (如环孢素),DMSO 仍是最常用的初级溶剂。近年研究证实,当 DMSO 终浓度超过 0.5% 时,会显著改变细胞膜流动性,干扰跨膜信号传导[2]。因此建议采用梯度置换法:先用 DMSO 溶解原药至储存浓度 (如 50 mg/mL),再用含 5% 聚山梨酯 80 的生理盐水进行二次稀释,将 DMSO 浓度控制在 0.2% 以下。实验表明,DMSO 反复冻融会导致溶剂晶格破坏,引发药物析出或降解。推荐分装后 -20℃ 单次冻存,并避免高温暴露 (DMSO 沸点 189℃)。
对于脂溶性药物 (如维生素 D) 通常也会用油性载体 (如大豆油、中链甘油三酯) 溶解,但需联合表面活性剂 (如聚山梨酯 80、卵磷脂) 形成稳定乳液。例如,睾酮注射液通过高压均质法制备粒径 <500 nm 的乳滴,可提高淋巴吸收效率。然而,乳化体系可能引起局部刺激,需通过动物实验评估安全性。
有机溶剂的毒理学评估
乙醇、丙二醇等助溶剂需建立系统毒性评价方案。体外实验中,建议进行 24-72 小时多时间点检测:0.5% 浓度用于急性毒性评估,0.1% 以下进行慢性暴露实验。例如,动物实验中,经静脉给药时丙二醇需控制在 30% 以下,腹腔注射不超过 15%。乙醇浓度超过 2% 可能诱导细胞凋亡[3]。
药物稳定性的多维保障体系
药物制剂的稳定性受物理、化学、环境等多因素影响,需构建综合防护策略,例如:
光降解防控技术:
对含共轭双键结构 (如硝苯地平) 或芳香环结构 (如多柔比星) 的药物,需采用避光方案:原料储存使用黑色玻璃瓶,配制过程在红光安全灯下操作,给药器具选用不透光材料。加速实验表明,透明安瓿中的硝苯地平溶液在日光灯下 6 小时降解率达 12%,而棕色瓶装样品仅降解 1.8%。
温度调控的精准控制:
高温可能引起降解,例如:单克隆抗体类生物制剂在 4℃ 下保存效价衰减率为 0.3%/月,而 25℃ 环境下降解速率提升至 2.1%/月。超低温冻存时应注意玻璃化转变温度 (Tg),推荐使用程序降温仪以 5℃/min 速率降至 -80℃ 后再转入液氮,避免冰晶形成破坏蛋白结构。
精密配制技术的关键突破点
摩尔浓度 (M) 与质量浓度 (mg/mL) 的转换:需准确计算分子量,例如紫杉醇 (分子量 853.9 g/mol) 配制 1 mM 溶液需 0.8539 mg/mL。特别注意结晶水影响:如硫酸镁 (MgSO4•7H2O) 分子量 246.47,而无水物仅 120.37。高精度称量时应采用四级防震天平,相对湿度控制在 40% 以下。对于 ug 级微量样品,建议采用溶液储备法:先配制 10 mg/mL 母液,再进行梯度稀释。
稀释工艺的标准化:系列稀释建议采用几何级数设计,例如抗肿瘤药物筛选通常设置 0.1、1、10、100 μM 四个数量级以覆盖有效浓度范围。
Section.02
助溶方法及其应用研究进展
助溶技术的机理与应用
超声处理:20-40 kHz 的超声波通过空化效应产生微射流,可破碎药物聚集体 (如纳米晶体),适用于制备粒径 <200 nm 的悬浮液。
加热溶解:适度升温可增加分子动能,促进溶剂渗透。
pH 调节:通过调节溶液 pH 至药物 pKa±1.5 范围内,可显著改变其离子化程度。
表面活性剂增溶:非离子型表面活性剂 (如泊洛沙姆) 通过形成胶束增溶疏水药物,临界胶束浓度 (CMC) 是关键参数。
纳米制剂技术
脂质体包裹技术:脂质体由磷脂双分子层构成,可包载亲水性 (内核) 或疏水性 (脂双层) 药物。
环糊精包合技术:环糊精 (CD) 通过疏水空腔包合药物分子,β-CD 及其衍生物 (如羟丙基-β-CD) 应用最广。
Section.03
给药方法及优化策略
药物研发过程中,给药方案的设计直接影响实验结果的可靠性和临床转化的可行性。本部分从体外细胞实验与体内动物实验两个维度,提供了不同给药方法的技术要点及优化策略。
体外给药 (细胞实验)
直接添加法
暴露时间优化
持续暴露 (72 小时):适用于细胞周期非特异性抗肿瘤药物 (如紫杉醇 ),通过维持有效血药浓度抑制有丝分裂[9]。
脉冲给药 (4-24 小时):适用于基因毒性药物 (如顺铂),短时高浓度暴露可模拟临床静脉滴注模式,减少长期培养导致的药物降解[10]。
体内给药 (动物实验)
给药途径选择标准
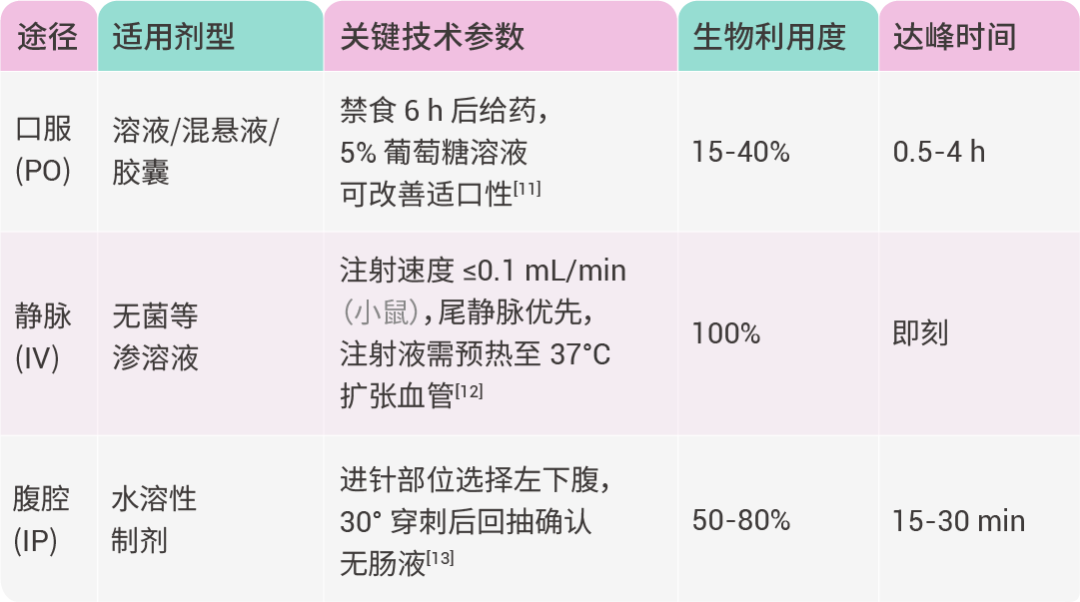
通过表 1 对比三种常用给药途径的技术参数:
产品推荐 |
是一种氨基糖,是糖基化蛋白和脂质生化合成的突出前体,用作膳食补充剂。 |
Ceftriaxone sodium salt (HY-B0712B) 是一种广谱 β-内酰胺类三代头孢菌素类抗生素 (antibiotic),对多种革兰氏阴性菌和阳性菌有良好的抗菌活性。也是 GSK3β 的共价抑制剂。可用于治疗细菌性感染和脑膜炎的研究。 |
是一种非挥发的两性离子化学缓冲剂,广泛应用于细胞培养。也是溶酶体生物发生的有效诱导剂。 |
是一种金属螯合剂 (与包括钙在内的二价和三价金属阳离子结合)。具有抗菌、抗炎、抗氧化、抗高钙血症和抗凝血活性。可减少金属离子催化的蛋白质氧化损伤,并维持蛋白质纯化过程中的还原环境,常用作蛋白质的纯化和储存。能够缓解肝脏的纤维化。可以用于冠状动脉疾病和神经系统疾病的研究。 |
是一种免疫抑制剂,能与亲环素结合,抑制 protein phosphatase 2B (PP2B/calcineurin) 活性的 IC50 值为 7 nM。Cyclosporin A 也抑制 CD11a/CD18 粘附分子。 |
是一种表面活性剂,已被广泛用作药理学实验的溶剂。Tween 80 可以减少细菌附着并抑制生物膜的形成。 |
是维生素 D 的天然存在形式,代谢激活后能诱导细胞分化和癌细胞增殖。 |

[1] Zhang Y. Huo M. PKSolver: An add-in program for pharmacokinetic and pharmacodynamic data analysis in Microsoft Excel. Comput Methods Programs Biomed. 2010 Sep;99(3):306-14.
[2] Galvao J. Davis B. Unexpected low-dose toxicity of the universal solvent DMSO. FASEB J. 2014 Mar;28(3):1317-30.
[3] Hou HH. Cheng SL. Elastase induced lung epithelial cell apoptosis and emphysema through placenta growth factor. Cell Death Dis. 2013 Sep 5;4(9):e793.
[4] Sawaengsak C. Mori Y. Intranasal chitosan-DNA vaccines that protect across influenza virus subtypes. Int J Pharm. 2014 Oct 1;473(1-2):113-25.
[5] Avdeef A. Berger CM. pH-metric solubility. 3. Dissolution titration template method for solubility determination. Eur J Pharm Sci. 2001 Dec;14(4):281-91.
[6] Ezike TC. Okpala US. Advances in drug delivery systems, challenges and future directions. Heliyon. 2023 Jun 24;9(6):e17488.
[7] Freshney. R. I.Culture of animal cells: A manual of basic technique and specialized applications (6th ed.).
[8] Ian A. Cree. Cancer cell culture: Methods and protocols (2nd ed.).
[9] Alley MC. Scudiero DA. Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Res. 1988 Feb 1;48(3):589-601.
[10] Holohan C. Van Schaeybroeck S. Cancer drug resistance: an evolving paradigm. Nat Rev Cancer. 2013 Oct;13(10):714-26.
[11] Mithani SD. Bakatselou V. Estimation of the increase in solubility of drugs as a function of bile salt concentration. Pharm Res. 1996 Jan;13(1):163-7.
[12] Diehl KH. Hull R. European Federation of Pharmaceutical Industries Association and European Centre for the Validation of Alternative Methods. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 2001 Jan-Feb;21(1):15-23.
[13] López-Salesansky N. Mazlan NH. Olfactory variation in mouse husbandry and its implications for refinement and standardization: UK survey of non-animal scents. Lab Anim. 2016 Aug;50(4):286-95.
[14] Kararli TT. Comparison of the gastrointestinal anatomy, physiology, and biochemistry of humans and commonly used laboratory animals. Biopharm Drug Dispos. 1995 Jul;16(5):351-80.
转载本文请联系原作者获取授权,同时请注明本文来自蒲姣姣科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3536222-1500989.html?mobile=1
收藏

