谢正军 李梦 钱梦琪 杨智仁 韩新燕
浙江大学动物科学学院
研究背景
肠道屏障能够阻止外界抗原入侵,在免疫抵抗和宿主生存中起到重要作用。由微生物诱导的细胞信号通路变化会导致黏膜屏障功能、免疫反应和代谢途径发生变化。大多数肠道疾病,如克罗恩病 (CD)、肠易激综合征 (IBS)、腹泻等,都与肠道微生物菌群失调和微生物多样性丧失有关。大量研究表明,益生微生物通过与肠道微生物群相互作用、调节免疫功能、产生抗菌化合物和有机酸以及改善肠道屏障完整性的途径对人体和动物发挥有益作用。益生菌共培养物是将几种不同的益生菌混合发酵得到,往往比单一益生菌或将几种益生菌简单混合发挥更好的效果。
浙江大学韩新燕教授团队以断奶仔猪为试验对象,探究了嗜酸乳杆菌和枯草芽孢杆菌的共培养混合发酵物 (FAM) 对肠道屏障的影响,重点关注了肠道微生物及其代谢、菌群代谢产物与肠黏膜的互作,进而解析其作用机制。
研究过程与结果
选取28日龄断奶仔猪,随机分为3组,分别为基础日粮组、基础日粮添加0.1%FAM组 (FAM由浙江康丸德川科技有限公司提供)、基础日粮添加抗生素组。经过30天试验期,与对照组相比,FAM组和抗生素组仔猪体重显著提高,腹泻发生率降低。肠道微绒毛和线粒体数量增加,肠上皮连接恢复,表明 FAM 或抗生素改善了肠道形态 (图1. A)。FAM组紧密连接蛋白ZO-1和Occludin表达水平提升,杯状细胞数量和MUC2表达增加,肠黏膜PBD-2、PBD-3和RegIIIγ表达显著上调,血清二胺氧化酶活性含量降低 (图1. B、C、D、F)。提示FAM能改善仔猪肠道形态,提高肠道稳态。

图1. FAM对断奶仔猪肠道形态和屏障功能的影响
FAM改善了肠道微生物的结构,提高菌群多样性 (图2A、B)。LEfSe分析显示,FAM显著增加了18个生物标记分类群的相对丰度,包括梭菌目、瘤胃球菌科、厚壁菌门和Muribaculaceae科,降低了22个生物标记分类群的相对丰度,包括猪链球菌属、拟杆菌属和巨单胞菌属 (图2C)。值得注意的是,FAM组表现出较高的Muribaculaceae科丰度,表明FAM可能促进肠道对复杂碳水化合物的降解功能。

图2. FAM对断奶仔猪肠道微生物的影响
为了探究FAM引起肠道微生物变化是否调节其代谢功能,作者基于16S rRNA基因序列进行了肠道微生物的宏基因组功能预测分析,与对照组相比,FAM组KEGG通路18个通路发生了显著变化,其中“丁酸代谢”、“丙酮酸代谢”和“丙酸代谢”的比例显著增加,而“多肽酶”、“鞘磷脂代谢”和“伴侣蛋白和折叠催化剂”的比例显著降低,与抗生素处理的仔猪相比,FAM处理的仔猪中“丁酸盐代谢”、“丙酮酸代谢”、“ABC转运蛋白”、“丙酸盐代谢”和“色氨酸代谢”的比例明显增加,“脂多糖生物合成”和“脂多糖生物合成蛋白”的比例下降 (图3. A-C)。Spearman相关分析显示,厚壁菌门和梭状芽孢杆菌属与“丁酸盐代谢”、“丙酸盐代谢”、“色氨酸代谢”和“脂肪酸代谢”呈正相关,与“脂多糖生物合成”呈负相关。同时,拟杆菌门、软壁菌门和柔膜菌目与“脂多糖生物合成”呈正相关,与“丁酸盐代谢”和“丙酸盐代谢”呈负相关 (图3. D)。
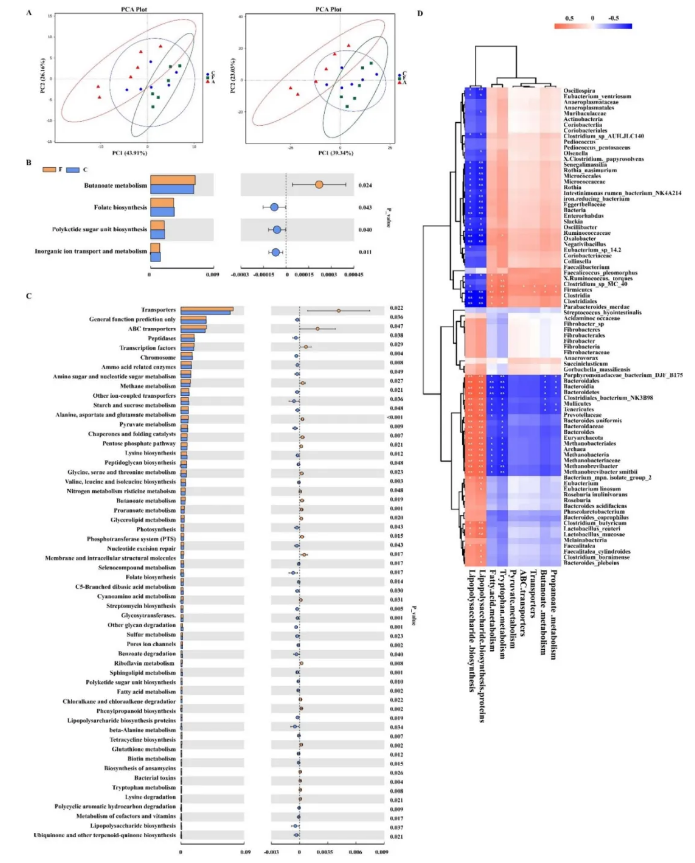
图3. 肠道微生物功能宏基因组学预测和Spearman相关性分析
肠道微生物的变化通常会引起其代谢产物的变化。对肠道内容物进行非靶向代谢组学检测表明,氨基酸代谢、氨酰-tRNA生物合成和短链脂肪酸代谢富集,丁酸盐代谢通路在FAM组和抗生素组间具差异显著。其中,FAM组角鲨烯、棕榈油酸等27种代谢物显著上调 (图4C),尸胺、丙二胺等57种代谢物显著下降,而抗生素组尸胺、顺丁烯二酰亚胺、磷酸乙醇胺等胺类显著高于其他组 (图4D)。

图4. 明显变化的部分代谢物及各组之间的富集分析
为了进一步确认通过以上非靶向代谢组学分析检测到的丁酸盐代谢功能变化,运用基于LC-MS/MS的靶向代谢组检测进一步量化短链脂肪酸 (SCFAs) 浓度,发现FAM组的丁酸和总SCFA含量远高于其他组。SCFAs是膳食纤维中微生物群的主要代谢产物,被认为是调节黏膜免疫和肠道稳态的重要介质。肠黏膜CD4+T细胞、SIgA+细胞和SIgA含量检测显示,FAM增强了黏膜免疫功能 (图5. B-D),且FAM组的促炎因子表达量低于抗生素组,而抗炎基因IL-22表达水平显著提高 (图5. E)。
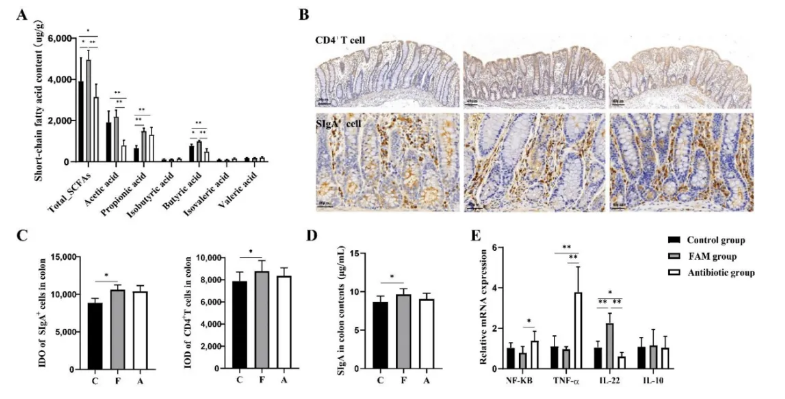
图5. FAM 增强了肠黏膜免疫功能,抑制了炎症反应
上述结果表明,FAM能增强肠道屏障功能,同时提高了肠道菌群代谢产物SCFAs含量。因此作者检测了肠黏膜上SCFAs的下游信号通路“SCFAs-IL-22” 轴相关组分即短链脂肪酸受体GPR43、GPR41和GPR109A的表达。FAM显著增加了GPR43、GPR41和IL-22的蛋白表达量 (图6. A、B)。芳香烃受体 (AhR) 和缺氧诱导因子1α (HIF-1α) 被认为是参与CD4+T细胞通过SCFAs-GPR41-IL-22通路产生IL-22的重要因子,与对照组和抗生素组相比,FAM组AhR和HIF-1α的蛋白表达量明显提高 (图6. B),表明FAM可能通过SCFAs-GPR41-AhR/HIF1αIL-22通路和SCFAs-GPR43-IL-22通路两种途径上调肠道微生物群源性SCFAs并调节CD4+T细胞中IL-22的产生。

图6. 肠黏膜中SCFAs-IL-22通路相关组分的变化
研究结论
综上研究结果,FAM可以改善仔猪肠道形态和肠黏膜免疫功能,其通过调节肠道菌群代谢产物SCFAs含量,激活其下游GPR41 AhR/HIF-1α-IL-22和GRP43-IL-22通路,上调肠黏膜抑炎因子IL-22含量,进而改善肠屏障功能。因此,本研究提供了一种新型益生菌制剂 (FAM) 改善肠道结构和功能的方法,并为帮助了解其在动物或人类体内的潜在作用机制提供新的见解。
原文出自 Nutrients 期刊:https://www.mdpi.com/2072-6643/14/21/4475
期刊主页:https://www.mdpi.com/journal/nutrients
Nutrients 期刊介绍
主编:Maria Luz Fernandez, University of Connecticut, USA; Lluis Serra-Majem, University of Las Palmas de Gran Canaria, Spain
期刊主题涵盖常量营养素、微量营养素、生物活性营养素、运动营养、公共卫生和饮食相关疾病等学科领域。
2023 Impact Factor:4.8
2023 CiteScore:9.2
Time to First Decision:17.5 Days
Acceptance to Publication:2.5 Days


转载本文请联系原作者获取授权,同时请注明本文来自MDPI开放科学科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3516770-1473506.html?mobile=1
收藏

