代谢学人
Cell metabolism:脂肪罢工,神经酰胺是元凶
撰文 | 李姿萱 郭钰涵 闪光余 周文豪 邱瑾
编辑 | 孟美瑶
校对 | 李姿萱
背景介绍
脂肪组织能够调控营养物质的储存和利用,在维持全身代谢稳态方面发挥重要作用。神经酰胺(Ceramides)是鞘脂的前体分子,由鞘氨醇骨架结合酰基辅酶A产生。神经酰胺主要通过从头合成途径产生,并涉及一系列酶促反应,其起始步骤是在丝氨酸棕榈酰转移酶(SPT)催化下,棕榈酰辅酶A与丝氨酸缩合,产生 3-酮鞘氨酸,然后经过一系列反应生成神经酰胺(见下方示意图)。虽然在健康的脂肪细胞中神经酰胺含量较低(因为大部分脂肪酸优先以甘油三酯的形式储存),但营养过剩、炎症等其他代谢应激条件会促进神经酰胺的积累。

神经酰胺从头生物合成途径示意图
ASAH1,酸性神经酰胺酶;CERS,神经酰胺合酶;DES,二氢神经酰胺去饱和酶;KDSR,3-酮二氢鞘氨醇还原酶;SPT,丝氨酸棕榈酰转移酶;UGCG,UDP-葡萄糖神经酰胺葡萄糖基转移酶。
参考文献:Chaurasia B, Summers SA. Annu Rev Physiol. 2021
近期有研究发现,脂肪组织中神经酰胺的积累会损害脂肪细胞的功能,减少神经酰胺的合成或使用加速神经酰胺降解的药物能够改善小鼠的胰岛素抵抗并降低心血管疾病相关指标,同时缓解肝脏脂肪变性(小编注:2019年发表的Science中证明了,脂肪组织中神经酰胺的积累会损害脂肪细胞功能,导致脂质摄取和存储增加,并削弱葡萄糖利用能力,通过脂肪或肝脏特异性敲除Des1(编码二氢神经酰胺去饱和酶,该酶是一种通常在神经酰胺和其他主要鞘脂的主干中插入一个保守的双键发挥作用的酶),可显著改善由瘦素缺乏或HFD饮食引发的胰岛素抵抗和肝脂肪变性(Chaurasia B, Tippetts TS, Mayoral Monibas R, et al. Science. 2019)。在2021年发表的Molecular Metabolism中,作者构建了BAT中敲除神经酰胺合成的关键基因Sptlc2的小鼠模型,以及敲除神经酰胺降解的关键基因Asah1 的小鼠模型,发现敲除Sptlc2 后,能量消耗增加,葡萄糖稳态改善,线粒体密度和大小增加,敲除Asah1 会导致神经酰胺积累、能量消耗减少以及加剧胰岛素抵抗和肥胖,线粒体密度和嵴的密度降低(Chaurasia B, Ying L, Talbot CL, et al. Mol Metab. 2021))。然而,目前有关神经酰胺积累导致损伤的相关机制还存在很大的研究空缺。
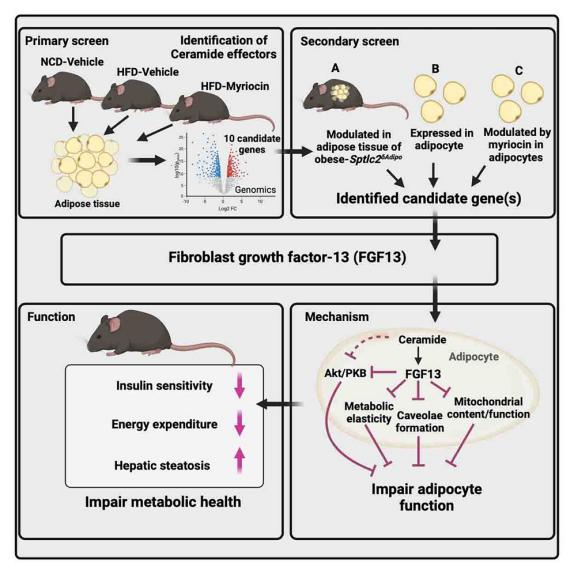
近期,一篇发表在Cell metabolism上的题目为“Ceramide-induced FGF13 impairs systemic metabolic health”的文章发现,FGF13是脂肪组织中受神经酰胺调控的关键基因,神经酰胺能够刺激FGF13的表达,FGF13通过抑制线粒体功能、代谢弹性和小窝形成(小编注:代谢弹性(metabolic elasticity)用于衡量机体在营养或能量状态发生波动(如禁食-再进食)时,代谢相关参数(如血糖、脂质、胰岛素水平)是否能迅速恢复到稳态的能力;小窝(caveolae)是细胞膜上的微小内陷结构,由Caveolin-1(Cav1)和Cavin蛋白构成,富含胆固醇和鞘脂,是胰岛素信号传递、GLUT4转运和脂质摄取的关键结构。高小窝密度代表胰岛素信号高效传导,GLUT4易位至膜表面,促进葡萄糖摄取;低小窝密度代表胰岛素信号受阻,GLUT4无法定位到膜上,导致胰岛素抵抗),影响脂肪细胞的葡萄糖利用和产热能力,而FGF13缺失能够改善能量和葡萄糖稳态,且这些作用独立于神经酰胺。本研究揭示了神经酰胺积累通过诱导FGF13表达损害脂肪细胞功能,导致全身代谢紊乱。

敲黑板啦!
1. FGF13是脂肪组织中神经酰胺调控的关键靶基因
2. 肥胖显著诱导了FGF13的表达
3. 脂肪细胞中的FGF13会影响能量代谢并损害全身代谢健康
4. 脂肪细胞中FGF13能够抑制线粒体功能和小窝形成进而影响脂肪细胞代谢
研究结果
1、FGF13是神经酰胺的靶点
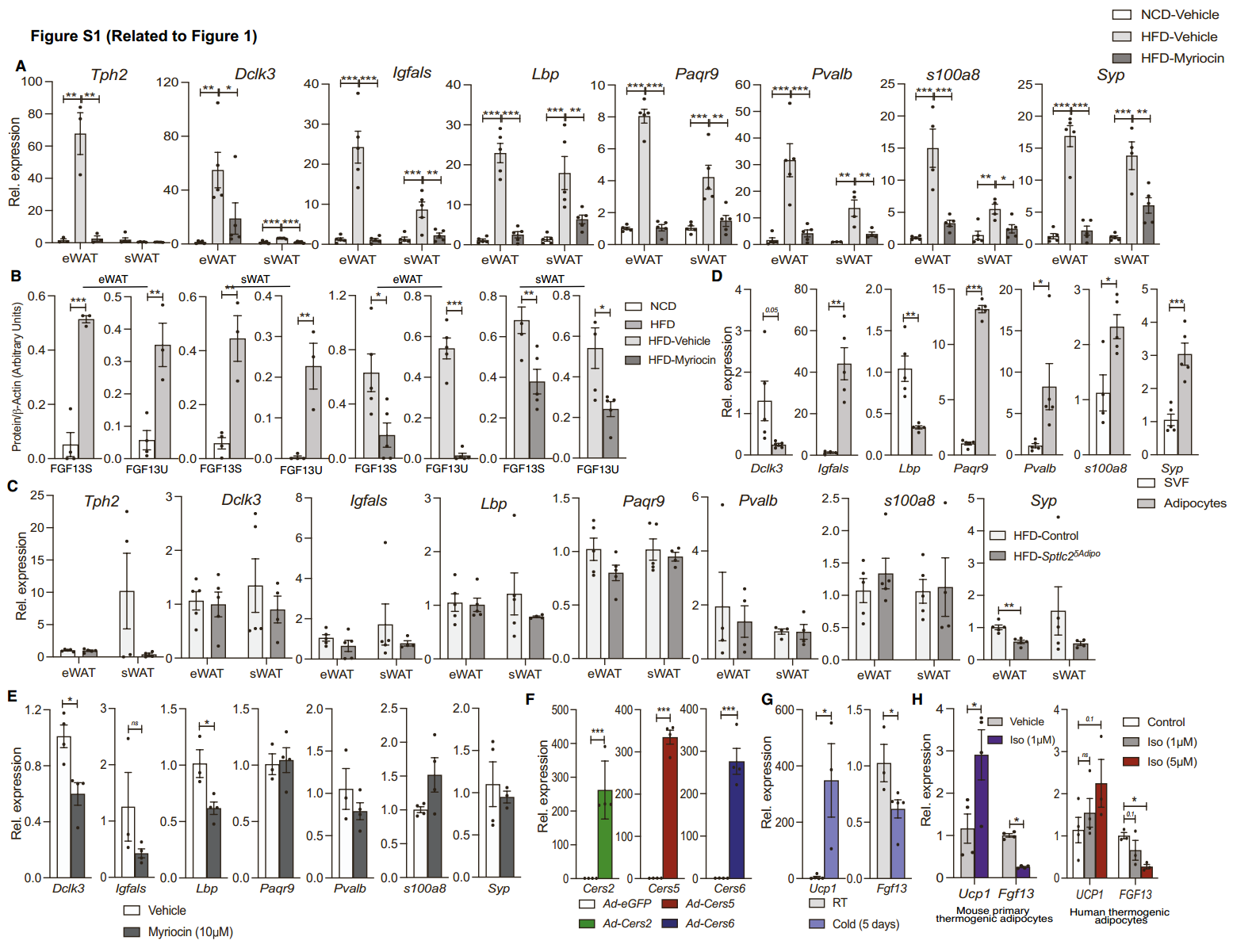
研究人员使用基因组微珠阵列(Genomic Bead Array)技术(小编注:Genomic Bead Array技术是一种用于高密度基因组分析的方法。在玻璃基片上,通过光蚀刻的方法蚀刻出许多个排列整齐的小孔,每个小孔直径约为3μm,这些小孔刚好可以容纳一个微珠,每个微珠的表面偶联了几十万条相同序列的DNA片段。这些DNA片段分成2个功能区域,靠近珠子一侧的23个碱基序列被称为Address序列,是标识微珠的标签序列;远离珠子端的50个碱基被称为探针序列,作用是与目标DNA 进行互补杂交。Address序列与探针序列之间是一一对应的关系。将几十万种微珠按设定的比例混合好,撒到玻璃基片上,微珠随机落入基片的小孔中,通过检测微珠上的DNA碱基延伸时所掺入的dNTP上所带的荧光信号来区别不同的基因,每个等位基因一种颜色。两种颜色的相对强度表示该位点等位基因是杂合还是纯合。 如:用绿色荧光标记C碱基,用红色荧光标记T碱基,如果发出的光为绿色,则是该位点为CC纯合,如果发出的光为红色,则为TT纯合,如果绿色和红色荧光都有,而且光强度差不多,那么该位点则是CT杂合)来筛选出脂肪组织中受神经酰胺调控的基因,结果发现,与NCD小鼠相比,HFD饮食的小鼠的附睾白色脂肪组织(eWAT)和皮下白色脂肪组织(sWAT)中Fgf13表达增加(图1A-1D, S1A-B),注射SPT抑制剂多球壳菌素(myriocin)后),Fgf13表达降低(图1A-1D, S1A-B)(小编注:多球壳菌素,Myriocin,又名ISP-1或Thermozymocidin。是一种真菌来源的鞘脂代谢抑制剂。多球壳菌素能结合SPT(鞘脂合成的限速酶),阻断棕榈酰-CoA与丝氨酸缩合为3-酮二氢鞘氨醇,从而抑制神经酰胺、鞘磷脂等鞘脂的从头合成),在小鼠的脂肪细胞中特异性敲除SPT的一个亚基Sptlc2后,脂肪中Fgf13表达也降低(图1E, S1C)。此外,与HFD-WT小鼠相比,BAT中特异性缺失Asah1的HFD小鼠中BAT中Fgf13的表达升高(图1I)(小编注:Asah1基因编码酸性神经酰胺酶,能够将神经酰胺降解为鞘氨醇和游离脂肪酸,Asah1δUcp1小鼠模型中,神经酰胺在BAT中积累)。同时,研究人员在细胞实验中发现与血管基质组分(SVF)相比,Fgf13在脂肪细胞中高度富集(图1F, S1D),在myriocin处理后,原代脂肪细胞中的Fgf13表达降低(图1G, S1E)。相反,神经酰胺处理原代脂肪细胞能够诱导Fgf13的表达(图1H)。以上数据说明,Fgf13是脂肪组织中受到神经酰胺调控的关键基因。接着,研究人员在原代脂肪细胞中过表达Cers2、Cers5 和 Cers6 后发现,不同链长的神经酰胺种类都能够诱导脂肪细胞中Fgf13的表达(图1J, 1K, S1F)。与小鼠中HFD诱导的FGF13表达结果相似,与瘦人的组织相比,肥胖患者的网膜脂肪组织(omental adipose tissue)的FGF13表达显著增加(图1L)。


基因组微珠阵列(Genomic Bead Array)技术示意图
FGF13是一种胞质内的、非分泌型的FGF超家族成员,可参与许多生理病理过程,如发育、心律失常、神经系统疾病和癌症。然而,FGF13在脂肪细胞功能和代谢性疾病中的作用研究存在很大空缺。目前,FGF13已被发现存在五种不同的亚型:FGF13S, -U, -V, -Y, 和 -VY (图1M),研究人员使用特异性检测FGF13S的抗体或能检测FGF13所有亚型的抗体(pan-FGF13抗体),测定了8周龄NCD小鼠中FGF13剪接变体的组织特异性表达。结果发现,在心脏、大脑、小肠、结肠和肌肉中检测到了FGF13的几种亚型。而在大脑中检测到了FGF13S高表达,在其他器官中FGF13S的表达较低(图1N)。为了确定脂肪组织中主要表达FGF13的哪种亚型,研究人员通过免疫印迹实验比较了NCD和HFD饮食的小鼠脂肪组织表达的FGF13与HEK293细胞过表达 FGF13U、S、V、Y和VY亚型的条带,结果发现,与图1D所示数据一致的是,HFD饮食的小鼠eWAT中FGF13的表达显著高于NCD的小鼠,并且脂肪组织主要表达FGF13S和FGF13U亚型(图1O)。
有研究发现,寒冷暴露和β-肾上腺素激动剂会显著降低神经酰胺水平(小编注:寒冷暴露条件降低脂肪组织中的神经酰胺,参考文献:Schweizer S, Liebisch G, Oeckl J, et al. PLoS Biol. 2019;17(8):e3000412. “β-肾上腺素激动剂会显著降低神经酰胺水平”是在原代棕色脂肪细胞中实验得出的,参考文献:Chaurasia B, Ying L, Talbot CL, et al. Mol Metab. 2021;45:101145.)。由于神经酰胺会诱导脂肪组织中Fgf13的表达(图1B-1K),研究人员将小鼠暴露于低温5天后发现,eWAT中的Fgf13表达降低了约50%(图S1G),用β-肾上腺素激动剂异丙肾上腺素处理也降低了小鼠和人类产热脂肪细胞中Fgf13的表达,同时伴随着产热基因Ucp1表达的升高(图S1H)。这些数据提示FGF13可能参与脂肪细胞的产热或代谢调控。
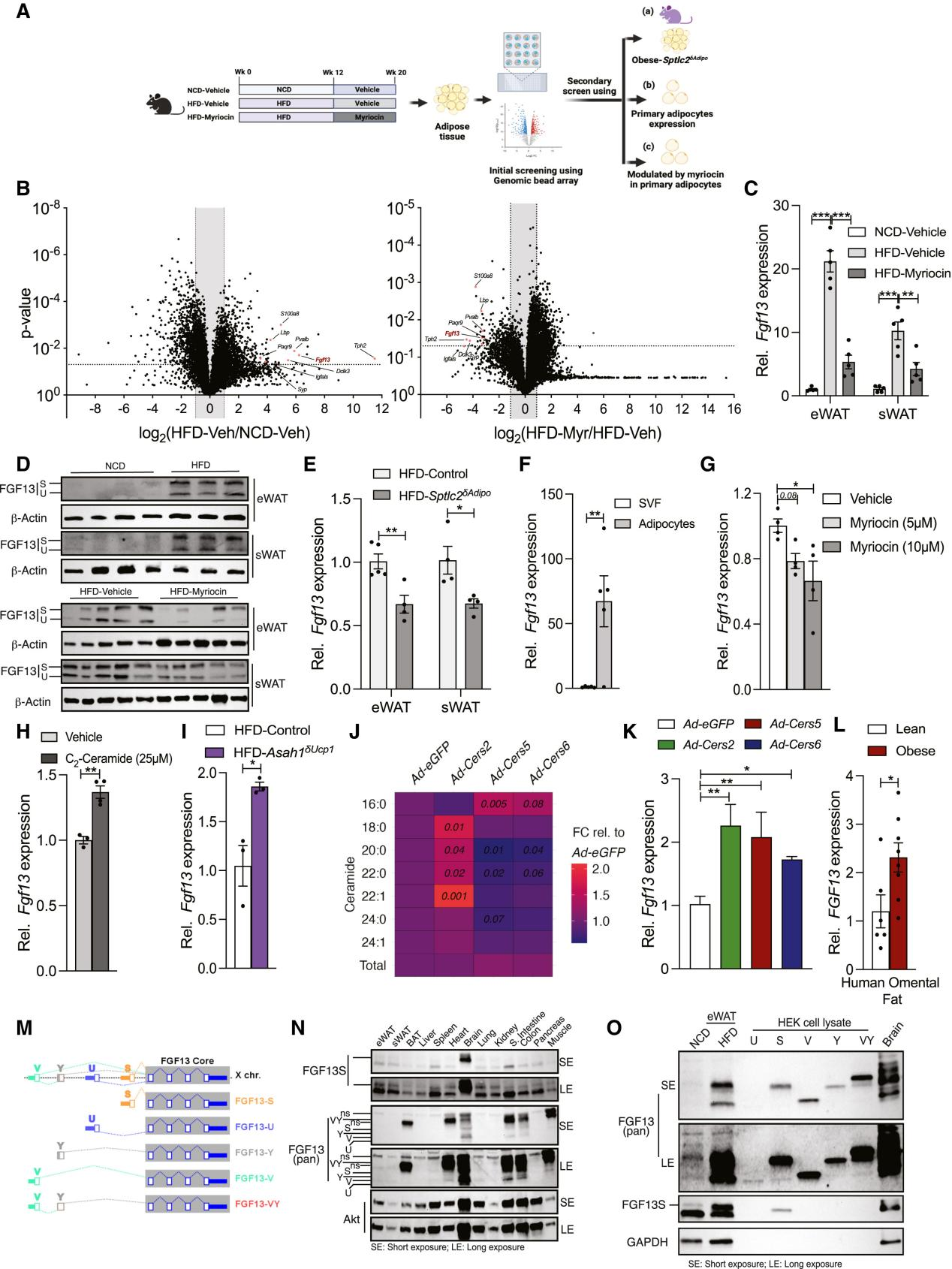
图1. 鉴定FGF13是神经酰胺的靶点
图S1. 脂肪组织中神经酰胺的效应分子的筛选
2、FGF13调节脂肪细胞功能
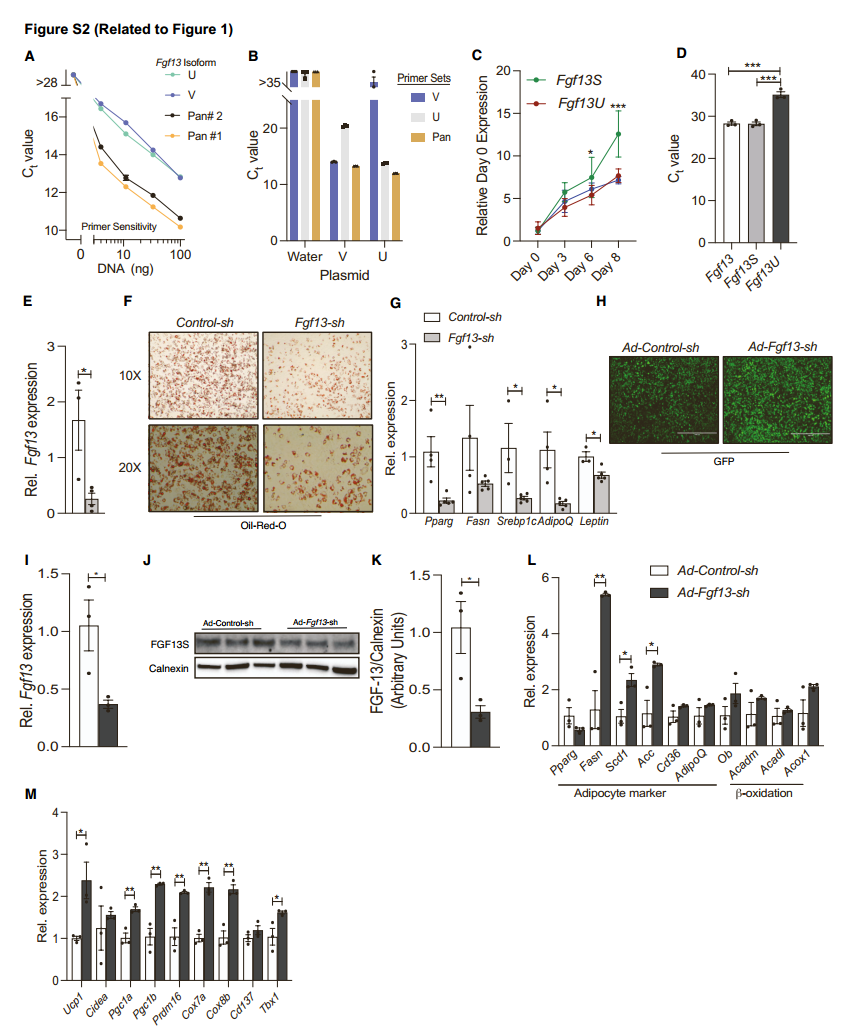
为了探究Fgf13在脂肪细胞代谢中的作用,研究人员首先探究了在3T3-L1细胞分化过程中哪种Fgf13亚型被诱导表达,结果发现,Fgf13S和Fgf13U亚型在脂肪细胞分化第三天就被诱导表达,其中Fgf13S的水平高于Fgf13U(图S2A-S2D)。然后,研究人员用慢病毒敲低3T3-L1细胞中的Fgf13(图S2E),结果发现,敲低Fgf13后,脂肪细胞分化相关基因表达降低,脂质积累减少(图S2F和S2G)。为了探究Fgf13是否影响成熟原代脂肪细胞的功能,研究人员在脂肪细胞分化的第6天通过转染腺病毒敲低Fgf13(图S2H-S2K),结果发现,虽然在3T3-L1脂肪细胞中敲低Fgf13会影响分化,但在成熟原代脂肪细胞中敲低Fgf13并不会影响脂肪细胞分化的基因表达,反而增加了参与脂肪生成基因(如Scd1、Acc)(图S2L)以及线粒体和产热相关基因的表达(图S2M)。这些数据表明FGF13在脂肪细胞中具有自主性,能够调节脂肪细胞的分化和功能。
图S2. 将FGF13鉴定为神经酰胺的效应分子并定义FGF13在脂肪细胞中的作用
3、成年肥胖小鼠中Fgf13的缺失可改善能量和葡萄糖稳态
在小鼠中Fgf13纯合缺失会导致胚胎致死,Fgf13杂合子雌性小鼠(由于Fgf13位于X染色体,只能在雌性中实现杂合)在热中性温度下饲养能够存活,但会表现出肥胖表型。因此,为了探究在成年肥胖小鼠中Fgf13缺失对葡萄糖和能量稳态的影响,研究人员将Fgf13fl/fl小鼠与表达他莫昔芬诱导型Cre重组酶的小鼠进行杂交,产生的 Fgf13iδ小鼠能够在多种组织中诱导Fgf13缺失(图2A, S3A, S3B)。将5至6周龄的Fgf13iδ小鼠及其同窝对照动物(雄性[图2和S3A-S3J]和雌性[图S3K-S3N和S4])进行NCD或HFD饮食7周,在第7周同时注射他莫昔芬,再持续NCD或HFD饮食8周。尽管Fgf13纯合缺失会导致胚胎致死,但在成年小鼠中敲除Fgf13却并没有影响小鼠的存活和健康。喂食NCD 15周后,WT小鼠和Fgf13iδ小鼠体重增加相似,所有的代谢参数几乎均无差异(图2B-2J和S3C-S3J;图S3K-S3N和S4A-S4K)。然而,喂食HFD饮食15周后,与WT雄性小鼠相比,Fgf13iδ雄性小鼠体重增加略有减缓(图2B),肝脏和脾脏重量降低(图2C, S3C, S3D),空腹血糖和胰岛素水平降低,葡萄糖耐量和胰岛素敏感性改善(图2D-2G),能量消耗、VO2和VCO2增加,但RER、活动量和食物摄入量没有差异(图2H和图S3E-S3I);在雌性小鼠中,虽然HFD-WT雌性小鼠和HFD-Fgf13iδ雌性小鼠体重增加相似(图S3K),但HFD-Fgf13iδ小鼠的胰岛素敏感性表现出了一定改善(图S3N和S4A-S4C)。BAT的HE染色证实了敲除Fgf13不影响雄性小鼠BAT中的脂质积累(图2I),但雌性小鼠BAT中的脂质积累减少(图S4J)。无论是雄性还是雌性,与HFD-WT小鼠相比,HFD-Fgf13iδ小鼠的eWAT中脂滴大小没有变化,但在sWAT中脂滴大小显著减小(图2J, S3J, S4J, S4K)。此外,敲除Fgf13后BAT中产热基因表达增加(图2K),eWAT中巨噬细胞标记物Emr1的表达、巨噬细胞的浸润以及炎症基因的表达降低(图2L-2N)。敲除Fgf13显著缓解了HFD雌性小鼠的肝脏脂肪变性(图S4J),部分缓解了雄性小鼠的肝脏脂肪变性(图2I),降低了肝脏中参与脂质合成和摄取以及炎症的部分基因表达(图2O)。总之,这些数据共同说明了在成年肥胖小鼠中全身敲除Fgf13后对代谢有益。
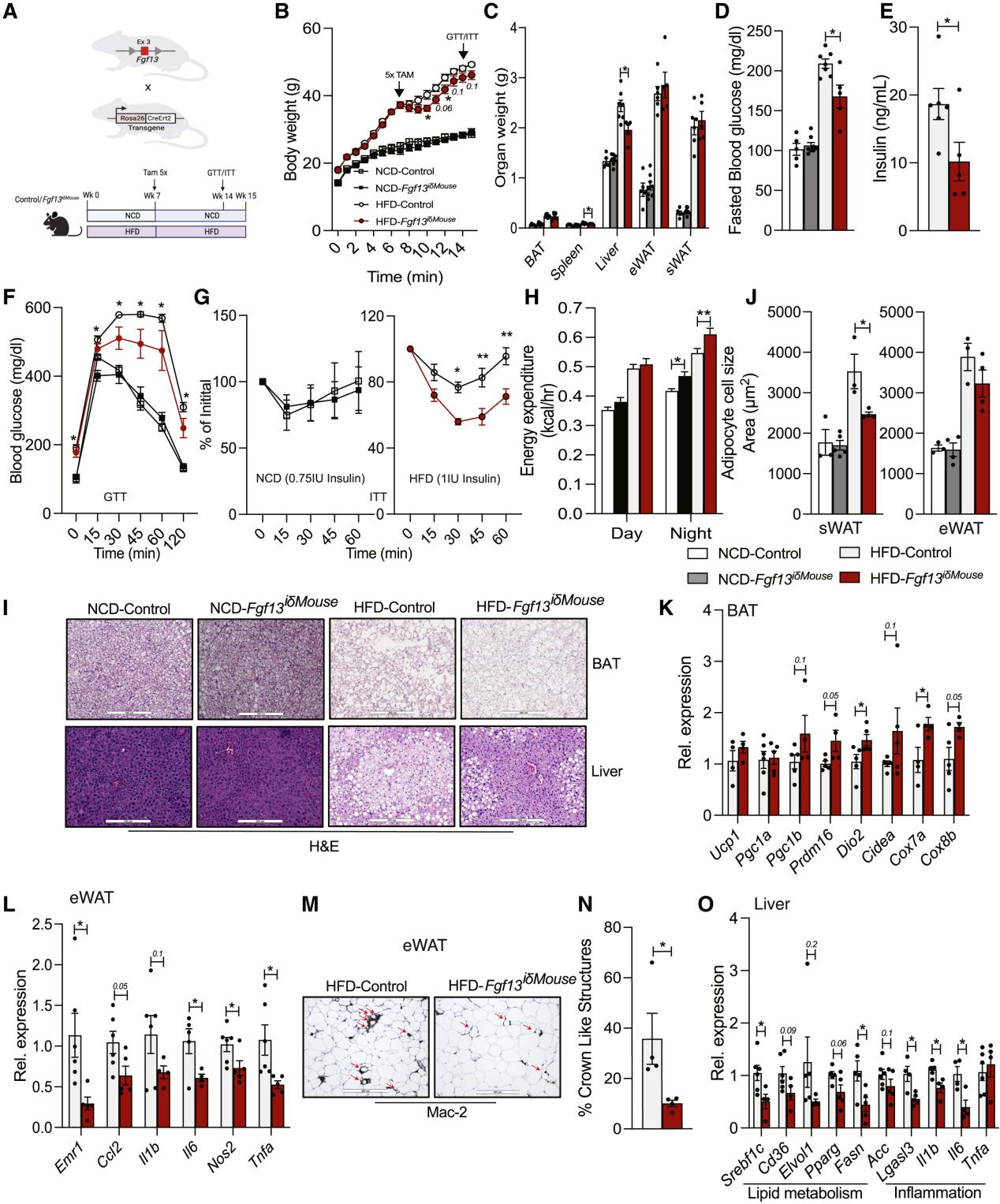
图2. 成年肥胖小鼠Fgf13的全身缺失改善了能量和葡萄糖稳态
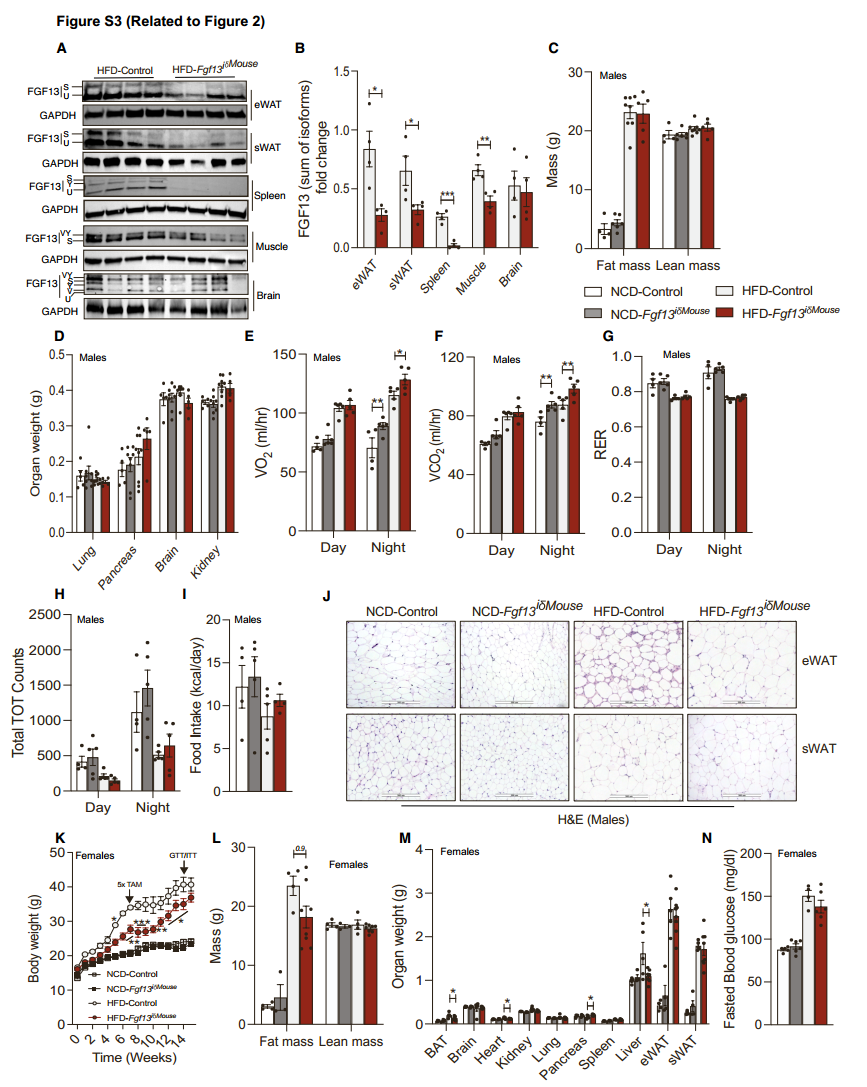
图S3. Fgf13iδ小鼠的代谢表征
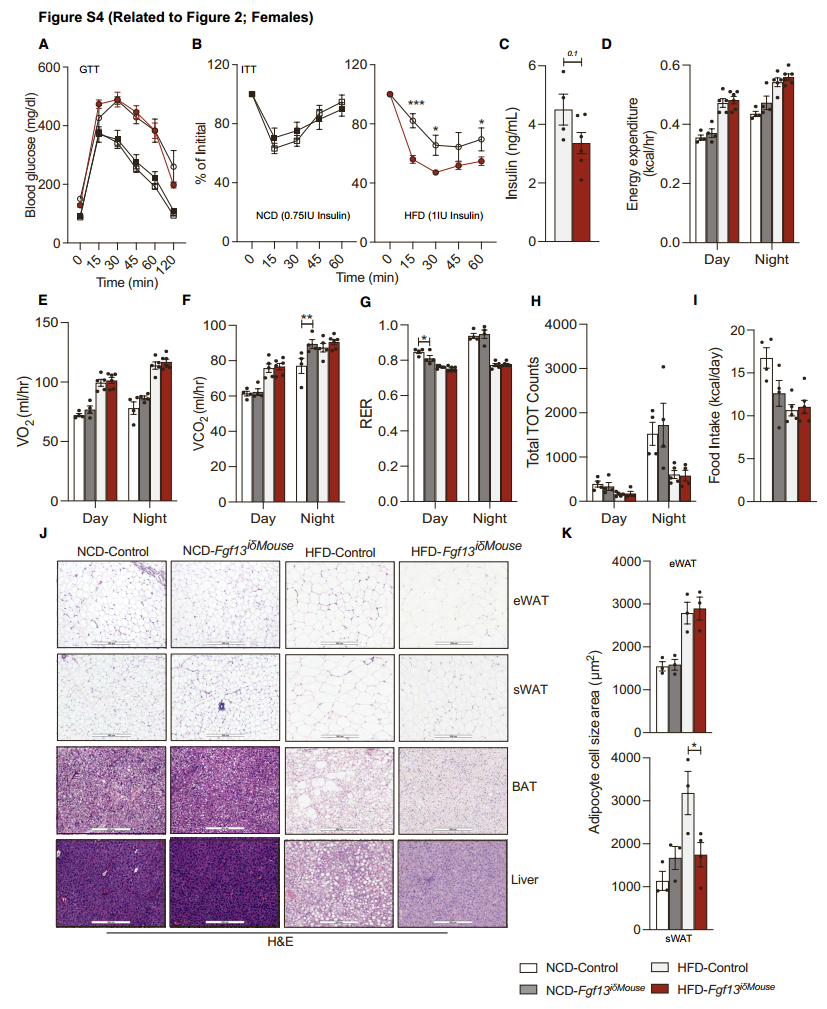
图S4. Fgf13iδ雌性小鼠的代谢表征
4、脂肪细胞中Fgf13的缺失可改善能量和葡萄糖稳态而不改变神经酰胺水平
为了探究在HFD-Fgf13iδ小鼠中观察到的代谢改善是否是由于Fgf13在脂肪细胞中的自主性,研究人员通过将Fgf13fl/fl小鼠与表达由脂联素(adiponectin)启动子控制的Cre重组酶的小鼠杂交,生成了脂肪细胞中特异性缺乏Fgf13的小鼠(Fgf13δAdipo ,图3A)。与Fgf13fl/fl对照小鼠相比,Fgf13δAdipo小鼠脂肪组织中Fgf13的表达降低,其他组织(如心脏和大脑)中Fgf13的表达没有差异(图S5A)。在NCD饮食20周时,WT和Fgf13δAdipo小鼠所有代谢参数没有差异(图3B-3H, 3K, S5B-S5H)。然而,在喂食HFD饮食20周时,Fgf13δAdipo小鼠表现出体重增长减缓、脂肪质量减少、BAT和肝脏重量减轻,eWAT重量增加(图3B-3D)。血清胰岛素和游离脂肪酸(FFA)水平降低,葡萄糖耐量和胰岛素耐受性改善,能量消耗增加(图3E-3J),而RER、活动量和食物摄入量没有差异(图S5C-S5F)。HE染色显示,脂肪组织中Fgf13的缺失减少了BAT中的脂质积累并缓解了肝脏脂肪变性,但没有改变eWAT和sWAT中的脂肪细胞大小(图3K, S5G, S5H)。HFD-Fgf13δAdipo小鼠的eWAT中巨噬细胞标记物Emr1和Lgals3的表达降低、巨噬细胞浸润减少,Tnfa等炎症标志基因表达降低(图3L-3O)。有趣的是,HFD-Fgf13δAdipo小鼠代谢表型的改善与脂肪组织和血清中神经酰胺和其他鞘脂的变化无关(表S2),这表明Fgf13位于神经酰胺的下游。此外,与喂食HFD的WT小鼠相比,喂食HFD的Fgf13δAdipo小鼠肩胛间区域温度升高约2℃,并且在BAT和sWAT中产热基因和UCP1蛋白表达增加(图3P-3R和S5I-S5J),而脂肪分化标志基因没有影响,参与β-氧化和脂肪分解的部分基因在BAT和sWAT中也表达增加(图S5L和S5M)。此外,Fgf13δAdipo小鼠表现出更强的耐寒能力,这与sWAT中米色脂肪细胞的增加以及BAT中UCP1表达升高相关(图S5N和S5O)。这些数据表明在脂肪细胞中敲除FGF13会增加产热。

图3. 脂肪细胞中Fgf13的缺失会改善能量代谢和葡萄糖稳态

图S5. Fgf13δAdipo小鼠的代谢表征
5、在UCP1+的产热脂肪细胞中敲除Fgf13可改善能量消耗
接下来,研究人员想要探究在Fgf13δAdipo小鼠中观察到的产热增加是否是由于FGF13直接作用于UCP1阳性产热脂肪细胞,结果发现,Fgf13在瘦小鼠的BAT中几乎不表达,但在肥胖小鼠中表达升高(图1N和4A)。因此,研究人员将Fgf13fl/fl小鼠与在UCP1启动子控制下表达Cre重组酶的小鼠杂交,生成了仅在UCP1阳性脂肪细胞中特异性敲除Fgf13的小鼠(Fgf13δUcp1,图4B)。与HFD饮食的WT小鼠相比,Fgf13δUcp1小鼠体重增长减缓,脂肪质量减少,BAT、sWAT和肝脏的重量减少(图4C-4E和S6A),葡萄糖稳态和胰岛素敏感性改善(图4F-4H),并且这种变化胰岛素水平无关(图S6B),同时发现Fgf13δUcp1小鼠能量消耗增加,但RER、活动量和食物摄入量不变(图4I, 4J和S6C-S6E)。HE染色显示,与对照小鼠相比,Fgf13δUcp1小鼠BAT中的脂质积累减少,缓解了肝脏脂肪变性,并且不影响eWAT和sWAT的脂滴大小(图4K, S6F, S6G)。此外,Fgf13δUcp1小鼠肝脏中脂质积累标志基因的表达降低(图4L),脂肪组织中巨噬细胞浸润减少,部分炎症基因的表达降低(图S6H-S6J)。与WT小鼠相比,Fgf13δUcp1小鼠BAT表面温度更高,产热相关基因、β-氧化和脂肪分解的标志基因表达增强(图4M-4Q),而脂肪分化标志基因表达没有差异(图S6K)。
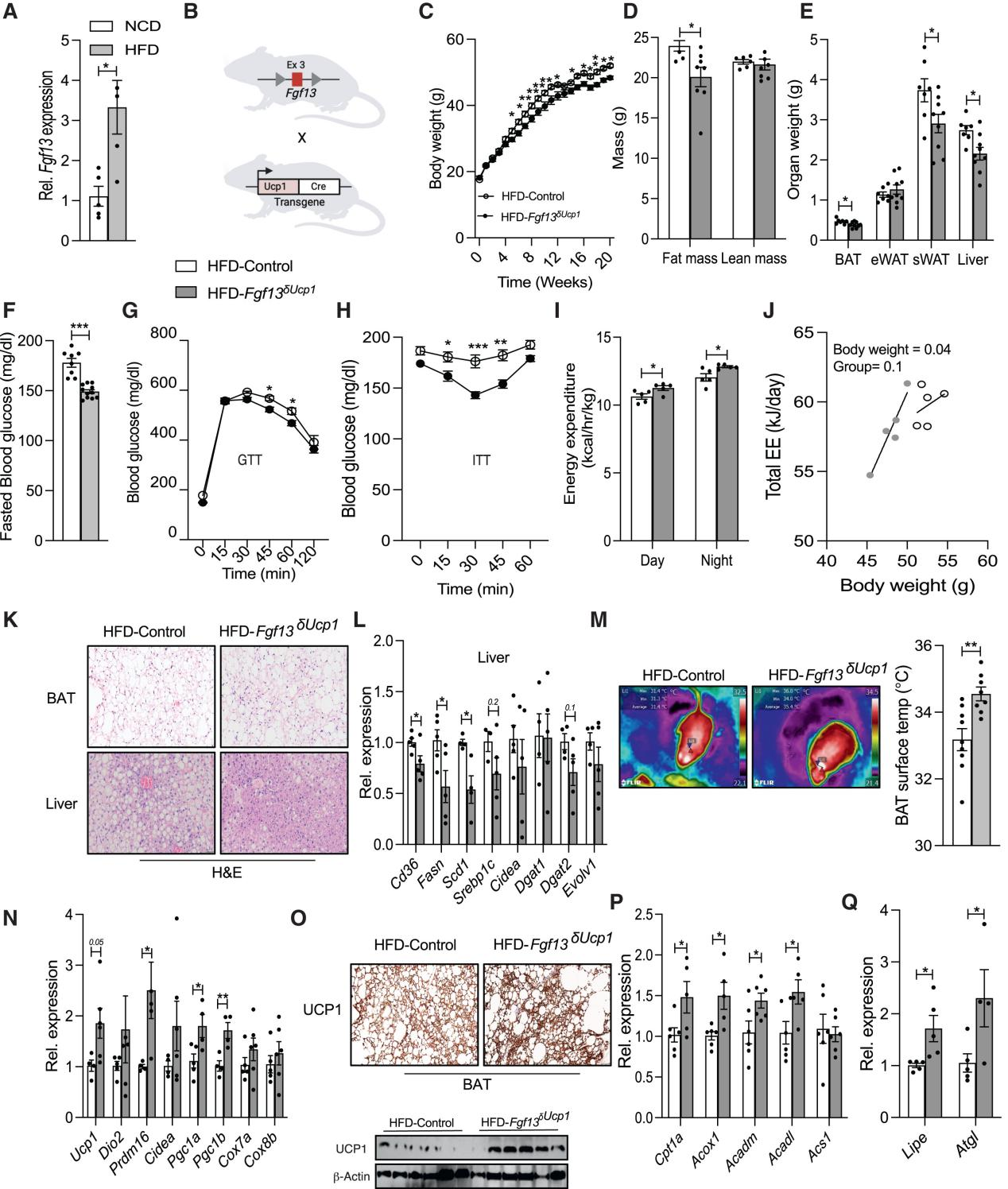
图4. UCP1+产热脂肪细胞中Fgf13的缺失会改善能量和葡萄糖稳态
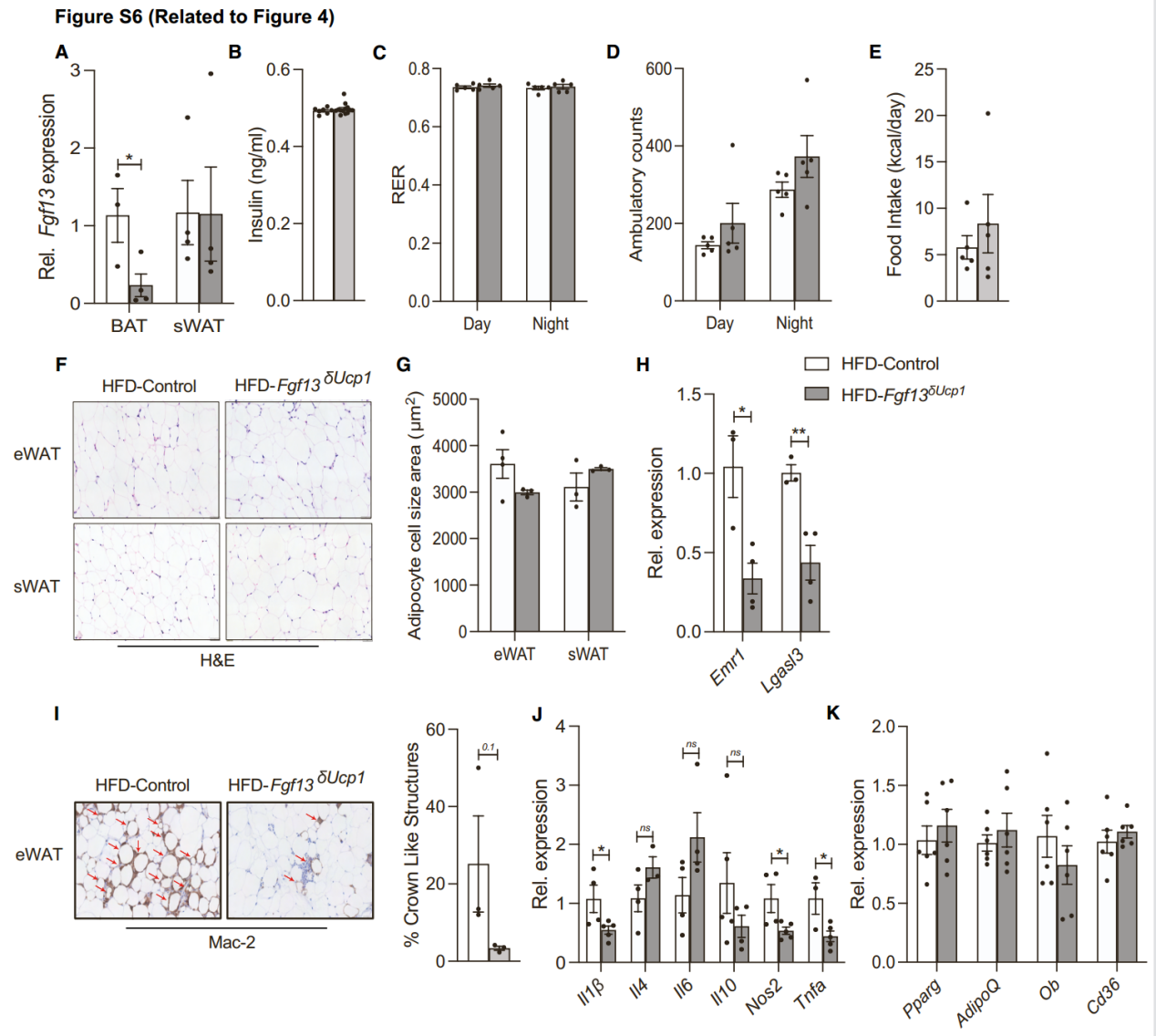
图S6. UCP1+产热脂肪细胞中Fgf13的缺失增加了产热并减少了脂肪组织炎症
6、在肥胖小鼠成熟脂肪细胞中敲除Fgf13可以改善葡萄糖代谢
为了探究Fgf13在成熟脂肪细胞中的作用,并排除Fgf13对脂肪细胞分化可能产生的潜在干扰,研究人员将Fgf13fl/fl小鼠与在脂联素启动子下表达他莫昔芬诱导型Cre重组酶的小鼠杂交(图5A上方),产生Fgf13iδAdipo小鼠。对照组和Fgf13iδAdipo小鼠进行HFD饮食8周,并连续5天注射他莫昔芬以在脂肪细胞中敲除Fgf13,然后喂食HFD 12周(图5A下方)。由于该 Adipo-Cre小鼠品系在BAT中的重组效率较低,这种敲除措施使得eWAT和sWAT中Fgf13表达显著降低,但BAT中没有明显降低(图S7A)。与对照小鼠相比,在成熟的白色脂肪细胞中敲除Fgf13不影响体重、体脂和组织重量(图5B, S7B, S7C),在能量消耗、RER、活动量和食物摄入量方面也没有差异(图S7D-S7G),但是空腹和餐后血糖降低,葡萄糖耐量和胰岛素敏感性改善(图5C-5E)。研究人员进行了高胰岛素-正葡萄糖钳夹试验(小编注:高胰岛素-正常血糖钳夹(Hyperinsulinemic-Euglycemic Clamp, HEC) 是目前评估胰岛素敏感性的金标准,通过持续输注胰岛素,同时输注葡萄糖以维持血糖稳定,从而精确测定胰岛素刺激下的葡萄糖处置能力),与上文的实验方案类似,对照组和Fgf13iδAdipo小鼠均喂食HFD 8周,注射他莫昔芬,同时继续进行HFD饮食12周(图5F),结果发现,对照组和Fgf13iδAdipo小鼠基础和钳夹状态下的胰岛素水平相似(图5I),但与对照组相比Fgf13iδAdipo小鼠需要更高的葡萄糖输注率(GIR)以维持血糖稳态(图5G, 5H, S7K),并抑制了肝脏葡萄糖生成(HGP)(图5J),而两组小鼠的葡萄糖清除率未改变,但Fgf13iδAdipo小鼠eWAT、sWAT和肌肉中的葡萄糖摄取增加(小编注:在高胰岛素-正葡萄糖钳夹试验中,实验组小鼠需要输注更多的葡萄糖维持稳态,组织葡萄糖摄取增加的同时其血液中总体葡萄糖水平已经被抬高,在计算葡萄糖清除率时计算公式为葡萄糖吸收量除以血液葡萄糖总量,吸收量与总量都提升的情况下可能会出现葡萄糖清除率不变的现象)(图5K和S7L)。组化实验结果表明,敲除Fgf13缓解了肝脏脂肪变性(图5L),但不影响脂滴大小和脂肪细胞分化标志基因的表达(图5L和S7M-S7O),巨噬细胞浸润减少,巨噬细胞标志基因Emr1和Lgals3和炎症相关基因表达降低(图5M-5O)。总之,这些数据表明,在成熟脂肪细胞中敲除FGF13改善了脂肪组织功能和全身胰岛素敏感性,并且这种改善与体重和能量消耗的变化无关。
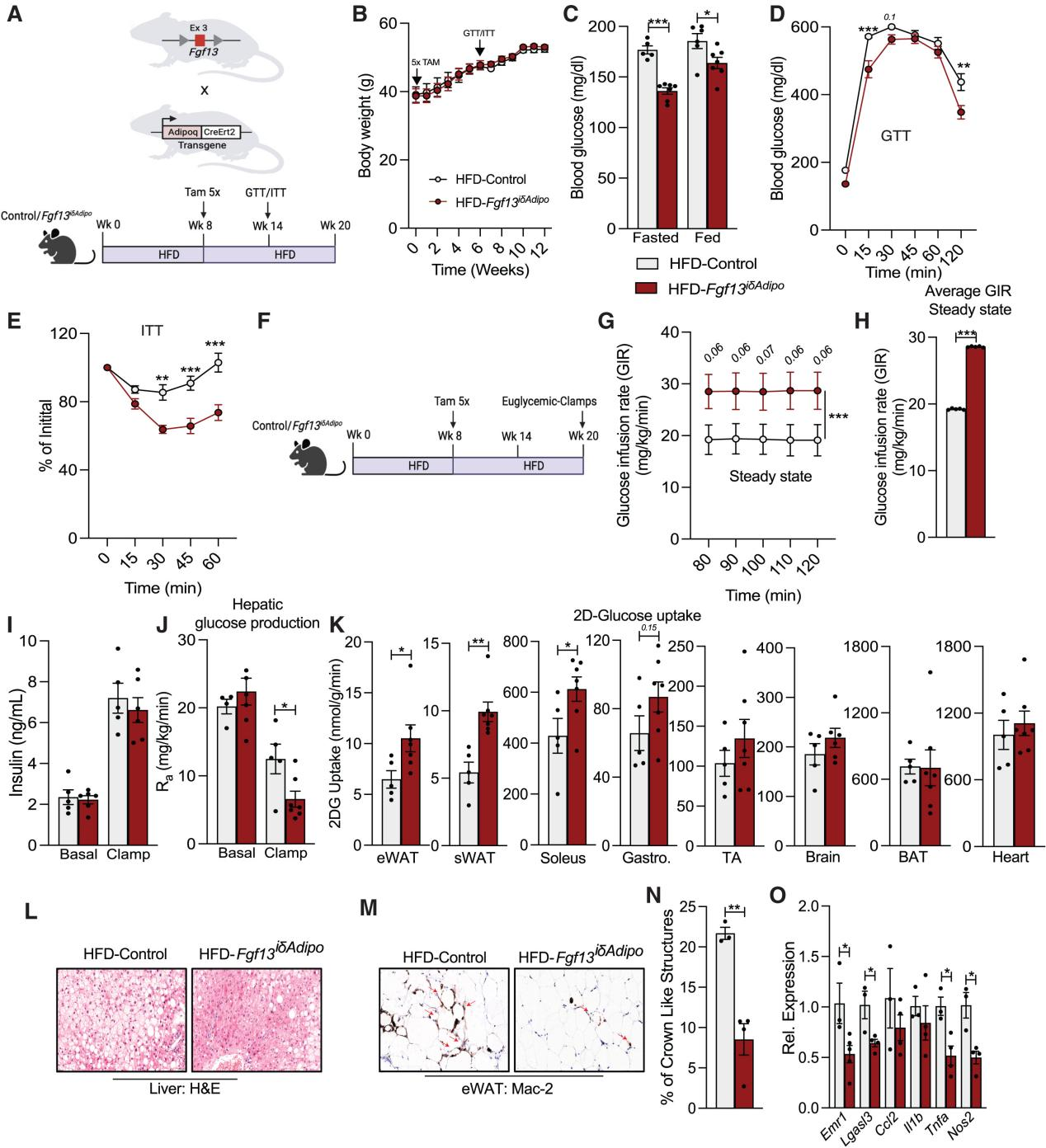
图5. 成年肥胖小鼠脂肪细胞中Fgf13的敲除能够改善葡萄糖稳态并缓解肝脏脂肪变性和脂肪组织炎症
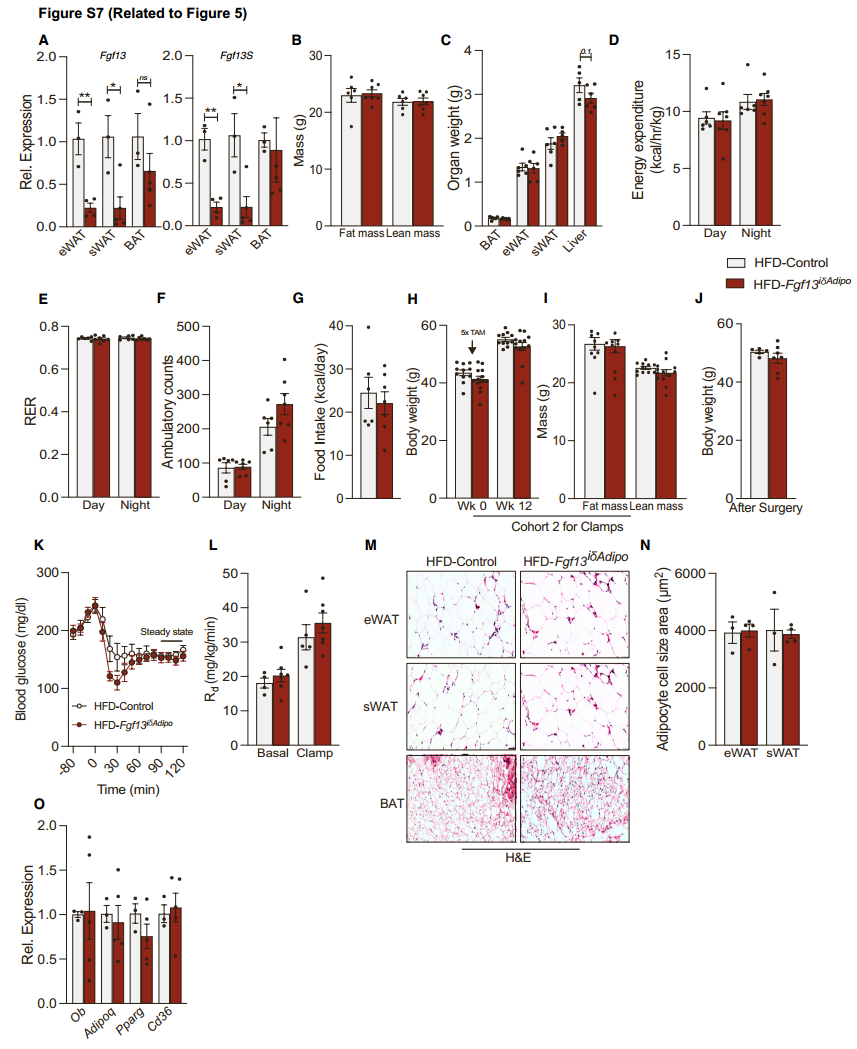
图S7. 脂肪细胞Fgf13缺失小鼠的代谢表型
7、脂肪细胞FGF13足以损害全身胰岛素敏感性
上述实验结果说明,FGF13是脂肪组织中神经酰胺的关键下游效应分子。为了探究在NCD饮食的情况下,FGF13是否会导致机体代谢功能障碍,研究人员构建了过表达人源FGF13的小鼠品系。同时由于FGF13S亚型在脂肪细胞中表达较高,并且HFD饮食能够诱导FGF13S的表达(图1C和1D),因此研究人员将FGF13S作为研究对象,使用诱导型四环素反应元件(TRE)来构建TRE-FGF13S转基因小鼠。为了选择性地在脂肪细胞中诱导FGF13S表达,研究人员将TRE-FGF13S小鼠与在脂联素启动子下游携带反向四环素依赖性转录激活因子(Adipoq-rTTA)的小鼠杂交,构建TRE-FGF13S-Adipoq-rTTA(FGF13STgAdipo)小鼠(图6A)。4周龄的TRE-FGF13S和FGF13STgAdipo(雄性[图6和S8A-S8K]和雌性[图S8L-S8W])小鼠被喂食含有多西环素的普通饲料(NCD-Dox)12周,以选择性地诱导脂肪细胞中FGF13S的表达。结果显示,FGF13STgAdipo小鼠的eWAT和sWAT中FGF13S蛋白增加了约3-4倍,但在BAT中FGF13S的表达没有增加(图6B, S8A, S8B)。并且过表达FGF13S不影响体重,但脂肪质量与瘦体质量的比例增加,并且eWAT和sWAT的重量有所增加(图6C, 6D, S8C)。虽然过表达FGF13S不影响能量消耗、RER、活动量和食物摄入(图S8D-S8I),但空腹血糖和胰岛素水平增加,葡萄糖耐量和胰岛素敏感性受损(图6E-6H和S8J,图S8L-S8W)。在FGF13STgAdipo小鼠的脂肪组织中,巨噬细胞标志基因和部分炎症基因的表达升高(图6I)。eWAT和sWAT脂滴大小增加(图6J)。总之,这些数据表明脂肪细胞中的FGF13S会损害脂肪细胞功能和全身葡萄糖代谢。
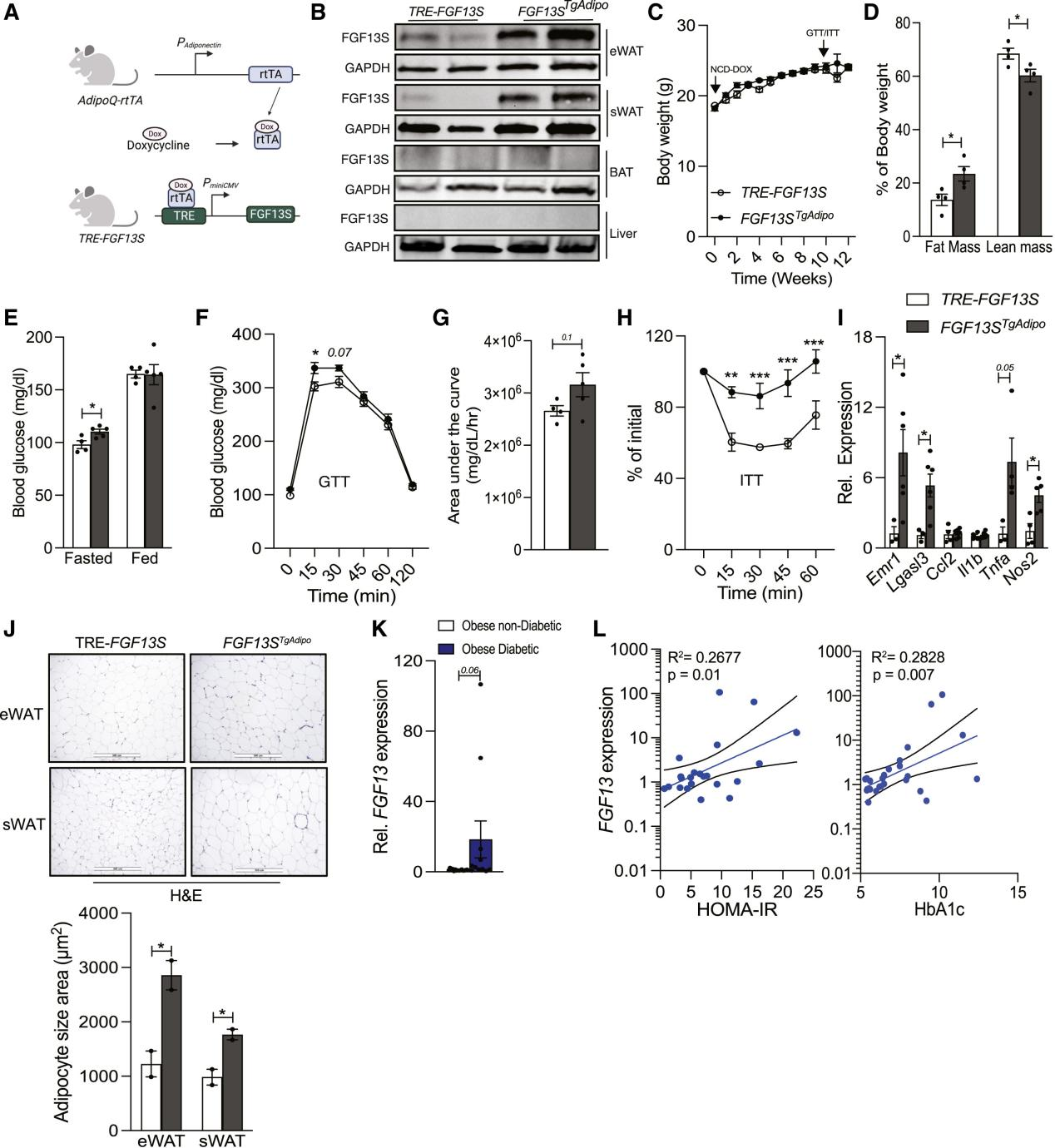
图6. 脂肪细胞FGF13会影响葡萄糖稳态,并且与HOMA-IR和HbA1c相关
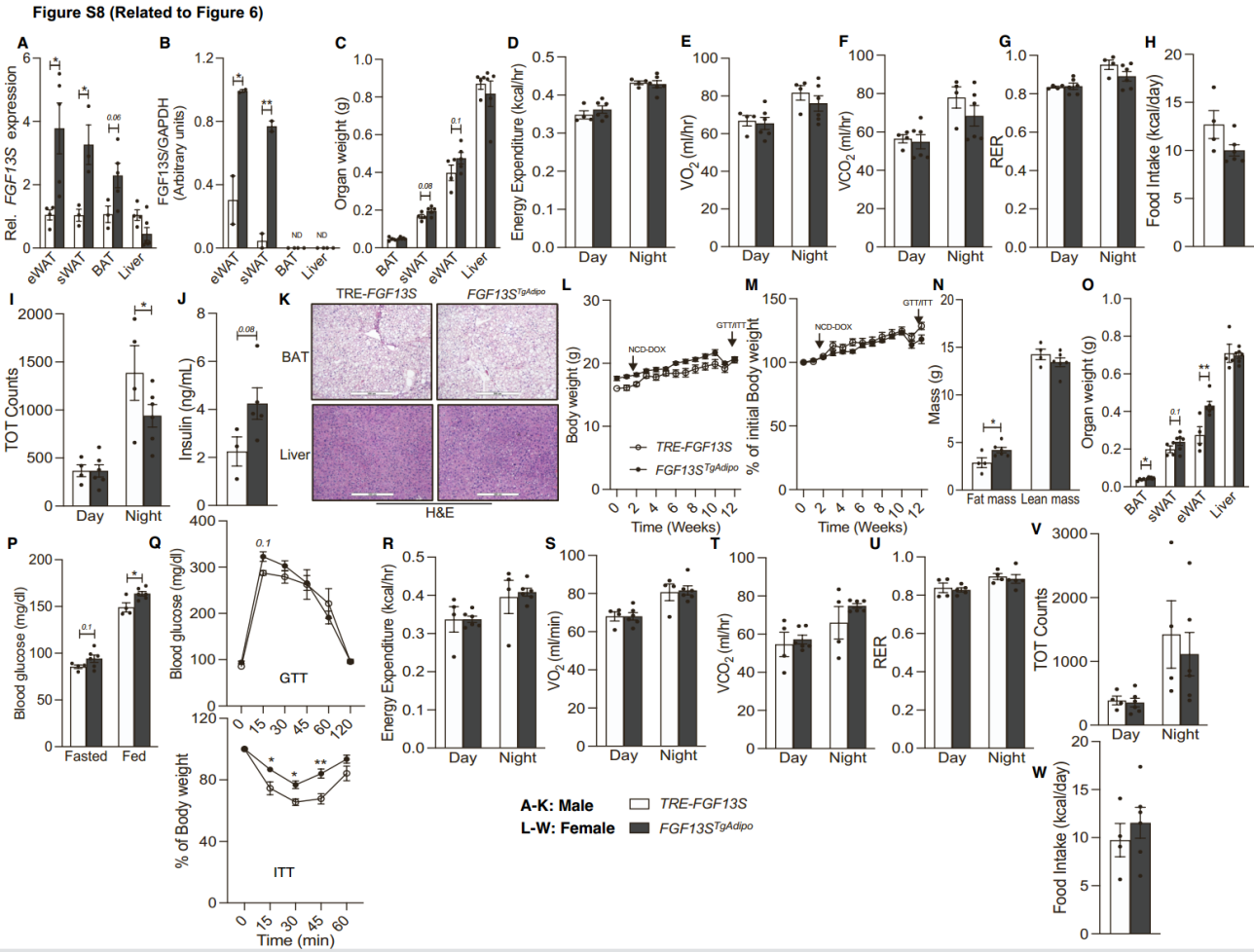
图S8. 脂肪细胞中Fgf13S过表达的雄性小鼠代谢表型
8、FGF13在肥胖和2型糖尿病患者的脂肪组织中表达增加,并且与HOMA-IR和HbA1c呈正相关
接下来,研究人员检测了来自多种族和不同性别的患有或不患有2型糖尿病的肥胖患者网膜脂肪组织中FGF13的表达,结果显示,在患有2型糖尿病的肥胖患者中,FGF13的表达升高了约20倍(图6K)。此外,研究人员还发现在这个群体中,FGF13的表达与胰岛素抵抗稳态模型评估(HOMA-IR)和糖化血红蛋白(HbA1c)呈正相关(图6L)(小编注:胰岛素抵抗的稳态模型评估是一种基于空腹血糖和胰岛素水平的计算模型,用于评估基础状态下的胰岛素敏感性。计算公式是:HOMA-IR=空腹胰岛素 (μU/mL)×空腹血糖 (mmol/L)/ 22.5)。总之,内脏脂肪组织中FGF13的高表达与血糖指标相关,并可能预示着脂肪组织健康受损。
9、脂肪细胞FGF13影响线粒体功能、代谢基因弹性和小窝密度
为了探究FGF13调节脂肪细胞功能的机制,研究人员对来自HFD对照组小鼠和HFD-Fgf13δAdipo小鼠的BAT、eWAT和sWAT,以及来自HFD对照组和HFD-Fgf13iδAdipo小鼠的eWAT和sWAT进行了RNA-seq分析,来确定敲除Fgf13后不同脂肪组织中共同受到调控的通路。结果显示,敲除Fgf13后,线粒体生物学以及脂肪酸生物合成和氧化通路在所有脂肪组织中均被正向富集,炎症和细胞因子通路则被负向富集(图7A)。在所有脂肪组织中调节通路的重叠表明,Fgf13调控脂肪细胞代谢和功能的分子机制在不同的脂肪组织中是保守的。
接下来,为了探究线粒体相关通路的富集是否在线粒体和脂肪酸生物合成及氧化相关的代谢物上也能体现出来,研究人员对从HFD对照组和HFD-Fgf13iδAdipo小鼠中分离的eWAT进行了靶向代谢组分析。研究人员分析了123种代谢物,结果显示,线粒体和脂肪酸生物合成及氧化是最显著富集的通路之一(图7B和S9A),许多涉及线粒体和脂肪酸代谢的代谢物发生显著改变(图S9A)。透射电子显微镜显示,HFD-Fgf13δAdipo小鼠的BAT线粒体密度和大小增加(图7C-7E)。为了验证在原代脂肪细胞中敲除FGF13是否会影响线粒体功能,研究人员在完全分化的原代脂肪细胞中敲低FGF13,结果发现,敲低FGF13后显著增加了线粒体的基础呼吸、最大呼吸和解偶联呼吸(图7F-7H)。重要的是,尽管神经酰胺处理抑制了对照组小鼠原代脂肪细胞的线粒体呼吸,但在敲除FGF13后完全消除了神经酰胺对基础呼吸和解偶联呼吸的抑制作用(图7G和7H)。最近有研究表明,线粒体的神经酰胺的积累会降低线粒体辅酶Q(CoQ)水平并损害线粒体功能(小编注:2023年发表在Elife上的一篇文章(DOI: 10.7554/eLife.87340)发现棕榈酸会诱导线粒体神经酰胺的积累以及CoQ水平的下降,同时线粒体神经酰胺的积累所导致的胰岛素抵抗是因为线粒体CoQ水平下降所引起的,同时上述这些效应也引起线粒体功能损坏),因此研究人员检测了在脂肪细胞中敲除FGF13对线粒体CoQ9(小鼠特异性CoQ)的影响,结果发现,虽然在脂肪细胞中敲除FGF13不改变线粒体中神经酰胺的含量(图S9B),但增加了线粒体CoQ9水平(图7I)。总之,这些研究表明,在脂肪细胞中敲除FGF13能够减轻神经酰胺对线粒体功能的损伤。
肥胖会损害脂肪组织的代谢弹性,即脂肪组织根据生理信号利用碳水化合物或脂质的能力。近期有研究证明,这种“代谢弹性(metabolic elasticity)”是通过20个特定基因的协调适应来实现的。研究人员发现在Fgf13δAdipo小鼠(图7J)和Fgf13iδAdipo小鼠(图S9C)中,eWAT中约75%的代谢弹性基因、sWAT中约50%代谢弹性基因的表达得到了显著恢复,表明在敲除FGF13后,脂肪组织的代谢弹性得到了恢复。
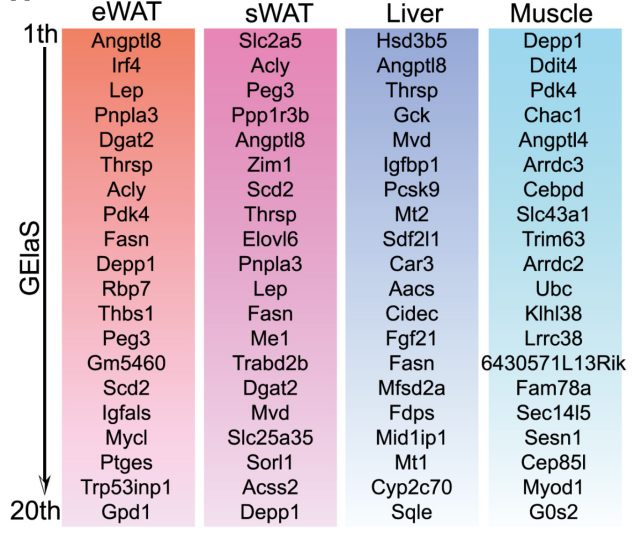
每个代谢器官中排名前 20 位的弹性基因
参考文献:Zhou Q, Yu L, Cook JR, Qiang L, Sun L. Cell Metab. 2023
脂肪细胞膜上的小窝(caveolae)是调节胰岛素信号转导和脂质摄取的关键结构。为了探究FGF13是否可能通过调节脂肪组织中的小窝形成来调控营养物质的储存和利用,研究人员观察到,在HFD对照组和Fgf13iδAdipo小鼠的脂肪组织差异表达基因中,许多参与小窝形成的基因,如Cav1、Cav2、Cavin1、Cavin2和Cavin3,在Fgf13δAdipo小鼠(图7K)和Fgf13iδAdipo小鼠(图S9D,S9E)的eWAT和sWAT中表达升高。因此,研究人员探究了在脂肪组织中敲除Fgf13是否会改变Cavin1和Cav1的表达,这两种蛋白是小窝形成所必需的,并且在脂肪组织中含量丰富。虽然来自两种小鼠的eWAT中Cavin1表达都升高,但只有Fgf13δAdipo小鼠Cav1表达增加。相比之下,在Fgf13STgAdipo小鼠的eWAT中,Cavin1和Cav1的表达降低(图7L和S9F-S9H)。在完全分化的原代脂肪细胞中敲除或敲低Fgf13会增加Cavin1的表达(图7M, S9I, S9J)。eWAT透射电镜结果显示,HFD-Fgf13δAdipo小鼠和Fgf13iδAdipo小鼠的eWAT中小窝密度增加,而Fgf13STgAdipo小鼠的小窝密度降低(图7N, 7O, S9K, S9L)。相比之下,在肌肉中没有观察到这种变化(图S9K, S9L)。因此,FGF13能够负向调节脂肪细胞中的小窝密度。
研究人员进一步探究了Fgf13的缺失是否能够通过增强胰岛素信号传导来调节脂肪细胞中的葡萄糖代谢。结果发现,在原代脂肪细胞中敲除Fgf13增强了胰岛素刺激的Akt磷酸化,用小窝抑制剂MβCD处理后这种作用被完全消除(图7P和S9M)。此外,与对照组小鼠相比,虽然来自HFD-Fgf13δAdipo小鼠的eWAT和sWAT表现出Akt磷酸化升高,但来自Fgf13STgAdipo小鼠的eWAT显示出Akt磷酸化降低,而在sWAT和BAT中则没有差异(图S9O, S9P)。有研究证明,神经酰胺能够抑制胰岛素刺激的Akt磷酸化,从而损害葡萄糖摄取和代谢,因此研究人员探究了在脂肪细胞中敲除Fgf13是否能够消除神经酰胺对Akt磷酸化的影响,结果发现,虽然神经酰胺抑制了胰岛素刺激的Akt磷酸化,但神经酰胺的这些效应并没有因Fgf13的缺失而改变(图7Q和S9N)。此外,无论是神经酰胺还是敲除Fgf13都不影响胰岛素受体的磷酸化(图7Q和S9N)。总之,这些数据表明,虽然在脂肪细胞中敲除Fgf13增加了胰岛素刺激的Akt磷酸化,但FGF13的这些作用与神经酰胺无关。
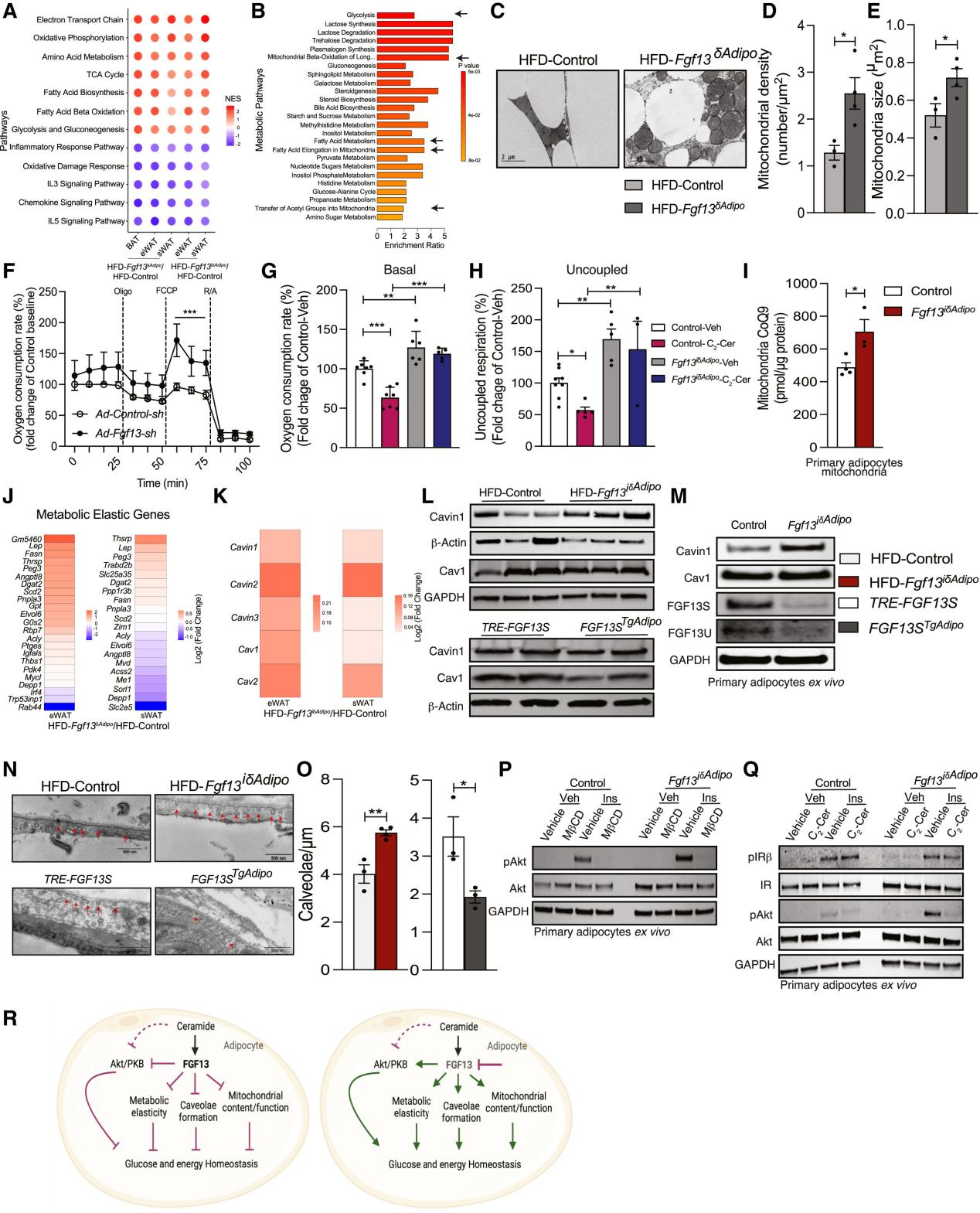
图7. 脂肪细胞FGF13能够调节线粒体功能、代谢弹性和小窝密度
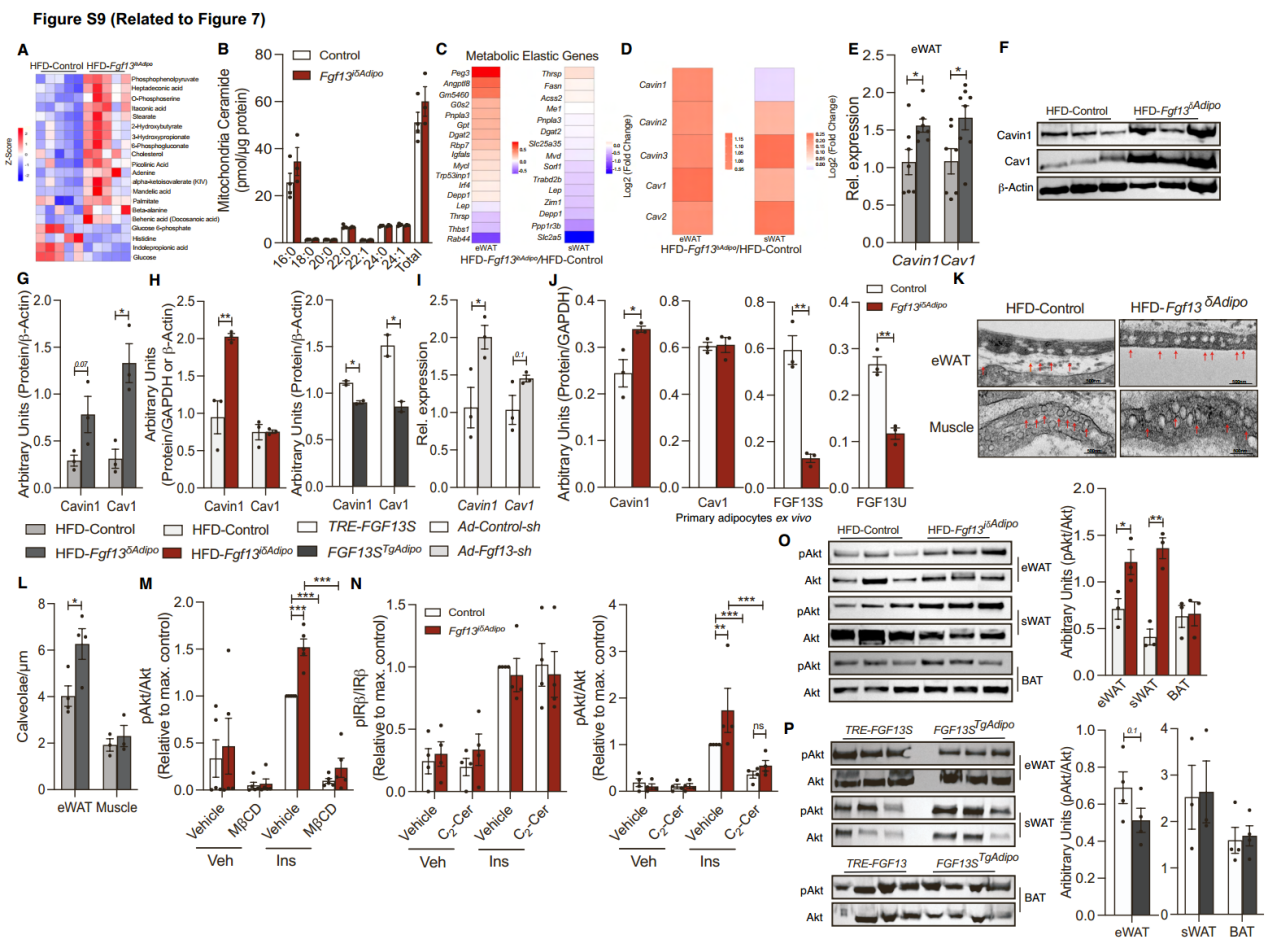
图S9. FGF13调节脂肪细胞功能的机制
总结
本研究发现,FGF13是脂肪组织中受神经酰胺调控的关键基因。在肥胖状态下,神经酰胺能够刺激FGF13的表达,FGF13通过抑制线粒体功能、代谢弹性和小窝形成,影响脂肪细胞的葡萄糖利用和产热能力,而FGF13缺失能够改善能量和葡萄糖稳态,且这些作用独立于神经酰胺。本研究揭示了神经酰胺积累通过诱导FGF13表达损害脂肪细胞功能,导致全身代谢紊乱。
原文链接:https://www.sciencedirect.com/science/article/pii/S1550413125001056?via=ihub
转载本文请联系原作者获取授权,同时请注明本文来自徐凌燕科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3483272-1505393.html?mobile=1
收藏

