
重症医学
https://doi.org/10.1007/s00134-025-07910-4
原创研究
老年脓毒性休克患者靶向高平均动脉压的疗效(OPTPRESS):一项多中心、实用性、开放标签随机对照试验
Akira Endo1,2,33*,Kazuma Yamakawa3,Takashi Tagami4,Yutaka Umemura5,Takeshi Wada6,Ryo Yamamoto7,Hiroki Nagasawa8,Wataru Takayama2,Masayuki Yagi9,Kyosuke Takahashi10,Mitsuaki Kojima2,11,Chihiro Narita12,Satoshi Kazuma13,Jiro Takahashi14,Atsushi Shiraishi15,Masaki Todani16,Masaki Nakane17,Toshihiko Nagata18,Shohei Tanaka19,Yuta Yokokawa20,Kunihiko Takahashi21,Haruka Ishikita1,2,Ryo Hisamune3,Junichi Sasaki7,Ken-ichi Muramatsu8,Hiroyuki Sonobe9,Kazunobu Minami22,Hiromasa Hoshi1,2,Yasuhiro Otomo2,23 代表OPTPRESS试验研究组
摘要
目的:我们在既往研究覆盖不足的地区,探讨了高目标平均动脉压(MAP)对脓毒性休克的影响。
方法:在日本29家医院开展了一项多中心、实用性、开放标签随机对照试验,该地区老年人群慢性高血压患病率为66.9%。纳入年龄≥65岁、诊断为脓毒性休克并收入重症监护病房的患者,按1:1随机分配至高目标组(目标MAP=80-85 mmHg)或对照组(目标MAP=65-70 mmHg),研究时间为2021年7月1日至2023年12月12日。目标MAP维持72小时或直至不再需要血管活性药物。主要结局为90天全因死亡率,次要结局包括无器官支持天数和不良事件。
结果:根据中期分析结果提示高目标策略存在危害,试验提前终止。共518例患者中,258例分至高目标组,260例分至对照组。随机化后90天,高目标组101例(39.3%)、对照组74例(28.6%)死亡(风险差异=10.7;95%置信区间2.6-18.9)。高目标组28天无肾脏替代治疗天数更短。任何亚组(包括已知慢性高血压患者)均未观察到高目标MAP对任何结局的临床获益。
结论:在老年脓毒性休克患者中,与标准治疗相比,高目标MAP显著增加死亡率。
试验注册:UMIN临床试验注册中心;UMIN000041775;2020年9月13日。
关键词:临床试验;重症监护;急诊医学;老年医学;脓毒性休克
关键信息
与常规治疗相比,靶向MAP 80-85 mmHg使518例日本≥65岁脓毒性休克患者的90天死亡率升高。尽管该随机对照试验针对慢性高血压患病率66.9%的人群,并采用早期联合血管加压素方案,但高MAP策略在任何结局或亚组中均未显示临床获益。
引言
脓毒症是全球主要的医疗挑战。脓毒性休克作为脓毒症的一种类型,即使在发达国家死亡率仍高达约38.5%[1],其特征为充分液体复苏后持续低血压[2],需立即稳定血流动力学。然而,脓毒性休克循环管理的关键因素——最佳目标血压仍存在争议[3]。
近期欧美随机试验显示,血管扩张性休克中目标MAP>65 mmHg并非总是有益[4-7]。但部分研究提示,合并慢性高血压的脓毒性休克患者靶向MAP 80-85 mmHg可能获益[8-10]。既往一项试验[6]表明,老年患者更低目标MAP(60-65 mmHg)更优,但该试验中不足半数参与者为脓毒性休克,且亚组分析显示目标血压的影响因疾病而异[6]。由于控制器官灌注的自身调节机制因患者人口学特征、疾病类型和严重程度而异[11,12],目标MAP的效果需在既往试验未涉及的种族、疾病特异性或慢性高血压患病率高的人群中进一步验证。此外,既往试验结果可能受儿茶酚胺相关不良事件影响,因此需采用最小化儿茶酚胺剂量的方案探讨高目标MAP的效果。
因此,我们在日本开展了一项随机试验,评估早期联合使用血管加压素的高目标MAP方案对年龄≥65岁脓毒性休克患者的影响。据日本全国调查,该人群慢性高血压患病率为66.9%[13]。
方法
研究设计
OPTPRESS试验(老年脓毒性休克患者最佳目标血压研究)是在日本29家中心开展的多中心、实用性、开放标签随机对照试验。筛选年龄≥65岁的脓毒性休克患者并随机分组。所有患者或其亲属均签署书面知情同意书;紧急情况下先实施试验流程,后补充知情同意。试验方案已另行发表[14],并在UMIN临床试验注册中心预注册(UMIN000041775)。
研究对象
纳入标准:年龄≥65岁、临床诊断为脓毒性休克并收入重症监护病房的患者。脓毒性休克诊断基于Sepsis-3标准[2]。脓毒性休克诊断后的液体复苏未采用“诊断后3小时内至少输注30 mL/kg晶体液”的统一方案[15],而是由临床医生根据最新研究显示过量液体(尤其对老年人群)可能有害的证据自行决定[16,17]。排除已使用血管活性药物≥3小时(包括入院前)的患者,因既往meta分析[18]提示去甲肾上腺素使用6小时后靶向高MAP可能存在风险。排除标准详见补充材料1(ESM 1)。
随机化与盲法
患者通过在线系统按1:1比例随机分配至高目标组(MAP=80-85 mmHg)或对照组(MAP=65-70 mmHg),采用由独立程序员生成的集中式计算机分配序列。根据是否合并慢性高血压病史及年龄(<80岁或≥80岁)进行分层区组随机化。慢性高血压定义为既往诊断或有降压药物使用史。区组大小为10,对所有研究成员保密以降低随机序列的可预测性。鉴于试验的实用性,分层用慢性高血压病史根据入组时信息确定,无论实际患病率如何。由于试验性质,治疗医生不设盲,但统计学家在所有分析完成前对分组设盲。
研究流程
随机化后维持目标MAP 72小时,或直至患者病情改善无需血管活性药物。高目标组若发生可能与血管活性药物相关的不良事件,目标MAP调整为65 mmHg。72小时后目标MAP由医生决定。考虑到普遍性,原则上采用上臂无创血压测量,仅重症监护病房可进行有创动脉血压监测。
本试验规定早期联合使用血管加压素,以最小化儿茶酚胺潜在不良事件[19,20]。若需去甲肾上腺素剂量≥0.1 μg/kg/min以达到目标MAP,启动血管加压素并增至0.04 U/min。若仍未达标,医生可加用其他血管活性药物、增加去甲肾上腺素剂量或加用多巴酚丁胺/氢化可的松。液体输注量和速度由医生决定。原则上要求医生遵循最新脓毒症管理临床实践指南[15,21]。是否减少或停用血管活性药物、初始经验性抗菌药物选择、机械通气或肾脏替代治疗(RRT)的启动及其他辅助药物使用均由治疗医生决定。镇痛镇静药物的类型和剂量原则上以里士满躁动-镇静量表(RASS)评分-3至0为目标[22]。
研究结局
主要终点为随机化后90天全因死亡率。次要结局包括28天全因死亡率、脓毒症相关死亡率、24小时乳酸清除率、28天无机械通气/无RRT/无儿茶酚胺天数及安全性终点。次要结局详情见ESM 1。死亡原因由治疗医生根据患者临床过程判断。24小时乳酸清除率定义为“100×(重症监护病房入院24小时后乳酸水平-入院时乳酸水平)/入院时乳酸水平”。28天内死亡患者的无支持天数计为0。出院时回顾性收集严重肾脏不良事件(MAKE)[23]。
统计分析
基于既往类似人群研究,预计对照组主要终点发生率为45%,预期干预组绝对差异为10%。计算得出每组需376例患者,以80%把握度实现双侧α=0.05。假设约10%患者因任何原因退出,计划入组836例患者。所有分析由独立于试验实施且对分组设盲的统计学家根据预设统计分析计划(ESM 2)完成。
主要分析基于随机化结果,采用意向治疗人群。次要分析对遵循方案直至干预结束或退出试验的患者进行符合方案分析。90天死亡率差异采用Fisher确切概率法比较。次要分析包括校正入组时分层因素的 logistic 回归分析,以及通过 Kaplan-Meier 曲线、对数秩检验等方法进行生存时间分析。对死亡率和不良事件发生率等次要终点进行相同分析。安全性分析纳入接受任何治疗的患者,无论是否退出试验。乳酸清除率和各无器官支持天数等终点采用Student’s t检验、Wilcoxon秩和检验等适当方法比较汇总统计量。采用多变量logistic回归模型进行事后敏感性分析,以校正试验组间患者基线特征的潜在不平衡。
在确认300例患者的90天生存结局后进行中期分析。中期分析期间继续入组患者。当计划入组患者数达到时计算贝叶斯把握度,若下降至约≤5%,安全监测委员会建议终止试验。因未基于有效性做出继续试验的决定,最终分析未调整显著性水平。统计学显著性设定为P<0.05,使用SAS 9.4软件进行所有分析。
结果
中期分析结果显示,高目标MAP策略达到预设的无效终止标准,甚至提示存在危害,因此安全监测委员会建议提前终止试验,患者入组于2023年12月12日停止。由于数据录入和验证延迟,从入组第300例患者至中期分析耗时约8个月。最终,2021年7月1日至2023年12月12日期间,共筛查561例患者,518例随机分配至高目标组(258例)和对照组(260例)(图1)。排除2例注册错误患者(每组1例)后,516例纳入分析。所有参与者均为日本人,总体人群中位年龄(四分位距)为78岁(73-85岁)。最常见感染来源为腹部(30.2%),其次为泌尿道(26.4%)和肺部(25.0%)。两组从开始使用去甲肾上腺素至随机化的中位时间均为60分钟。两组基线特征相似(表1;ESM 3,表E1)。高目标组和对照组分别约53.3%和52.9%有慢性高血压病史。
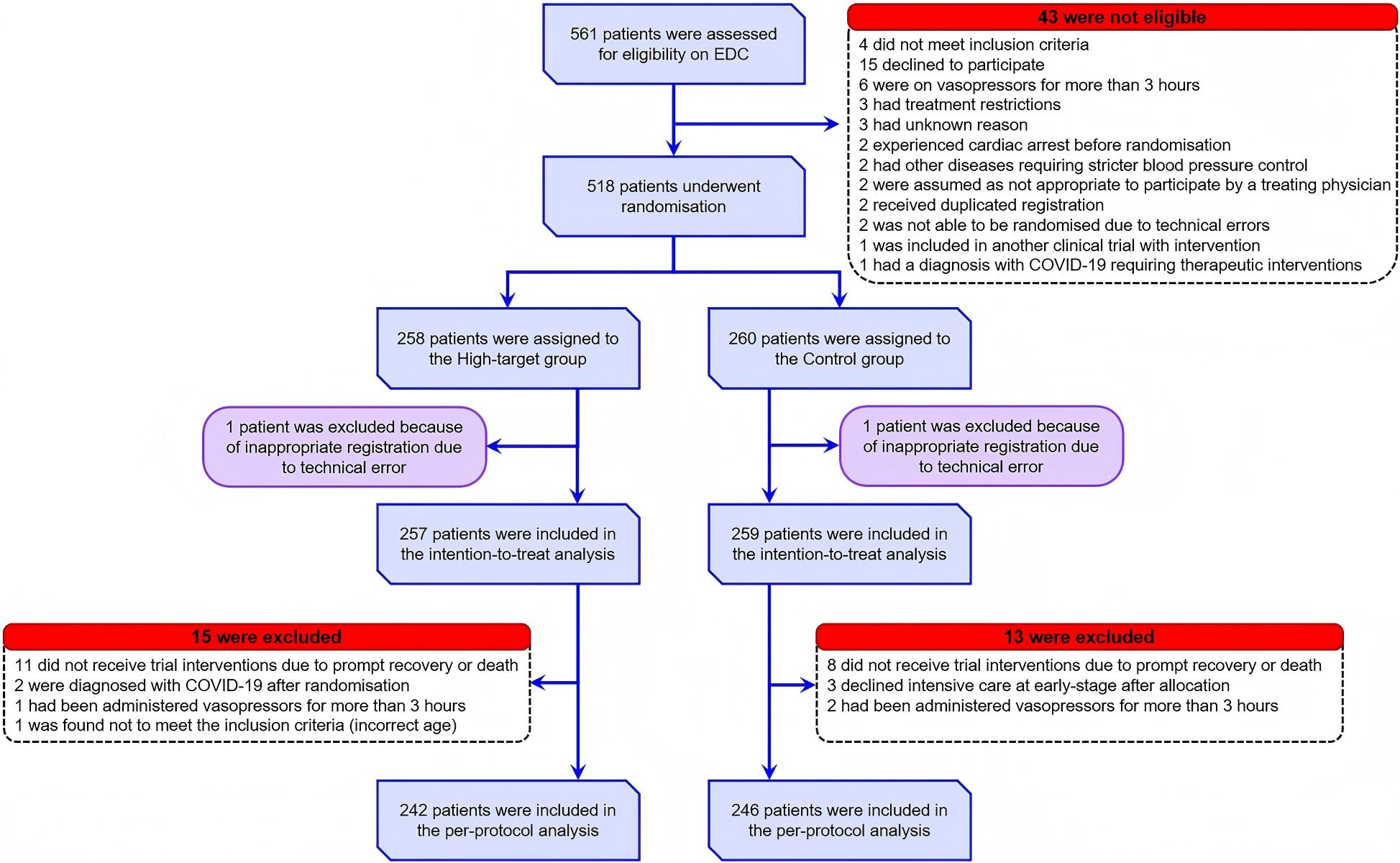
图1 患者流程图。纳入根据Sepsis-3标准临床诊断为脓毒性休克的≥65岁患者进行资格评估。总计518例患者按1:1比例随机分配至高目标组或对照组。每组各有1例患者因技术错误导致的不当注册被排除在主要分析之外。EDC:电子数据采集;MAP:平均动脉压。
表 1 患者基线特征(意向治疗人群)
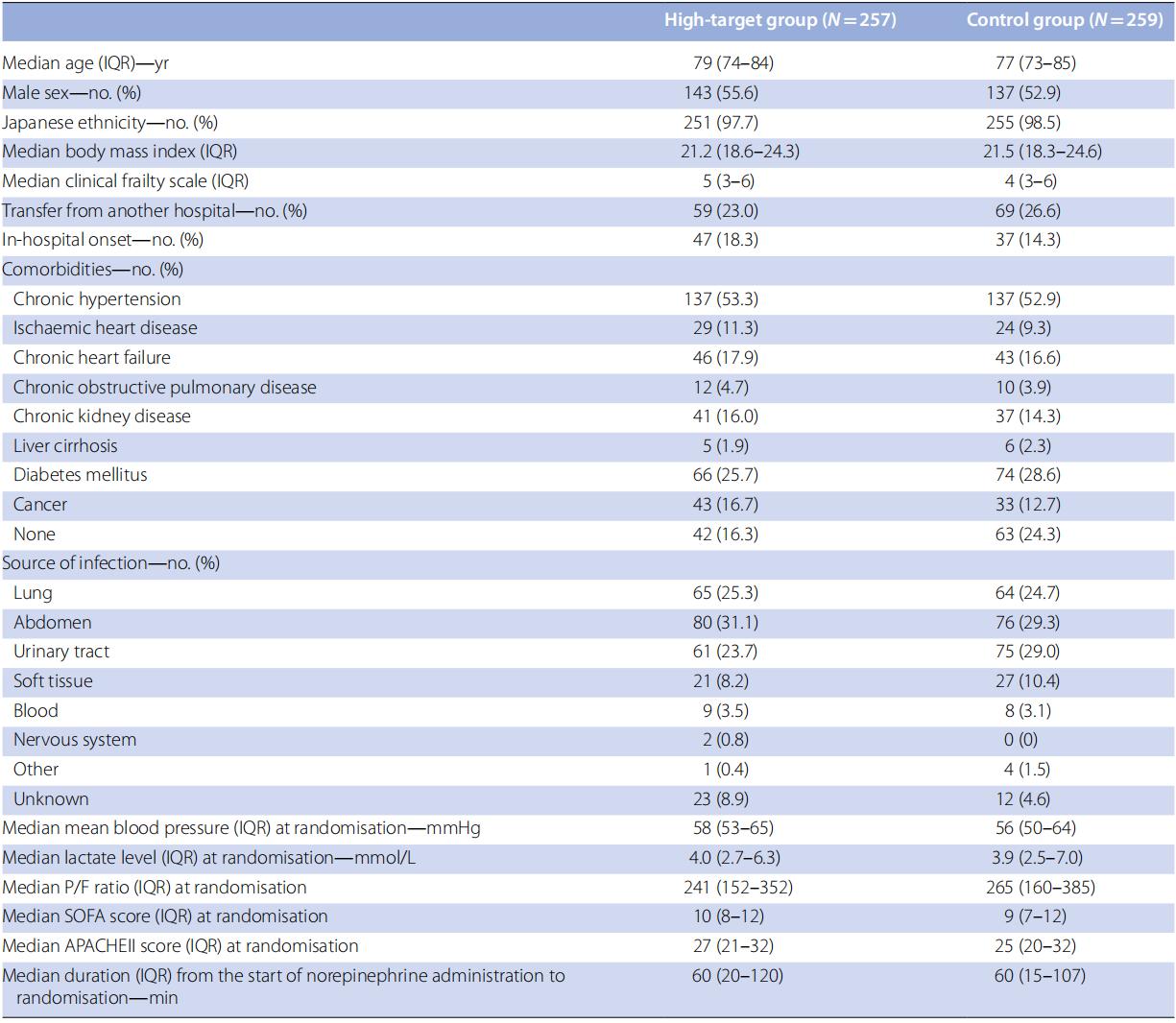
汇总统计数据计算时排除了缺失值。各变量缺失值的数量和比例见表E1。
IQR:四分位距;P/F比值:动脉血氧分压(PaO₂)与吸入氧浓度分数(FiO₂)的比值;SOFA:序贯器官衰竭评估;APACHE:急性生理学及慢性健康状况评估。
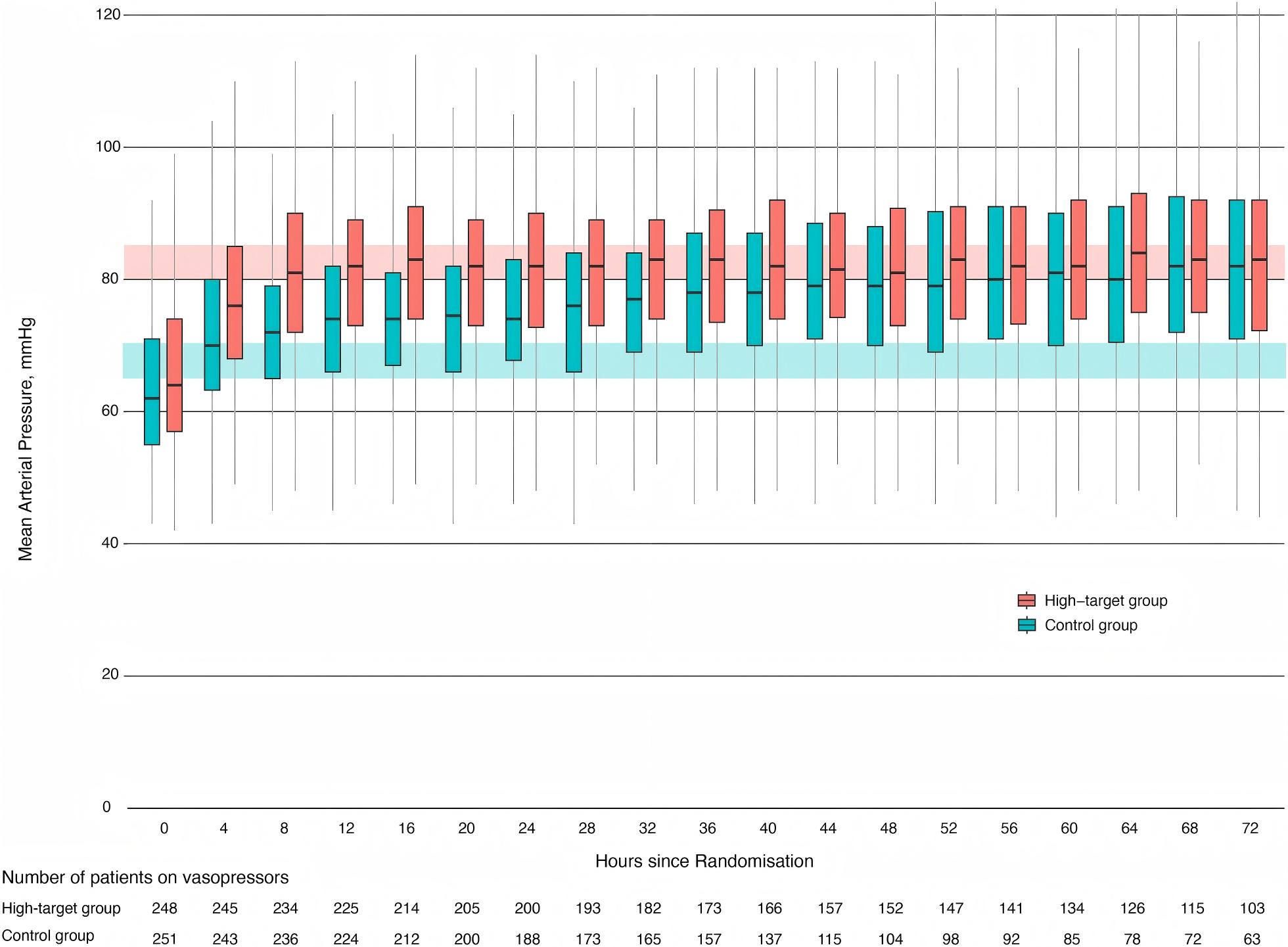
图2 基于平均动脉压目标的血压管理。箱线图显示了根据目标MAP的中位MAP值及四分位距的变化。红色阴影区域表示高MAP组的目标范围,蓝色阴影区域表示对照组的目标范围。未显示异常值。大多数高目标组患者在随机化后8小时达到目标MAP,对照组患者则在随机化后4小时达到目标MAP。图中还显示了接受血管加压药物治疗的患者数量。高目标组和对照组的血管加压药物中位使用时长分别为65小时和42小时。MAP:平均动脉压。
复苏期间及复苏后,高目标组前64小时MAP显著高于对照组(图2;ESM 3,表E2-E3和图E1)。首次达到目标MAP的中位时间(四分位距)在高目标组为3小时(1-7小时),对照组为1小时(0-3小时)。高目标组16例、对照组5例患者在达到目标MAP前死亡。高目标组和对照组血管活性药物使用中位时长分别为65小时和42小时(图2;ESM,表E4)。高目标组2例患者因不良事件将目标MAP降至65-70 mmHg。随机化后72小时内的临床管理总结见ESM 3表E5。两组液体输注量相似。前72小时去甲肾上腺素中位用量在高目标组为15.6 mg,对照组为9.6 mg;血管加压素用量分别为34.0 U和11.8 U。高目标组和对照组分别有60.3%和56.8%的患者接受糖皮质激素补充治疗。
随机化后90天,高目标组101例(39.3%)、对照组74例(28.6%)死亡(风险差异=10.7;95% CI 2.6-18.9)(表2)。除脓毒症外,两组缺血事件等其他死因无差异(ESM,表E6)。90天内累积死亡人数见图3。随机化后90天内脓毒症相关死亡在高目标组为77例(30.0%),对照组为46例(17.8%)(风险差异=12.2;95% CI 4.9-19.5)。死因相关累积死亡人数见ESM 3图E2。28天无RRT天数的均值(标准差)在高目标组为18天(13.1天),对照组为20天(12.1天)(差异=2.5天;95% CI -4.7至-0.3)。所有主要安全结局在高目标组发生率更高,包括心律失常、血栓栓塞、非血栓栓塞性缺血事件及需要输血的出血事件。
表 2 临床结局 (意向治疗人群)
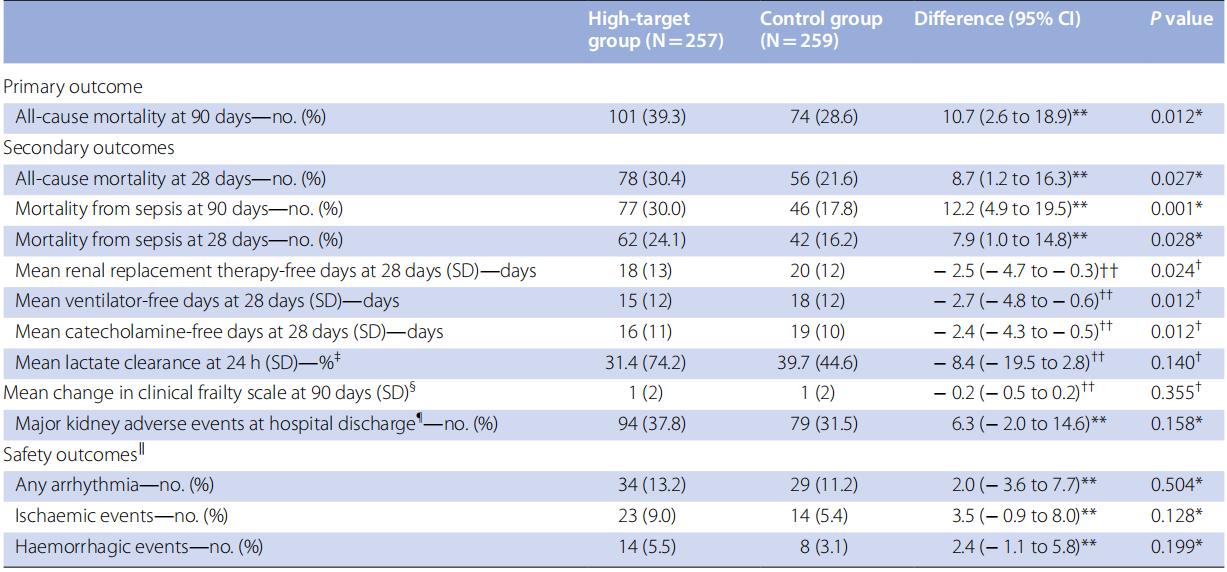
CI:置信区间,SD:标准差
*P值采用Fisher确切概率法计算
**提供风险差异
†P值采用Student's t检验计算
††提供均数差异
‡汇总统计量分别基于高目标组228例和对照组234例患者计算
§汇总统计量分别基于高目标组192例和对照组161例患者计算
¶严重肾脏不良事件(MAKE)包括以下任何一种情况:eGFR较基线下降≥25%定义的持续性肾功能不全、持续需要肾脏替代治疗(RRT)及死亡。该结局未预先定义,为回顾性收集。汇总统计量分别基于高目标组249例和对照组251例患者计算
‖汇总统计量在至少接受一项治疗干预(液体输注、去甲肾上腺素使用、血管加压素使用或肾上腺素使用)的安全性分析人群中计算。安全性分析人群包括高目标组247例和对照组251例患者
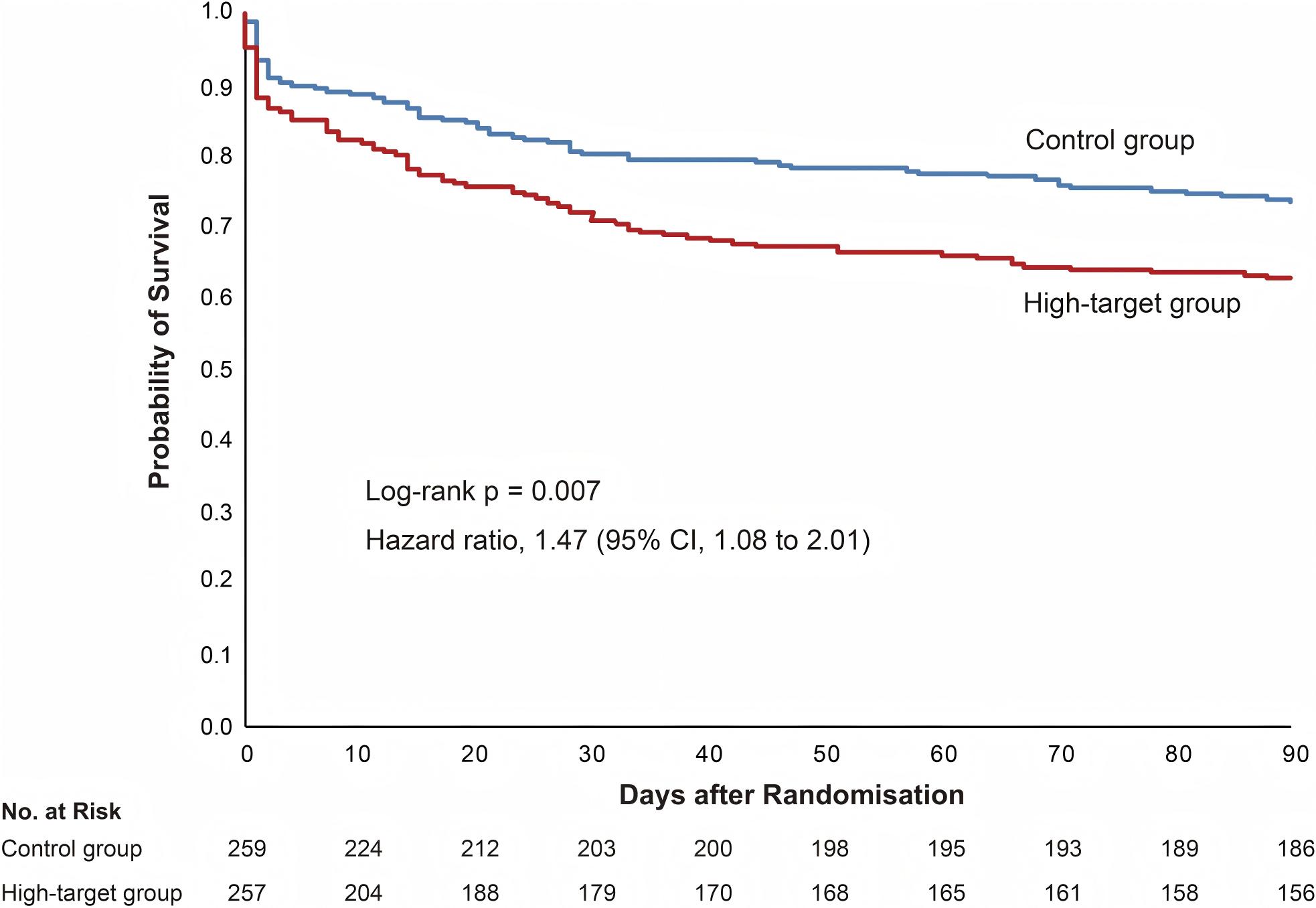
图3 累积生存的 Kaplan–Meier 曲线
使用Wilcoxon秩和检验的敏感性分析显示相似结果(ESM,表E7)。任何亚组(包括已知慢性高血压患者)均未观察到高MAP策略对任何结局的临床获益(ESM 3,表E8和图E3-E4)。次要符合方案分析和预设的分层因素校正敏感性分析显示相似结果(ESM 3,表E9-E10和图E5)。校正潜在混杂因素的事后多变量分析结果与主要分析一致(ESM 3,表E11)。
讨论
OPTPRESS试验探讨了日本≥65岁脓毒性休克患者中高目标MAP的有效性。此外,本试验采用近年来提出的早期使用血管加压素策略[19,20],以最小化儿茶酚胺相关不良事件。结果显示,靶向MAP 80-85 mmHg较靶向65-70 mmHg显著增加死亡率。所有与生存和无器官支持天数相关的次要结局在高目标组均显著更差。包括慢性高血压在内的潜在效应修饰因子对结局影响甚微。尽管西方国家的累积证据表明较高MAP策略在一般血管扩张性休克中无效[4-7,24],但由于影响全身血流动力学的疾病模式(如心脑血管疾病)因国家、地区和种族而异[25],其普遍性受限。本试验通过在既往研究覆盖不足的地区开展,为该领域现有证据增添了全球相关性。
与既往试验[4-6]一致,对照组实际MAP超过目标范围。由于对照组超过半数患者在随机化42小时后不再使用血管活性药物,推测该差异主要由患者病情改善驱动,而非方案依从性问题。同时,部分患者因病情严重即使使用大剂量血管活性药物仍无法达到目标MAP。组间目标MAP与观察MAP的差异表明,该问题仅能通过随机试验而非现有观察数据的分析恰当探讨。尽管组间MAP差异小于试验方案预设,但随机化8小时后两组MAP的明确分离表明比较其效果具有合理性。
本试验中,尽管两组液体输注量相似,但高目标组血管活性药物累积用量更高。如既往前瞻性研究[26]所示,高目标MAP策略中因血管活性药物暴露增加带来的风险可能超过低血压相关风险。理论上,过度血管收缩存在器官缺血风险[27]。老年人群共病较多,可能对血管活性药物诱导的不良事件更敏感。然而,尽管高目标组不良事件更常见,但两组除脓毒症外的死因(包括缺血事件相关死亡)无差异(ESM 3,表E6和图E2)。有研究报道,血管活性药物可能通过免疫效应影响脓毒性休克结局。临床前模型显示,去甲肾上腺素具有免疫抑制和促进细菌生长的作用[28,29]。与既往试验[4]提示高MAP目标对慢性高血压患者肾功能有益不同,本试验在MAKE发生和无RRT天数方面未观察到类似趋势。基线条件差异(如年龄和慢性肾病患病率)可能导致这些结果差异。另一项纳入≥65岁患者并比较目标MAP效果的试验[6]也未发现肾脏替代治疗天数的差异。
近期提出了个体化复苏理念[30,31]。一项随机试验[32]报道,全身麻醉期间个体化血压管理可减少术后器官功能障碍。然而,急诊环境中通常缺乏发病前血压信息,且未诊断的慢性高血压普遍存在[33]。此外,液体复苏和血管活性药物的有效性取决于既往心血管状况和脓毒症导致的心肌抑制。本试验未对合并基础心脏疾病的患者进行心脏功能监测和管理的标准化规定。未来需评估结合超声心动图或血流动力学监测设备、考虑患者心血管状态的个体化血流动力学管理的有效性。
本试验存在一些局限性。开放标签设计可能影响临床管理并引入偏倚(如结局判定偏倚)。固定区组的使用可能导致随机化隐藏不充分。由于急诊环境信息有限及未诊断情况的存在,慢性高血压共病状态有时不准确。血管活性药物缺乏严格的滴定或减量方案,可能导致达到目标MAP的时间和MAP控制准确性存在差异。计算样本量时预设的死亡率高于实际观察到的死亡率。鉴于研究规模,预设基于欧美数据,而既往流行病学研究显示西方国家与日本脓毒症死亡率存在差异[34,35]。由于未立即报告非严重不良事件,存在漏报风险。此外,缺乏不良事件详细发生时间和72小时后的记录。尽管本试验结果可提供来自既往未探索地区的见解,但因单国试验和种族同质性的性质,普遍性受限。
结论
在日本老年脓毒性休克患者中,尽管采用血管加压素节省儿茶酚胺的方案,靶向MAP 80-85 mmHg的治疗未降低反而显著增加死亡率,高于靶向MAP 65-70 mmHg的标准治疗。除非未来出现新证据,否则在脓毒性休克患者中应警惕过度使用血管活性药物。
补充信息
在线版本包含补充材料,可通过https://doi.org/10.1007/s00134-025-07910-4获取。
作者单位
1 土浦协同综合医院急性重症医学科,茨城县土浦市
2 东京医科齿科大学医院创伤与急性重症中心,东京都文京区汤岛1-5-45
3 大阪医疗药科大学急诊与重症医学科,大阪府高槻市大学町2-7
4 日本医科大学武藏小杉医院急诊与重症医学科,神奈川县川崎市中原区小杉町1-396
5 大阪市立综合医疗中心创伤与外科重症医学科,大阪府住吉区万代东3-1-56
6 北海道大学医学部麻醉与重症医学科急性与重症医学分部,北海道札幌市北区
7 庆应义塾大学医学院急诊与重症医学科,东京都新宿区信浓町35
8 顺天堂大学静冈医院急性重症医学科,静冈县伊豆之国市长岛1129
9 松户市立综合医院急诊医学与急性外科,千叶县松户市船堀993-1
10 兵库县立西宫医院急诊与重症中心,兵库县西宫市六团町13-9
11 东京女子医科大学足立医疗中心急诊与重症医学科,东京都足立区江北4-33-1
12 静冈县综合医院急诊医学科,静冈县葵区北安藤4-27-1
13 札幌医科大学医学院重症医学科,北海道札幌市中央区S1 W16
14 川崎医科大学急性医学科,冈山县仓敷市松岛577
15 龟田医疗中心急诊与创伤中心,千叶县鸭川市东町929
16 山口大学急诊与重症医学科,山口县宇部市南小串1-1-1
17 山形大学医院急诊与重症医学科,山形县山形市饭田西2-2-2
18 淀川基督教医院急诊与重症医学科,大阪府东淀川区国岛1-7-50
19 砂川市医疗中心急诊医学科,北海道砂川市西4条北3-1-1
20 东北大学医学院急诊与重症医学科,宫城县仙台市青叶区星陵町1-1
21 东京医科齿科大学医学与牙科科学研究生院生物统计学部,东京都文京区汤岛1-5-45
22 龟田医疗中心重症医学科,千叶县鸭川市东町929
23 国立医院组织灾害医疗中心创伤与重症医学科,东京都立川市绿町3256
24 佐贺大学医学院急诊与重症医学科,佐贺县佐贺市锅岛5-1-1
25 京都大学医院麻醉科,京都市左京区松园町54
26 广岛县立医院重症医疗中心,广岛市南区宇品下1-5-54
27 福冈大学医院急诊与重症医学科,福冈市南区七隈7-45-1
28 札幌手稻庆生会医院急诊与重症医疗中心,札幌市手稻区前田1条12丁目
29 东京医科大学医院急诊与重症医学科,东京都新宿区西新宿6-7-1
30 千叶大学医学院急诊与重症医学科,千叶县千叶市中央区亥鼻1-8-1
31 大分大学医学院急诊医学科,大分县由布市 Idaigaoka 1-1
32 和歌山医科大学急诊与重症医学科,和歌山县贵志川町811-1
33 东京医科齿科大学医学与牙科科学研究生院急性重症与灾难医学科,东京都文京区汤岛1-5-45
致谢
我们感谢所有同意参与本试验的患者及其亲属,感谢治疗患者的医生和试验合作者,包括数据管理委员会和安全监测委员会。OPTPRESS试验研究组成员:Tomohiko Akutsu, Daiki Kaito, Hiromichi Ohsaka, Yohei Iwasaki, Fumino Taketazu, Tomoko Iguchi, Ryu Azumaguchi, Noritaka Ushio, Takahiro Okane, Toshiyuki Karumai, Ayaka Matsuoka, Chikashi Takeda, Toshiki Sera, Hiroko Okura, Yoichi Katayama, Keiichiro Shimoyama, Tadanaga Shimada, Ryuzo Abe, Tsuyoshi Nakashima, Tatsuhiko Anzai, Keisuke Suzuki, Takahiro Yamanaka, Youichi Yanagawa, Yuichi Araki。
作者贡献
所有作者均参与试验设计、数据解读和报告终稿的批判性修订。AE为试验获取资金。AT和KT参与统计设计与分析。AE、KY、TT和YU撰写手稿初稿。所有作者均有机会对研究方案提出意见、访问研究数据,并对提交发表的决定负最终责任。通讯作者确认所有列出作者符合署名标准,且无符合标准者被遗漏。
资金支持
本研究由日本学术振兴会KAKENHI资助(批准号21H03197和23K21518)。资助方未参与研究设计与实施、数据收集、管理、分析与解读、 手稿撰写、审核或批准,以及提交发表的决定。
数据可用性
试验组完成所有辅助分析后,经指导委员会成员批准,可向通讯作者合理申请获取本研究分析的数据集。
声明
利益冲突:作者声明无可能影响或偏倚试验实施及结果的利益冲突。
开放获取:本文受知识共享署名-非商业性使用4.0国际许可协议保护,允许在任何媒介或格式中进行非商业性使用、分享、改编、分发和复制,但需为原始作者及来源提供适当署名,附上知识共享许可协议链接,并标明是否进行了修改。除非材料的引用说明中另有规定,否则本文中的图片或其他第三方材料均包含在知识共享许可协议内。如果材料未包含在许可协议中,且您的预期用途超出法定许可范围或未被许可协议涵盖,需直接从版权持有者处获取授权。如需查看本许可协议副本,请访问http://creativecommons.org/licenses/by-nc/4.0/。
出版者说明:施普林格·自然对已发表地图的管辖权主张和机构隶属保持中立。
收稿日期:2024年12月4日
接受日期:2025年4月11日
在线发表日期:2025年5月13日
参考文献
[1] Bauer M, Gerlach H, Vogelmann T, et al. Mortality in sepsis and septic shock in Europe, North America and Australia between 2009 and 2019—results from a systematic review and meta-analysis. Crit Care. 2020;24:239.
[2] Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315:801-810. DOI: 10.1001/jama.2016.0287.
[3] De Backer D, Deutschman CS, Hellman J, et al. Surviving sepsis campaign research priorities 2023. Crit Care Med. 2024;52:268-296. DOI: 10.1097/CCM.0000000000006135.
[4] Asfar P, Meziani F, Hamel JF, et al. High versus low blood-pressure target in patients with septic shock. N Engl J Med. 2014;370:1583-1593. DOI: 10.1056/NEJMoa1312173.
[5] Lamontagne F, Meade MO, Hébert PC, et al. Higher versus lower blood pressure targets for vasopressor therapy in shock: a multicentre pilot randomized controlled trial. Intensive Care Med. 2016;42:542-550. DOI: 10.1007/s00134-016-4237-3.
[6] Lamontagne F, Richards-Belle A, Thomas K, et al. Effect of reduced exposure to vasopressors on 90-day mortality in older critically ill patients with vasodilatory hypotension: a randomized clinical trial. JAMA. 2020;323:938-949. DOI: 10.1001/jama.2020.0930.
[7] Marcucci M, Painter TW, Conen D, et al. Hypotension-avoidance versus hypertension-avoidance strategies in noncardiac surgery: an international randomized controlled trial. Ann Intern Med. 2023;176:605-614. DOI: 10.7326/M22-3157.
[8] Carayannopoulos KL, Pidutti A, Upadhyaya Y, et al. Mean arterial pressure targets and patient-important outcomes in critically ill adults: a systematic review and meta-analysis of randomized trials. Crit Care Med. 2023;51:241-253. DOI: 10.1097/CCM.0000000000005726.
[9] Tran PNT, Kusirisin P, Kaewdoungtien P, et al. Higher blood pressure versus normotension targets to prevent acute kidney injury: a systematic review and meta-regression of randomized controlled trials. Crit Care. 2022;26:364. DOI: 10.1186/s13054-022-04236-1.
[10] Leone M, Asfar P, Radermacher P, et al. Optimizing mean arterial pressure in septic shock: a critical reappraisal of the literature. Crit Care. 2015;19:101. DOI: 10.1186/s13054-015-0794-z.
[11] Kato R, Pinsky MR. Personalizing blood pressure management in septic shock. Ann Intensive Care. 2015;5:41. DOI: 10.1186/s13613-015-0085-5.
[12] Ferlini L, Su F, Creteur J, et al. Cerebral autoregulation and neurovascular coupling are progressively impaired during septic shock: an experimental study. Intensive Care Med Exp. 2020;8:44. DOI: 10.1186/s40635-020-00332-0.
[13] Japanese Ministry of Health, Labour and Welfare. Result of National health and nutrition examination survey. https://www.e-stat.go.jp/stat-search/files?page=1&layout=datalist&toukei=00450171&tstat=000001041744&cycle=7&year=20190&month=0&tclass1=000001148507&stat_infid=000032041920&tclass2val=0. Accessed 8 Oct 2024.
[14] Endo A, Yamakawa K, Tagami T, et al. Optimal target blood pressure in elderly with septic shock (OPTPRESS) trial: study protocol for a randomized controlled trial. Trials. 2022;23:799. DOI: 10.1186/s13063-022-06732-9.
[15] Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021;47:1181-1247. DOI: 10.1007/s00134-021-06506-y.
[16] Yealy DM, Kellum JA, et al. (Investigators ProCESS). A randomized trial of protocol-based care for early septic shock. N Engl J Med. 2014;370:1683-1693. DOI: 10.1056/NEJMoa1401602.
[17] Goodacre S, Fuller G, Conroy S, et al. Diagnosis and management of sepsis in the older adult. BMJ. 2023;382:e075585. DOI: 10.1136/bmj-2023-075585.
[18] Lamontagne F, Day AG, Meade MO, et al. Pooled analysis of higher versus lower blood pressure targets for vasopressor therapy in septic and vasodilatory shock. Intensive Care Med. 2018;44:12-21. DOI: 10.1007/s00134-017-5016-5.
[19] Russell JA, Walley KR, Singer J, et al. Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med. 2008;358:877-887. DOI: 10.1056/NEJMoa067373.
[20] Sacha GL, Bauer SR. Optimizing vasopressin use and initiation timing in septic shock: a narrative review. Chest. 2023;164:1216-1227. DOI: 10.1016/j.chest.2023.07.009.
[21] Egi M, Ogura H, Yatabe T, et al. The Japanese clinical practice guidelines for management of sepsis and septic shock 2020 (J-SSCG 2020). Acute Med Surg. 2021;8:e659. DOI: 10.1002/ams2.659.
[22] Sessler CN, Grap MJ, Brophy GM. Multidisciplinary management of sedation and analgesia in critical care. Semin Respir Crit Care Med. 2001;22:211-226. DOI: 10.1055/s-2001-13834.
[23] Billings FT 4th, Shaw AD. Clinical trial endpoints in acute kidney injury. Nephron Clin Pract. 2014;127:89-93. DOI: 10.1159/000363725.
[24] Yoshimoto H, Fukui S, Higashio K, et al. Optimal target blood pressure in critically ill adult patients with vasodilatory shock: a systematic review and meta-analysis. Front Physiol. 2022;13:962670. DOI: 10.3389/fphys.2022.962670.
[25] Vaduganathan M, Mensah GA, Turco JV, et al. The global burden of cardiovascular diseases and risk: a compass for future health. J Am Coll Cardiol. 2022;80:2361-2371. DOI: 10.1016/j.jacc.2022.11.005.
[26] Roberts RJ, Miano TA, Hammond DA, et al. Evaluation of vasopressor exposure and mortality in patients with septic shock. Crit Care Med. 2020;48:1445-1453. DOI: 10.1097/CCM.0000000000004476.
[27] Dalimonte MA, DeGrado JR, Anger KE. Vasoactive agents for adult septic shock: an update and review. J Pharm Pract. 2019;33:523-532. DOI: 10.1177/0897190019.
[28] Stolk RF, van der Poll T, Angus DC, et al. Potentially inadvertent immunomodulation: norepinephrine use in sepsis. Am J Respir Crit Care Med. 2016;194:550-558. DOI: 10.1164/rccm.201604-0862CP.
[29] Russell JA, Walley KR. Vasopressin and its immune effects in septic shock. J Innate Immun. 2010;2:446-460. DOI: 10.1159/000318531.
[30] De Backer D, Cecconi M, Chew MS, et al. A plea for personalization of the hemodynamic management of septic shock. Crit Care. 2022;26:372. DOI: 10.1186/s13054-022-04255-y.
[31] Zampieri FG, Bagshaw SM, Semler MW. Fluid therapy for critically ill adults with sepsis: a review. JAMA. 2023;329:1967-1980. DOI: 10.1001/jama.2023.7560.
[32] Futier E, Lefrant JY, Guinot PG, et al. Effect of individualized vs standard blood pressure management strategies on postoperative organ dysfunction among high-risk patients undergoing major surgery: a randomized clinical trial. JAMA. 2017;318:1346-1357. DOI: 10.1001/jama.2017.14172.
[33] NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: A pooled analysis of 1201 population-representative studies with 104 million participants. Lancet. 2021;398:957-980. DOI: 10.1016/S0140-6736(21)01330-1.
[34] Vincent JL, Jones G, David S, et al. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Crit Care. 2019;23:196. DOI: 10.1186/s13054-019-2478-6.
[35] Abe T, Ogura H, Shiraishi A, et al. Characteristics, management, and in-hospital mortality among patients with severe sepsis in intensive care units in Japan: the FORECAST study. Crit Care. 2018;22:322. DOI: 10.1186/s13054-018-2186-7.
转载本文请联系原作者获取授权,同时请注明本文来自葛颖科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3430044-1486662.html?mobile=1
收藏

