 精选
精选
研究背景
随着生物医用材料在可植入设备、药物传输和组织工程等领域的快速发展,如何构建既稳定、又具功能性的新型水凝胶材料,成为科研界关注的焦点。传统水凝胶虽具备良好亲水性和生物相容性,但普遍存在易溶胀、结构不稳定、易降解等问题,严重限制了其在长期植入及复杂生理环境中的应用。为解决这一关键难题,吉林大学李云峰教授团队提出了一种创新策略——构建不溶胀润滑纳米胶体水凝胶(NCG),在材料结构设计和综合性能方面实现突破进展。
Nonswelling Lubricative Nanocolloidal Hydrogel Resistant to Biodegradation
Tiantian Ding, Chunxia Ren, Liyuan Meng, Guoyong Han, Yao Xue, Wenlong Song, Daowei Li, Hongchen Sun, Bai Yang & YunfengLi
Nano-Micro Letters (2025)17: 327
https://doi.org/10.1007/s40820-025-01830-0
本文亮点
1. 技术革新:本研究创新性地构建了一种基于甲基丙烯酰化透明质酸(HAMA)纳米粒子的纳米胶体水凝胶。该策略通过在纳米粒子内部引入稳定的疏水结构域,并结合光引发交联机制,构建出一种高度稳定的不溶胀水凝胶。相比传统的分子交联,该方法从结构层面有效抑制了水凝胶在复杂环境中的体积变化,实现了不溶胀。值得强调的是,该NCG构建策略具有高度通用性,可适用于多种高分子体系,在实现不溶胀特性的同时,还兼顾了水凝胶的力学调控、抗酶降解能力。该策略为新一代功能性水凝胶材料的稳定性与应用拓展提供了全新的设计路径和实践基础。
2. 性能飞跃:该水凝胶在常温常压PBS溶液中浸泡200天体积不变,表现出远超传统水凝胶的稳定性;其摩擦系数低至~0.0018,展现优异润滑性能;同时,在小鼠体内24周无明显降解与炎症反应,实现了长期生物安全性与稳定性共存。此外,该水凝胶在成胶后保持良好透明度,光学均匀性高,相比传统胶体材料常见的光散射或浑浊问题,该材料的纳米粒子均匀分散、结构致密有序,有效减少了光散射,显著提升了整体光学性能,进一步拓展了其在可视化植入与光学相关医疗器械中的应用潜力。
3. 应用前景广阔:凭借其不溶胀、耐降解、低摩擦、高透明和结构可调等综合优势,该水凝胶在多种复杂生理环境中均表现出优异适应性,具备广泛的生物医学应用潜力。其在药物控释、软组织填充、组织工程支架、植入式电子器件润滑涂层以及可视化医疗器械等领域均具有重要推广价值。同时,所采用的纳米粒子构建策略具有良好的通用性和拓展性,为新一代功能性水凝胶材料的设计提供了全新思路与技术支撑。
内容简介
传统水凝胶在复杂生理环境中易发生溶胀与降解,严重制约了其在植入式医疗器械、药物控释等场景中的应用。针对这一关键问题,吉林大学李云峰教授团队提出了一种创新解决方案——基于HAMA纳米粒子构建的不溶胀润滑纳米胶体水凝胶(NCG)。该材料通过纳米级疏水结构域与光交联机制,构建出高度稳定的纳米网络结构,赋予水凝胶优异的不溶胀性、抗降解性、超低摩擦性能与良好生物相容性。研究发现,NCGs在不同温度和离子强度条件下体积保持稳定,在多种材料界面上实现稳定润滑,在小鼠体内植入6个月仍保持形貌完整、无明显免疫炎症反应。
图文导读
I NCGs的制备
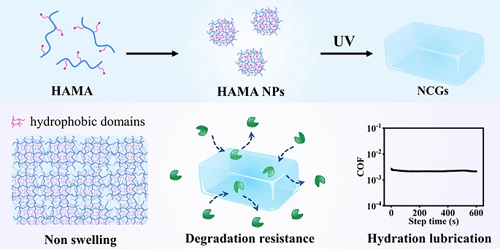
图1. NCGs的制备流程图。 (a)合成HAMA纳米粒子(NPs);(b)光交联制备NCGs。
本图概述了NCGs的整体构建策略。首先,通过甲基丙烯酰化反应制备HAMA,并在丙酮与水的混合体系中进行纳米沉淀,实现粒径较均一的HAMA NPs的构建。随后,在HAMA NPs 溶液中加入光引发剂,利用紫外光照射诱导甲基丙烯酰基团发生交联反应,形成以HAMA NPs为结构单元的三维水凝胶网络。这一“纳米粒子-光交联”双机制,使得所得水凝胶具备独特的结构致密性与高度可控性,为后续性能调控奠定基础。
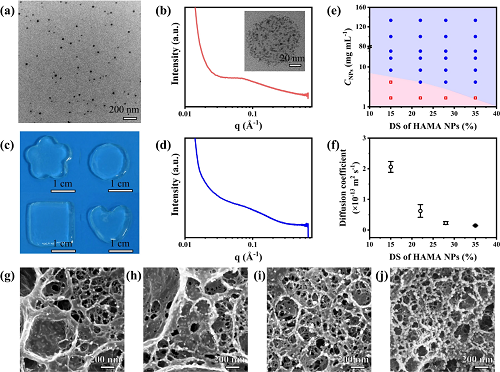
图2. NCGs的结构表征与成胶性能。 (a) HAMA NPs 的TEM图像; (b) SAXS及TEM表征HAMA NPs内部的疏水结构域; (c) NCGs高透光性的图片; (d) NCGs内部的疏水结构; (e) 在不同粒子浓度和取代度下绘制的成胶相图; (f) FITC-dextran在NCGs中的扩散实验; (g–j) NCGs的SEM图像。
图2系统揭示了HAMA NPs的内部结构及其对NCGs形成与性能的影响。图2a显示TEM下HAMA-28 NPs呈球形,粒径约26 nm;图2b结合SAXS与染色TEM证实NPs内部存在半径约1 nm的疏水域。图2c展示NCGs可通过调节模具制得不同形状,制备的NCGs具有高度均匀性和透明度。图2d显示,成胶后,SAXS说明疏水相区仍然保留,说明纳米结构稳定嵌入水凝胶网络中。图2e呈现成胶相图,指出NPs浓度和DS(取代度)越高,越有利于水凝胶形成。图2f通过FITC-dextran扩散测试表明,DS增加导致水凝胶内部网络更致密,扩散能力下降。图2g–j为不同DS下NCGs的cryo-SEM图像,孔径随DS从15%增至35%逐渐缩小,反映出更高的交联密度和致密结构。
II NCGs的不溶胀性能
图3深入评估了NCGs在不同环境下的体积溶胀率。图3a显示HAMA-28 NPs构建的水凝胶在PBS中浸泡200天后无明显膨胀,保持原始尺寸;图3b表明该稳定性对温度(4、25、37°C)不敏感;图3c展示其在10 mM到100 mM PBS的高渗环境中同样不发生明显脱水收缩,反映其抗渗透压扰动能力;图3d–e进一步表明,不论NPs浓度或甲基丙烯酰基取代度变化,所得NCGs均维持非溶胀状态;综合分析表明,NCGs具备不依赖温度的不溶胀行为,这种性能在多种体内环境模拟条件下均表现出优异的结构稳定性,远优于常规水凝胶材料。
图3. NCGs的不溶胀性能。 (a) NCGs样条在PBS(10 mM)中浸泡200天内的光学显微镜图像; (b) NCGs在4、25和37 °C条件下的体积溶胀率; (c) NCGs在不同PBS浓度(20 – 100 mM)下的体积溶胀率; (d)不同浓度HAMA NPs制备的NCGs的体积溶胀率; (e) 不同取代度HAMA NPs制备的NCGs的体积溶胀率。
III NCGs的力学性能
图4系统揭示NCGs的线性粘弹行为与力学调控策略。图4a显示,所有样品在10%应变以下表现出G' > G''的稳定弹性主导特性,超过10%后因网络结构破坏,模量下降;图4b频率扫描显示其在0.1–100 Hz范围内稳定保持粘弹响应,反映良好的结构完整性;图4c进一步表明,通过提高NPs浓度可实现G'从14 Pa提升至超11,000 Pa,覆盖从软脑膜到软骨的生物组织模量范围;图4d说明HAMA-28 NPs构建的水凝胶在PBS中浸泡30天后,其G'与G''基本未变,体现出水凝胶优异的结构与力学稳定性。这证明该材料不仅结构致密,而且在实际生理环境中具有长期应用的潜力。
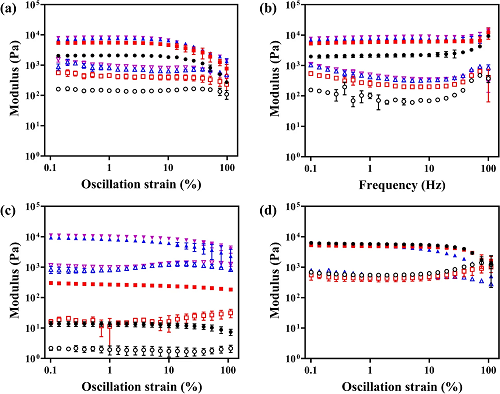
图4. NCGs的力学性能。 (a–b) NCGs在应变和频率扫描实验中获得的储能模量(G′)和损耗模量(G′′);(c) 不同浓度HAMA NPs制备的NCGs的储能模量和损耗模量;(d)在PBS中浸泡7、15和30天后,水凝胶模量的变化。
IV NCGs的润滑性能
图5评估了该材料的关键应用属性——润滑性能与耐久性。图5a–b显示,在不同剪切速率(0.1–1 s⁻1)和轴向载荷(0.1–1 N)下,NCGs始终维持极低摩擦系数(最低~0.0018),大大优于传统HAMA水凝胶(COF约0.04–0.09);图5c说明CHAMA NPs越高,COF略增,可能由于孔隙率降低影响水合层;图5d表明该材料在多种材料界面(聚乙烯、聚氨酯等)间均表现优异润滑性,COF均< 0.03;图5e–f为长时间连续摩擦实验,COF略有上升但未超过0.03,表明润滑层稳定;图5g中光学显微与宏观照片显示,水凝胶表面在长时间测试后依旧无明显损伤,体现了其高耐磨性。整体说明NCGs是可用于较高负载、长期滑动接触的优秀润滑材料,特别适合植入式器械界面润滑。
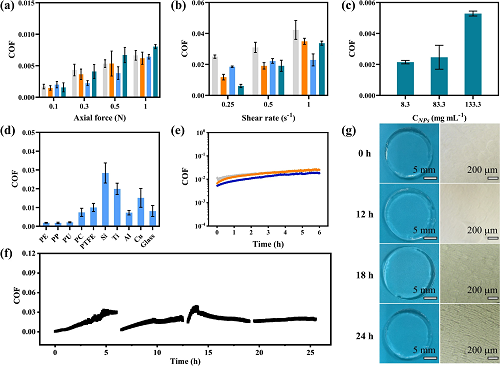
图5. NCGs的润滑性能。 (a) 在不同载荷下NCGs的摩擦系数(COF), (b) 在不同剪切速率下NCGs的摩擦系数; (c) 由不同浓度HAMA NPs制备的NCGs的COF; (d) NCGs与多种材料表面之间COF; (e–f) 在连续24小时的摩擦测试中COF的变化情况; (g) 6小时和24小时后,水凝胶的宏观和光学显微镜图像。
V NCGs的降解与生物安全性
图6总结了该材料在小鼠体内24周植入过程中的降解行为及组织反应。图6a显示了不同取代度HAMA NPs制备的NCGs在体外PBS酶溶液中的降解情况。图6b显示HAMA-28 NPs构建的NCGs在体内直至24周依然保持完整形态,未发生明显体积缩减或溶解;图6c–d证实材料植入后可完整取出,机械稳定性良好;图6e展示HE染色结果,材料周围组织仅形成薄纤维包膜,炎症细胞浸润轻微,无坏死或钙化;图6f–m结合血液指标与主要器官HE染色进一步证实,该水凝胶不会引起明显肝肾毒性或全身性炎症反应;该图整体证明该材料具有卓越的生物相容性与长期体内稳定性,为临床应用提供可靠依据。
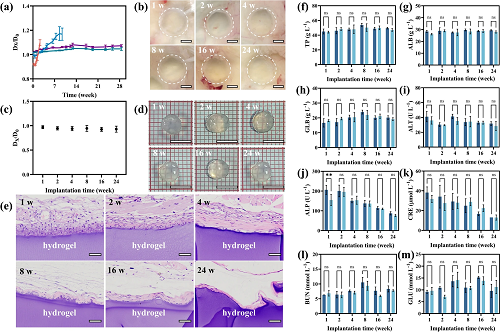
图6. NCGs的降解与生物安全性。 (a) 不同取代度的HAMA NPs所制NCGs在24周内的体外降解曲线; (b) HAMA-28构建的NCGs植入小鼠背部1–24周后水凝胶形貌保持完整的图像; (c–d) 植入位点的水凝胶直径变化; (e) 水凝胶植入周围组织的HE染色图像; (f–m) 皮下植入后小鼠的肝肾功能指标变化。
VI 总结
本研究提出了一种基于纳米粒子构建的不溶胀润滑水凝胶新策略,成功解决了传统水凝胶在溶胀、降解和润滑性能方面的关键瓶颈。该材料不仅在复杂生理条件下展现出长期结构稳定性和卓越润滑性,还具备优异的体内生物相容性与安全性。相关成果为高性能、长效型水凝胶材料的设计提供了新思路,为其在医疗器械涂层、植入物界面润滑以及组织工程支架等多领域的临床转化应用奠定了坚实基础。未来,该技术有望广泛服务于精准医疗和先进生物制造等前沿领域。
作者简介

李云峰
本文通讯作者
吉林大学 教授
▍主要研究领域
高分子胶体(纳米粒子)的非平衡自组装;高分子动态水凝胶及生物医用;微流控器官芯片和3D生物打印。
▍主要研究成果
李云峰,吉林大学超分子结构与材料全国重点实验室教授。主要从事超分子自组装及生物材料研究,仿生设计并建立了高分子胶体非平衡自组装新体系;开拓了具有生物相容性的非平衡自组装超分子材料;建立了创制高分子胶体水凝胶的新方法,实现了其在组织修复, 肿瘤模型构建等方面的生物医学应用。在Nat. Commun., Sci. Adv., PNAS,Angew. Chem. Int. Ed.,CCS Chem等期刊发表60余篇论文,引用5000余次。
▍Email:yflichem@jlu.edu.cn
撰稿:原文作者
编辑:《纳微快报(英文)》编辑部
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
转载本文请联系原作者获取授权,同时请注明本文来自纳微快报科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3411509-1497149.html?mobile=1
收藏

