 精选
精选
研究背景
在精准医疗时代,核酸检测技术是疾病精准防控和诊治的重要手段,需要突破的关键技术包括:一、无需纯化和酶扩增的快速检测。传统方法(如PCR)依赖酶促扩增,需预先进行核酸纯化,导致检测流程延长、成本增加,且对微量临床样本(如液体活检中的循环核酸)造成不可逆损耗,制约其在床旁诊断(POCT)和资源有限场景的应用;二、无扩增的高灵敏检测。现有技术的灵敏度受限于靶标-信号转换机制(如荧光标记效率、电化学界面噪声),低丰度靶标检测往往需扩增,但扩增可能引入偏差,影响结果可靠性;三、多靶标的通用检测技术。多数检测系统针对单一靶标优化(如特定miRNA或病原体RNA),难以通过模块化设计快速适配新发变异或不同标志物,无法满足多靶标通用检测的临床需求。因此,突破这些技术瓶颈,开发兼具免扩增、高灵敏、高特异且广泛适用的新一代核酸检测平台,已成为推动分子诊断技术革新的关键突破口。
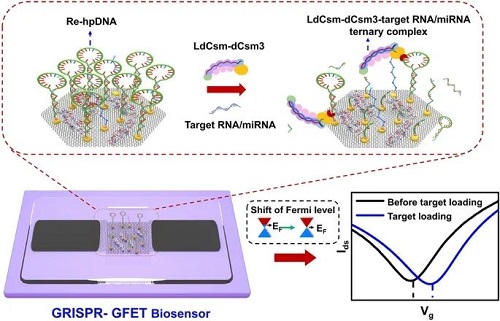
Universal Amplification-Free RNA Detection by Integrating CRISPR-Cas10 with Aptameric Graphene Field-effect Transistor
Mingyuan Sun, Zhenxiao Yu, Shuai Wang, Jiaoyan Qiu, Yuzhen Huang, Xiaoshuang Chen, Yunhong Zhang, Chao Wang, Xue Zhang, Yanbo Liang, Hong Liu, Qunxin She, Yu Zhang*, Lin Han*
Nano-Micro Letters (2025)17: 242
https://doi.org/10.1007/s40820-025-01730-3
本文亮点
1. "分子剪刀-微纳电子"集成检测新范式:将III型CRISPR-Cas10系统与石墨烯场效应晶体管(GFET)集成,构建了一种“分子剪刀-纳米电子”协同传感平台。该系统无需核酸预扩增即可实现无标记超灵敏检测,为分子诊断提供了全新技术路径。
2. 双机制协同实现aM级检测:通过蛋白质工程改造获得具有持续ssDNA切割活性的突变型CRISPR-Cas10效应复合物;设计高电荷密度的发夹式DNA报告子增强信号转导。两者协同精准调控GFET费米能级,使检测灵敏度达到aM级。
3. 通用型分子诊断平台:该技术可直接检测临床样本中的中等长度RNA或miRNA。其模块化设计(如可编程crRNA间距序列)可快速适配不同靶标,在精准医疗、即时诊断和基础研究等领域具有广泛应用前景。
内容简介
无扩增、高灵敏和特异性的核酸检测对于健康监测和诊断至关重要。III型CRISPR-Cas10系统通过CRISPR相关蛋白效应器提供病毒免疫,从而实现了一种新的核酸诊断工具。基于此,山东大学韩琳、张宇教授团队与山东大学微生物改造全国重点实验室佘群新教授团队合作提出一种“分子剪刀-微纳电子”协同传感平台,将CRISPR-Cas10系统与GFET创新性融合,构建了一种无需核酸扩增的高灵敏度、通用型CRISPR-GFET生物传感平台。
首先通过对Ldcsm效应复合物进行Csm3ᴰ3⁴ᴬ位点定向突变,显著提升了CRISPR系统的反式切割活性,从而实现信号放大功能;随后将GFET平台与AuNPs介导的re-hpDNA进行集成,并引入优化后的Ldcsm-dCsm3效应复合物,构建CRISPR-GFET生物传感器。利用re-hpDNA的高电荷密度特性与CRISPR系统介导的ssDNA剪切传感机制的协同效应,实现了GFET费米能级的有效调控,大幅提高了检测灵敏度。基于GFET的优异电学特性和CRISPR系统的可编程优势,CRISPR-GFET成功实现了多种核酸分子(包括中等长度RNA和miRNA)的无标记、无扩增、高灵敏度和高特异性检测,检测限达到aM水平,为分子诊断提供了多功能、可扩展的技术工具。此外,该平台在咽拭子和血清样本检测中表现出优异的抗干扰性能,可在不经过提取、纯化和扩增等复杂预处理步骤的情况下,直接实现血清样本中miRNA-155的检测,避免了核酸扩增和交叉污染,并有效降低了假阳性风险,为癌症早期诊断、传染性疾病监测提供了高效、可靠的技术支撑。
图文导读
I “分子剪刀-微纳电子”集成传感平台
本研究提出一种“分子剪刀-微纳电子”集成传感平台,通过将具有增强反式切割活性的突变型CRISPR-Cas10系统(LdCsm-dCsm3)与石墨烯场效应晶体管(-GFET)进行集成,实现了无需核酸扩增的高灵敏度分子检测。首先通过对LdCsm效应复合物的Csm3ᴰ3⁴ᴬ位点进行定向突变,显著提升了其反式切割活性;随后利用金纳米颗粒(AuNPs)介导的高电荷密度发夹式DNA报告子(re-hpDNA)修饰GFET传感界面,构建了GFET基底芯片。当靶分子与CRISPR-Cas10效应复合物结合时,激活的Cas10 DNase会高效切割GFET表面的re-hpDNA,导致其从石墨烯表面脱离,通过电荷密度变化精准调控GFET费米能级,最终实现了对血清或咽拭子样本中RNA和miRNA的aM级高灵敏度、高特异性检测。该平台兼具CRISPR系统的分子识别特异性与纳米电子器件的超高灵敏度,突破了传统核酸检测依赖扩增的技术瓶颈,为精准医疗提供了通用型分子诊断新工具。

图1. CRISPR-GFET的采样、检测和工作原理示意图,用于对RNA样品进行免扩增和超灵敏检测。
II CRISPR-Cas10系统的设计及性能研究
在CRISPR-Cas10系统设计方面,首先构建了LdCsm效应复合物。具体而言,将Lactobacillus delbrueckii III-A型CRISPR-Cas系统中的Cas基因克隆至质粒表达载体,同时将含有特定靶序列的迷你CRISPR阵列间隔区克隆至另一质粒中。上述两个质粒共同转化至Escherichia coli后,可分别驱动Cas蛋白和前crRNA转录本的表达,进而在宿主中组装形成LdCsm核糖核蛋白(RNP)复合体(图2a)。该复合体中的crRNA能够特异性识别其互补靶RNA序列,并形成靶RNA-LdCsm三元复合物(图2b)。靶RNA的结合诱导Cas10亚基中HD结构域构象变化,继而激活其对单链DNA(ssDNA)的剪切活性(图2c)。然而,由于Csm3作为大骨架亚基具备RNA核酸酶活性,其介导的靶RNA降解会中断该过程,从而限制ssDNA剪切反应的持续性。为了突破这一限制性调控,对LdCsm效应复合物中Csm3亚基的第34位天冬氨酸进行了定点突变,将其替换为丙氨酸(D34A)。这一突变成功阻断了靶RNA的降解活性,构建出功能改良的LdCsm-dCsm3效应复合物(图2d)。理论上,该突变体能够稳定结合靶RNA或miRNA,并持续激活Cas10介导的ssDNA剪切,达到信号放大的效果(图2e)。
为验证LdCsm-dCsm3对靶RNA和miRNA的结合能力,研究人员采用非变性聚丙烯酰胺凝胶电泳分析其与靶RNA的杂交情况。结果表明,所有处理组均可观察到明显的荧光迁移带,且目标RNA的迁移率明显低于非靶RNA,表明其已与LdCsm-dCsm3形成稳定三元复合物(图2f)。
随后,为评估LdCsm与LdCsm-dCsm3对ssDNA的剪切能力,研究团队设计了5'-FAM与3'-BHQ标记的全CA序列报告子(FQ-fCA)进行荧光检测。结果显示,识别靶RNA后,两种复合体均可激活Cas10 HD结构域,剪切FQ-fCA探针并释放荧光信号(图S1)。值得注意的是,LdCsm-dCsm3效应复合物产生的相对荧光强度(RFI)显著高于LdCsm效应复合物(图2g),表明Csm3突变增强了ssDNA剪切反应的连续性,并具备显著的信号放大潜力。
尽管LdCsm-dCsm3具备剪切ssDNA的能力,其序列偏好性尚未完全阐明。先前研究表明该系统可能偏好剪切CT或CA二核苷酸序列,但缺乏系统验证。为此,研究人员设计了全CT序列报告子(FQ-fCT)以作比较。实验结果显示,FQ-fCA剪切产生的荧光信号明显强于FQ-fCT(图2h),表明LdCsm-dCsm3对CA序列具有更强的剪切功能。
此外,为探讨靶RNA长度对LdCsm-dCsm3激活效率的影响,研究团队设计了不同原间隔长度(20 – 64 nt)的靶RNA序列,这些序列在3'-反标签区域与crRNA的5'-标签存在错配(匹配情况见图S3)。测定其剪切FQ-fCA的信号后发现,随着靶RNA长度增加,RFI呈先升高后下降趋势,其中36 nt长度的RNA激活效果最强,而小于28 nt的靶RNA激活能力显著下降(图2i及插图)。这一结果说明,在5'-重复标签存在错配的条件下,长度在20 nt以上的靶RNA均可激活LdCsm-dCsm3,其中36 nt为最优长度,表明RNA长度对复合体活化具有显著影响。
综上所述,该研究系统性揭示了CRISPR-Cas10系统对靶RNA的识别能力、ssDNA剪切活性及其序列偏好性。通过抑制Csm3的核酸酶活性,可稳定复合物的激活态,增强对ssDNA的持续剪切能力及信号放大能力。LdCsm-dCsm3效应复合物在靶RNA识别、反应持续性及剪切反应的可控性方面表现优异,展现了在RNA检测领域的广阔应用前景。
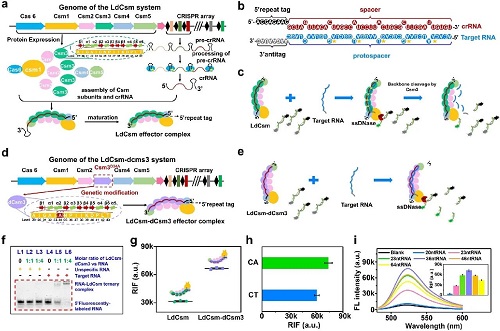
图2. (a) LdCsm和(d) LdCsm-dCsm3效应复合物的制备和结构示意图。绿色和紫色虚椭圆框分别是Csm3和dCsm3的结构;(b) LdCsm/LdCsm-dCsm3效应复合物中目标RNA与crRNA的碱基互补配对;(c) LdCsm和(e) LdCsm-dCsm3效应复合物特异性识别目标RNA并反式剪切荧光淬灭ssDNA报告子的示意图;(f) 目标RNA与LdCsm-dCsm3效应复合物杂交的非变性聚丙烯酰胺凝胶电泳分析。“+”表示存在, “-”表示不存在;(g) 活化的LdCsm和LdCsm-dCsm3效应复合物剪切FQ-fCA所释放的RFI对比;(h) 活化的LdCsm-dCsm3效应复合物剪切FQ-fCT和FQ-fCA所释放的RFI对比;(i) LdCsm-dCsm3与不同长度的靶RNA结合时,剪切FQ-fCA后的荧光光谱和释放的RFI对比。
III CRISPR-GFET生物传感器的性能表征、可行性验证与优化
在GFET器件的制备方面,研究人员采用PDMS/LIG转移电极和简单的一步粘贴法制备范德华接触式石墨烯场效应晶体管。这种制备方法具有以下优势:(1)PDMS/LIG电极与半导体层之间可形成无污染的范德华界面;(2)LIG材料中的含氧官能团能够有效掺杂石墨烯,显著降低接触电阻。得益于这些特性,所制备的GFET器件展现出优异的载流子传输性能,其空穴和电子迁移率分别达到3584 cm2/(V·s)和3132 cm2/(V·s)(图S4d)。
基于该高性能GFET平台,研究人员进一步整合优化的CRISPR-Cas10系统,制备新型CRISPR-GFET生物传感器。详细的器件制备流程和传感机制如图3a-b所示。为验证生物传感器的构建过程,研究采用多尺度表征技术进行了系统验证。图3c和S5a分别显示了扫描电子显微镜(SEM)和能量色散X射线光谱(EDS)分析。结果表明,在石墨烯表面形成了直径约为10 nm的高密度AuNPs。此外,XPS在Au 4f7/2和Au 4f5/2处检测到了Au 4f特征峰,进一步证实了AuNPs的成功修饰(图S5c)。AuNPs的引入不仅为后续报告子的附着提供了稳定的介质载体,且与直接附着于传感沟道表面的报告子相比,AuNPs具有更大的比表面积,能够有效降低固相芯片表面可能存在的空间位阻。固定FAM标记的硫醇化线性DNA报告(re-FAM-lDNA)后,荧光图像和热图中的荧光强度增加,证实了通过Au-S键固定reDNA方法的可行性(图S5b)。随后,利用电化学阻抗谱(EIS)进一步研究了re-hpDNA的固定情况。re-hpDNA的负电性阻碍了[Fe(CN)₆]3⁻/⁴⁻的扩散,导致电荷转移电阻(Ret)显著增加,进一步确认发夹报告子成功固定(图3d)。此外,XPS中检测到的S 2p、P 2p和N 1s信号亦提供了佐证(图S5d-f)。上述结果表明,利用金纳米粒子作为固定re-hpDNA的介质,成功构建了CRISPR-GFET基底芯片。
与基于CRISPR系统的RNA液相检测不同,CRISPR-GFET传感器的剪切反应发生在固液界面。在RNA存在时,LdCsm-dCsm3的Cas10 HD结构域被激活,剪切固定的re-FAM-lDNA,使芯片荧光显著降低(图S5b),EIS结果也显示Ret下降(图3d),证实报告子的剪切在固体表面发生。Id-Vg曲线进一步证明了CRISPR-GFET生物传感器的构建和可行性:AuNP修饰和re-hpDNA固定引起Vdirac负移;无靶RNA时,LdCsm-dCsm3中失活的Cas10无法剪切re-hpDNA,导致Vdirac几乎没有移动;靶RNA存在时因re-hpDNA剪切,Vdirac正向移动(图3e)。
由于PBS中的移动离子对re-hpDNA产生屏蔽效应,研究团队通过调控PBS浓度以减缓德拜屏蔽现象。实验结果表明,降低PBS浓度可显著增强GFET的电信号响应,其中20 μM PBS(对应德拜长度λD≈15.5 nm)条件下信号趋于稳定(图S6d),且对器件性能影响较小,能有效避免假阳性结果(图S6e),因此被确定为标准缓冲条件。此外,研究对多种反应参数进行了系统优化,包括温度、金属离子浓度、孵育时间、LdCsm-dCsm3浓度以及DNA报告子浓度。结果显示,37°C及含10 mM MgCl₂和50 mM KCl的缓冲体系最适合该体系反应。孵育时间的优化结果(图 3f)显示,信号强度随孵育时间延长而提升,但在45分钟后增长速率减缓。为兼顾灵敏度与检测效率,研究将45分钟作为标准孵育时间。LdCsm-dCsm3效应复合物的浓度直接影响传感性能,其机制涉及目标RNA的结合效率及DNA报告子的反式剪切能力。较低浓度下,RNP数量受限,限制反应活性;而较高浓度时,因分子体积较大而降低扩散与结合效率。浓度梯度测试结果显示,在 20 nM时可获得最大ΔVDirac信号(图3g),为最优使用浓度。同时,固定于GFET表面的re-hpDNA浓度也显著影响传感效果。较高的DNA覆盖率可提升反式剪切反应的上限,但过高密度可能引发空间位阻,抑制效应复合物的结合。浓度筛选实验表明,在1 – 10 μM范围内,5 μM的re-hpDNA可产生最强响应信号(图3h),因此被选为最佳固定浓度。

图3. (a) CRISPR-GFET生物传感器的制造过程和(b) 工作机制示意图;(c) 在石墨烯表面沉积AuNPs后的扫描电镜图像;(d)石墨烯工作电极在沉积AuNP、修饰e-hpDNA并与含有目标RNA的LdCsm-dCsm3混合物孵育后的EIS;(e) CRISPR-GFET生物传感器在AuNP沉积、e-hpDNA修饰以及与含有非目标RNA和目标RNA的LdCsm-dCsm3混合物孵育前后的逐步转移曲线;生物传感器在(f) 反应时间、(g) LdCsm-dCsm3效应复合物和(h) re-hpDNA浓度方面的优化。
IV CRISPR-GFET生物传感器对中等长度RNA的传感性能
在优化后的检测条件(37 °C,孵育时间为45 分钟,LdCsm-dCsm3浓度为20 nM)下,研究人员实现了基于CRISPR-GFET的RNA检测。具体操作中,将由LdCsm-dCsm3效应复合物、剪切缓冲液以及不同浓度(1 fM – 10 pM)的目标RNA组成的混合液依次注入传感器装置中。如图4a所示,随着靶RNA浓度的增加,Vdirac呈现逐渐正向偏移。图4b所示的校准曲线表明,目标RNA浓度的对数值与响应信号之间具有良好的线性关系,其回归方程为ΔVdirac = 10.24 lgC + 173.17,拟合优度(R2)为0.9930,其检测限(LOD)低至214 aM。当前多数基于CRISPR的FET传感器通常采用线性DNA报告子(re-lDNA)构建。为此,研究人员亦使用re-lDNA构建了CRISPR-GFET传感器,并与使用发卡结构探针(re-hpDNA)的传感器进行对比分析。图4b中的绿色曲线显示,re-lDNA传感器同样成功实现了RNA检测,其LOD为274 aM,回归方程为ΔVdirac = 7.91 lgC + 131.33,R2为0.9888,其灵敏度仅为re-hpDNA构建传感器的约77%。
基于电双层(EDL)理论,GFET的狄拉克点偏移量可由公式ΔVdirac =eΔn/CT表示,其中e为基本电荷,Δn为石墨烯载流子密度变化量,CT为总栅电容。由于CRISPR-GFET的总电容几乎恒定,Δn的变化反映了石墨烯表面电荷密度的变化。如图S14所示,固定于GFET表面的re-hpDNA诱导的Vdirac偏移量约为re-lDNA的1.53倍,说明其表面电荷密度更高。这表明,与re-lDNA相比,re-hpDNA被剪切后可以产生更多的电荷变化量。考虑LdCsm-dCsm3与目标RNA形成三元复合物的最佳剪切位点为CA二核苷酸,结合结构分析图(图4c、4d),re-hpDNA在剪切后损失了更多的磷酸-脱氧核糖骨架结构。尽管LdCsm-dCsm3对DNA的剪切具有一定随机性发生非特异剪切,但在优化孵育时间后,传感器平台中的报告子能够基本完全剪切,从而使re-hpDNA传感器产生更大的Δn和更显著的正向迁移(图4b)。总体而言,得益于其较高的电荷密度和有效的剪切传感机制,re-hpDNA构建的CRISPR-GFET表现了出优于传统re-lDNA CRISPR-GFET的检测性能。此外,该检测方法在检测限和检测时间方面,与目前主流的无扩增CRISPR检测方法(如比色法、电学方法、表面增强拉曼光谱(SERS)、荧光法、电化学发光法、电化学法)相当甚至略有优势(见表S1)。另外,该传感器采用激光直写技术制备低成本激光诱导石墨烯(LIG)作为电极,简化了传感器制造流程,使每个器件的成本降至约1.16美元(表S1)。其中,基底材料是主要成本构成部分,采用更廉价的替代材料如聚酰亚胺(PI)有望进一步降低整体成本。因此,该传感器在实现超低检测限的同时,还具有成本低、工艺简便等优势。
在传感器特异性测试中,研究人员将空白样品、含有10 pM非靶RNA(RNA-1、RNA-2、RNA-3)及含有靶RNA的LdCsm-dCsm3混合液分别应用于传感器平台。如图4e所示,靶标RNA所引发的响应明显高于非特异性干扰,达其6 倍,表明该传感器具有良好的特异性识别能力。
为评估其可重复性与长期稳定性,研究人员制备了六个平行传感器,并在1 pM和10 pM RNA浓度下进行测试。所得响应的相对标准偏差(RSD)分别为4.48%与3.33%(图S16),显示传感器在制造过程中的高度一致性。进一步地,通过测量在4 °C储存0至3天后的电信号响应(图4f),发现其对10 pM RNA的响应信号保持率分别为97.78%、95.55%和93.33%,波动幅度小于7%,验证了其良好的存储稳定性。
为验证检测准确性,研究者还将CRISPR-GFET的结果与反转录定量PCR(RT-qPCR)进行比对。在分析含5 pM目标RNA和100 pM非目标RNA混合溶液时,RT-qPCR得到的Ct值为26.18,CRISPR-GFET的ΔVdirac为57.33 mV。两者所估算的目标RNA浓度分别为4.329 pM和4.870 pM,回收率分别为86.58% 与97.40%,RSD分别为7.60%与4.03%(表S2)。整体来看,CRISPR-GFET 具备优异的准确性,并且操作简便、检测时间短,在避免假阳性方面亦优于基于扩增的CRISPR检测方法(见表S1)。
最后,为评估其在复杂生物样本中的适用性,研究团队向阴性咽拭子溶液中添加不同浓度的目标RNA,并按标准流程进行检测(图4g)。结果显示,尽管背景信号略有升高,响应信号有所下降,这可能是由于样本中存在多种非目标RNA、DNA和蛋白质造成的竞争结合与非特异性激活所致。然而,在实际生物基质中,传感器依然能够识别目标RNA,显示出良好的抗干扰能力和适用性。利用图4b中的标准曲线对加标样品中的RNA浓度进行了反校准,并分析了回收率及其与实际加标浓度的偏差。如表S3所示,检测到的RNA浓度的回收率为81.68%-98.81%,RSD值为3.94%-6.19%,表明CRISPR-GFET生物传感器能够准确可靠地检测模拟咽拭子样品中的RNA。

图4. (a) 发夹式CRISPR-GFET生物传感器与含有不同浓度RNA的LdCsmd-Csm3混合物孵育后的转移曲线;(b) re-hpDNA生物传感器和re-lDNA生物传感器的ΔVdirac与不同浓度RNA之间的校准曲线;(c) re-lDNA生物传感器和(d) re-hpDNA生物传感器的传感机制,上图分别为re-lDNA和re-hpDNA的结构;(e) CRISPR-GFET生物传感器对非特异性RNA和目标RNA的电学信号响应;(f) CRISPR-GFET生物传感器的稳定性;(g) CRISPR-GFET生物传感器对DEPC水和咽拭子中目标RNA检测性能的对比。
V CRISPR-GFET生物传感器对miRNA-155的传感性能
为了进一步验证CRISPR-GFET作为通用平台的可行性,以miRNA-155为例,进一步探讨CRISPR-GFET在miRNA检测中的应用潜力。研究表明,目标RNA的长度缩短后,CRISPR-Cas10系统的检测效率也会受到显著影响。为克服该结构性限制,研究团队在在LdCsm-dCsm3 CRISPR阵列中引入定点突变(A→T),构建了pUCE-miRNA-A-5U质粒,生成了LdCsm-dCsm3-155-A-5U效应复合物。该设计使得crRNA的5’-重复标签与miRNA-155的3’-反标签形成精准错配(图4-20a),突破了短链miRNA无法提供替代3’-反标签的结构限制。与LdCsm-dCsm3-155相比,LdCsm-dCsm3-155-A-5U剪切报告子所产生的RFI显著提高(图5b),表明其具有更优异的剪切效率。
基于此,研究人员构建了miRNA靶向的CRISPR-GFET生物传感器,并验证其在乳腺癌早期筛查中的潜在应用价值(图5c)。在性能测试方面,首先评估了CRISPR-GFET生物传感器对miRNA-155的灵敏性。如图S23c所示,在1 fM至1 nM浓度范围内,随着miRNA-155浓度的升高,Vdirac呈递增趋势。拟合回归方程为ΔVdirac = 8.03 lgC + 131.57,拟合度R2达到0.9990,LoD为427 aM(图5d)。随后,引入包含miRNA-155、miRNA-4484、miRNA-4732、miRNA-126及不含miRNA的LdCsm-dCsm3-155-A-5U混合物,考察生物传感器的特异性。结果显示,目标miRNA引起的电信号显著高于非特异性miRNA和空白样本的信号,其响应强度为非特异性miRNA的4.7倍以上(图5e),显著的信号差异表明该传感器对目标miRNA具有优异的特异性识别能力。为了进一步评估传感器对靶序列中碱基错配的识别能力,研究团队测试了CRISPR-GFET对不同程度错配miRNA的电学响应情况。电响应结果表明,三碱基与四碱基错配可与完全匹配序列有效区分;而对于单碱基与双碱基错配,传感器的分辨能力相对较弱(图5f),这可能是由于部分错配仍能激活复合物,引发报告子解。此外,即使均为双碱基错配,错配位点对激活程度的影响亦不同,尤其是3-4 nt区域更靠近识别核心区,对复合物敏感性更强。
为进一步验证传感器的实际应用潜力,研究人员在健康人血清中加入miRNA-155,评估其在复杂生物基质中的抗干扰能力。如图5g所示,在血清样本中,传感器背景信号增加,而目标miRNA的响应信号下降,但两者仍维持明显的信号差异。分析认为,这一现象源于血清中存在微量内源性miRNA-155激活效应复合物,导致背景信号升高;而血清加标样本中的过量非特异性RNA则抑制了目标响应信号的增强。上述结果表明该传感器在复杂样本中仍具良好的特异性和抗干扰性能。在上述基础上,研究进一步采集了健康人及乳腺癌患者的血清样本,评估传感器在潜在临床检测中的应用能力。图S32展示了各组样本中miRNA-155表达的差异性。为准确估算血清中miRNA-155的浓度,研究人员以血清中加标样本(1 pM至1 nM)构建标准曲线,公式为ΔVdirac = 6.67 lgC + 116.4(R2 = 0.9989,图5g)。据此计算,健康人样本中miRNA-155浓度为0.1 – 0.8 pM,而乳腺癌患者血清中浓度显著升高至10 – 80 pM(图5h),两组差异具有统计学意义(**p < 0.01,图5i)。此外,该检测流程无需RNA提取、纯化和扩增,显著简化了操作步骤,验证了该CRISPR-GFET 生物传感器作为乳腺癌临床辅助诊断工具的实际应用潜力。
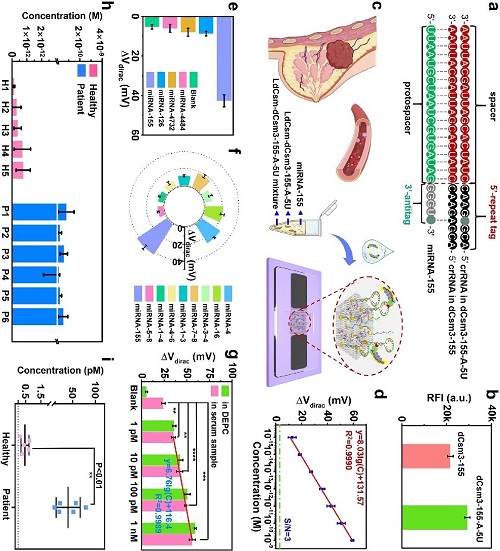
图5. (a) 设计用于检测miRNA-155 crRNA及其重复突变衍生物(155-A-5U)示意图。重复标签中的突变碱基显示为深蓝色;(b) LdCsm-dCsm3-155和LdCsm-dCsm3-155-A-5U剪切FQ-fCA的RFI比较;(c) 乳腺癌检测示意图;(d) CRISPR-GFET生物传感器的ΔVdirac与不同浓度miRNA-155之间的校准曲线;(e) CRISPR-GFET生物传感器对非特异性miRNA和miRNA-155的电学信号响应;(f) CRISPR-GFET生物传感器对单碱基错配miRNA(miRNA-155-4、miRNA-155-16)、双碱基错配miRNA(miRNA-155-3-4、miRNA-155-3-4、miRNA-155-7-8)、三碱基错配miRNA(miRNA-155-1~3、miRNA-155-4~6)、四碱基错配miRNA(miRNA-155-1~4、miRNA-155-5~8)和miRNA-155的电学信号响应;(g) CRISPR-GFET生物传感器对DEPC水和血清中miRNA-155的电学信号响应的对比,包含CRISPR-GFET生物传感器的ΔVdirac与血清中不同浓度miRNA-155之间的校准曲线;(h)健康人和乳腺癌患者血清样本中miRNA-155的浓度;(i) 健康人和乳腺癌患者血清中miRNA-155浓度的统计比较。
VI 总结
本研究通过将CRISPR-Cas10系统与GFET深度整合,成功构建了一种免核酸扩增的高灵敏度通用型RNA检测平台。研究揭示了CRISPR-Cas10系统的分子作用机制:靶RNA特异性激活Cas10蛋白的HD结构域,介导ssDNA的反式切割并表现出对CA二核苷酸的优先剪切特性。通过引入Csm3ᴰ3⁴ᴬ突变构建的LdCsm-dCsm3效应复合物,在阻断RNA酶活性的同时维持ssDNA持续剪切能力。采用AuNPs介导的re-hpDNA功能化方案制备GFET基底芯片结合LdCsm-dCsm3效应复合物,其在优化条件下展现出卓越性能:灵敏度较直链报告子体系提升1.34倍,对三碱基以上错配序列具有优异鉴别能力,4℃储存3天信号衰减<7%。该平台成功实现了不同RNA分子的通用检测(短链RNA 427 aM,中等长度RNA 214 aM),在临床样本中回收率达81.68% – 98.81%,并能准确区分健康人与乳腺癌患者血清miRNA-155表达水平。这项研究不仅为CRISPR与纳米电子器件的结合应用提供了范例,更为开发新一代高灵敏度、高特异性、通用型分子诊断工具开辟了新途径,具有重要的科学价值和临床转化前景。
作者简介

韩 琳
本文通讯作者
山东大学 教授
▍主要研究领域
面向生命健康和海洋环境监测的新型生物传感芯片与系统研发,开发了10余种国际先进水平的生物芯片(DNA、miRNA、抗原、抗体、外泌体、单细胞等)。
▍主要研究成果
山东大学海洋研究院/ 集成电路学院教授,博士生导师,山东大学杰出中青年学者,齐鲁青年学者,山东省杰出青年基金获得者。近五年,以第一或通讯作者在 Chemical Society Review、Advanced Materials、Advanced Functional Materials、ACS Nano、Advanced Healthcare Materials等国际知名期刊发表学术论文80余篇,申请专利60余项,实现了千万级的技术成果转化1项,相关成果被中央人民广播电台特别报道。主持国家重点研发计划课题、国家自然基金、山东省杰出青年基金、山东省重大创新工程项目课题等10余项,担任山东大学青年交叉科学群体项目首席。曾获中国金桥奖一等奖、青岛市拔尖人才、山东大学杰出中青年学者、山东大学十大高价值应用科技成果奖、中国济南新动能国际高层次人才创新创业大赛一等奖等荣誉。担任卓越期刊BMEMat和Interdisciplinary Medicine青年编委、山东省医学会类器官分会第一届委员会副主任委员、生物标志物与人工智能应用山东省工程研究中心副主任和济南市微纳传感芯片与智能装备重点实验室主任。
▍Email:hanlin@sdu.edu.cn

张 宇
本文通讯作者
山东大学 教授
▍主要研究领域
新型微纳传感材料、器件和系统,微流控技术,海洋环境检测技术的研究开发及其应用、宽禁带半导体材料与器件。
▍主要研究成果
张宇,山东大学 教授,博士生导师,承担和参与国家重点研发计划,山东省重点研发计划,国家自然基金,横向项目等10余项,发表SCI论文90余篇,申请专利80余项,科技成果转化多项。2022年、2023年和2024年分别获得山东大学优秀硕士、博士学位论文指导奖。2024年获得山东省金桥奖一等奖。。
▍Email:yuzhang@sdu.edu.cn
撰稿:原文作者
编辑:《纳微快报(英文)》编辑部
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2023 JCR IF=31.6,学科排名Q1区前3%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
转载本文请联系原作者获取授权,同时请注明本文来自纳微快报科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3411509-1489248.html?mobile=1
收藏

