 精选
精选
研究背景
全球范围内,癌症始终作为一种难治性重大疾病,对人类健康与生命构成严重威胁。近年来,肺癌已成为癌症相关死亡的主要诱因,2022年导致约180万例死亡。临床常用CYFRA21-1、CA125、SCC-Ag等重要肿瘤标志物进行非小细胞肺癌评估,约占肺癌检测的85%。此外,胰腺癌作为致死率极高的"癌中之王",其诊疗难度极大,而CA 19–9肿瘤标志物已被验证并广泛应用于该疾病的诊断。因此,实现对相关肿瘤标志物的灵敏精准检测,对于癌症早期筛查与诊断具有重要意义。
Intelligent Point﹐f〤are Biosensing Platform Based on Luminescent Nanoparticles and Microfluidic Biochip with Machine Vision Algorithm Analysis
Yuan Liu, Xinyue Lao, Man-Chung Wong, Menglin Song, Yifei Zhao, Yingjin Ma, Qianqian Bai, Jianhua Hao*
Nano-Micro Letters (2025)17: 215
https://doi.org/10.1007/s40820-025-01745-w
本文亮点
1. 提出一种由量子点发光体系、生物芯片与机器视觉算法构成的新型智能生物传感平台,用于即时癌胚抗原(CEA)蛋白检测。
2. 实现了模式选择性的多重光发射,其中,通过控制极性液体和水的蒸发,可以容易地操控FL、RTP和EL这三种发射模式。与市售侧向层析检测试纸条等商业化生物检测设备相比,该诊断平台对CEA浓度的检测限低至约0.021 ng mL⁻1,展现出优异的检测性能。
3. 机器视觉算法的应用提升了检测系统的便携性与集成特性,进一步拓展了即时生物传感技术的应用潜力。
内容简介
实现兼具便捷性与高灵敏度的即时肿瘤标志物生物检测,对于推动生物医学研究领域的癌症监测与筛查具有重要意义。香港理工大学郝建华等人设计并构建了一种集成量子点发光特性、微流控生物芯片与基于机器视觉算法的智能生物传感平台,用于即时肿瘤标志物诊断。所选用具备优异光致发光性能的量子点经特异性抗体修饰后,作为光学标记物应用于设计的夹心结构免疫分析法。针对该生物检测平台的传感研究表明,其具备灵敏度高达~0.021 ng mL⁻1、操作便捷性及系统集成性优异等多重优势。进一步采用人工合成唾液样本的对比测试结果显示,其检测性能优于市售快速检测试纸条。综合上述创新特性,本精密生物传感平台有望在未来即时肿瘤标志物诊断领域展现重要应用潜力。
图文导读
I 智能生物传感平台的机理
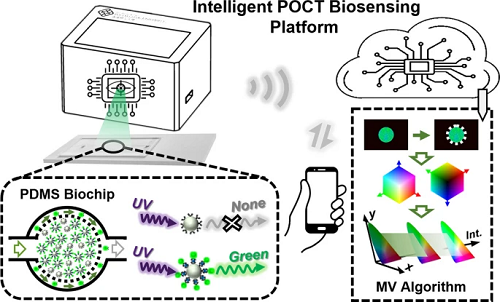
为实现即时肿瘤标志物检测,本研究设计并构建了一种智能生物传感平台,其工作原理如图1所示。简要流程如下:首先将预制备的多种试剂混合孵育以完成发光量子点偶联,随后将微流控生物芯片的成像数据上传至云端,最终通过智能手机端运行的机器视觉算法完成信号处理和检测结果输出。接下来,将缀合的PS微球注射到设计和制造的具有分离功能的基于PDMS的微流体生物芯片中。在紫外光照射后,未共轭PS微球表现出非发光性质;然而,QDs共轭PS微球呈现亮绿色发射,如图1的虚线框所示。随后,微流控生物芯片的光学图像被捕获,并通过WIFI信号传输上传到云端。然后,通过一些机器视觉算法对相关图像进行识别和分析,以研究和评估肿瘤标志物。
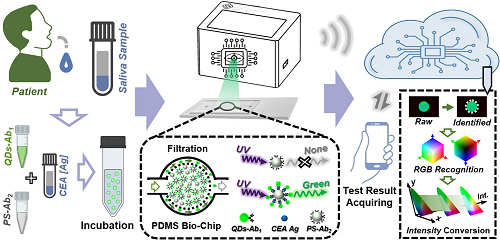
图1. 肿瘤标志物检测平台原理图,包含以下模块:唾液样本采集、夹心结构免疫分析试剂孵育、微流控生物芯片过滤未结合量子点、便携式生物传感平台获取发光图像、云端机器视觉算法分析,以及智能手机端检测结果输出。
II 形貌和光致发光性能研究
如图2所示,本研究对量子点进行了多维度表征分析,包括形貌特征、晶体结构、表面修饰及发光性能研究。图2a为CdSe/ZnS量子点的透射电子显微镜(TEM)图像,显示量子点呈现均匀形貌特征。如图S1所示,根据粒径分布图统计,量子点平均粒径约为11 nm。图2b顶部插图为CdSe/ZnS量子点的高分辨透射电子显微镜(HR-TEM)图像,可清晰观察到量子点优异的结晶性及规整的晶格条纹,并呈现出可见的快速傅里叶变换(FFT)图谱。图2b底部插图的亮场(BF)与暗场(DF)扫描透射电子显微镜(STEM)图像,初步揭示了CdSe/ZnS量子点的核壳结构特征。图2c为X射线衍射(XRD)谱图的晶体结构分析结果,其中显著的衍射峰表明量子点具有核壳结构,这与前期文献报道结果一致。
此外,本研究对聚苯乙烯(PS)微球的形貌特征进行了系统研究(图2d)。扫描电子显微镜(SEM)图像(图2d)进一步揭示了量子点在PS微球表面的偶联状态差异:当存在CEA肿瘤标志物偶联时(图2d上部插图),量子点清晰附着于PS微球表面;而未进行CEA肿瘤标志物偶联时(图2d下部插图),PS微球表面则保持相对洁净。图2e的Zeta电位分析结果,佐证了抗体在量子点及PS微球表面的成功修饰。图2f则对量子点的光致发光性能进行了表征,可见其发射峰位于530 nm附近,呈现明亮的绿色荧光(图2f插图),表明该量子点在后续CEA肿瘤标志物检测中具有潜在应用价值。图2g为CdSe/ZnS量子点可能的光学过程示意图,当紫外光照射核壳结构CdSe/ZnS量子点时,其可发射可见光波段光子(图2g左侧插图)。
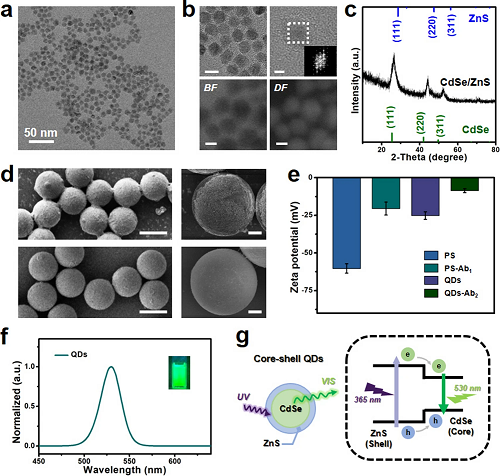
图2. 量子点及检测体系的表征分析。(a) 核壳结构CdSe/ZnS量子点的透射电子显微镜(TEM)图像;(b) 量子点的高分辨透射电子显微镜(HR-TEM)图像、快速傅里叶变换(FFT)衍射图谱及亮场/暗场扫描透射电子显微镜(STEM)图像;(c) 核壳结构量子点的X射线衍射(XRD)谱图;(d) 聚苯乙烯(PS)微球的扫描电子显微镜(SEM)图像:CEA蛋白偶联后与偶联前的形貌对比;(e) 抗体修饰前后PS微球与量子点的Zeta电位直方图;(f) 紫外光(365 nm)激发下量子点的光致发光(PL)发射光谱;(g) 紫外光照下核壳结构量子点发光过程示意图。
III 可逆RTP进行模式选择性重试具有浓缩和过滤性能的微流控生物芯片
所设计的微流控生物芯片展现出优异的分离与清洗性能,如图3a所示。具体而言,图3a展示了分离过程的光学图像,其中底部插图呈现了生物芯片的清洗过程:通过注入冲洗液,可实现PS微球的有效清洗。图3b则展示了微流控生物芯片过滤区域内PS微球的光学图像,对比了CEA肿瘤标志物偶联前后的状态。偶联后可见PS微球在过滤区域呈现明显的绿色荧光,进一步表明量子点已成功偶联至PS微球表面。
IV 生物传感平台的诊断特性
图3c展示了不同浓度CEA肿瘤标志物对应的归一化光致发光(PL)发射光谱。随着CEA浓度的增加,PL发射强度呈现上升趋势,这归因于PS微球表面偶联的量子点数量增加。图3d描绘了归一化峰值强度随CEA浓度(0.01-50 ng mL⁻1)的变化趋势。如图3e所示,在0.01-1.0 ng mL⁻1范围内,归一化强度与CEA浓度呈线性相关。为验证检测特异性,图3f选取Na⁺、K⁺、Ca2⁺、溶菌酶(LZM)、α-淀粉酶(α-AMS)、甲胎蛋白(AFP)、人血清白蛋白(HSA)及CEA等重要靶标进行了特异性实验。
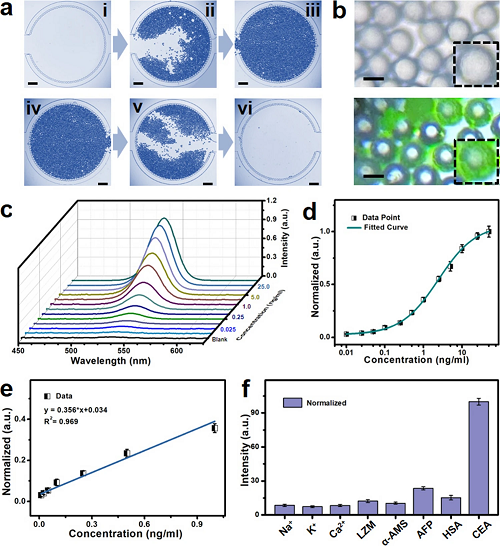
图3. 微流控生物芯片的分离清洗性能及生物传感特性研究。(a) 微流控生物芯片的分离性能与可清洗性能光学图像;(b) 无CEA偶联与有CEA偶联的PS微球光学照片;(c) 不同CEA偶联浓度下,偶联量子点的PS微球过滤后的发射光谱;(d) 微流控生物芯片对不同CEA偶联浓度的归一化强度响应及相关拟合曲线;(e) 微流控生物芯片中偶联并分离的PS微球用于CEA蛋白检测的线性关系;(f) CEA检测针对相关干扰物的特异性测试结果。
V 基于机器视觉算法的护理点生物传感平台
为实现即时肿瘤标志物诊断,本研究设计并构建了一种集成量子点发光、微流控生物芯片与机器视觉算法的智能生物传感平台,其结构如图4所示。图4a展示了该平台的原理示意图,主要由触摸屏、便携式电源(PPS)、微流控生物芯片、紫外(365 nm)LED光源、遮光片、光学透镜、滤光片、CMOS图像传感器、单片机(SCM)、云计算模块及智能手机终端构成。图4b展示了原始图像经算法处理后的荧光区域识别过程,该基于Python的机器视觉算法可自动识别和提取荧光区域的RGB值。针对所设计的CEA肿瘤标志物量子点发光夹心免疫分析体系,其发射光谱的波长与强度相互独立。
如图3c、d所示,随着CEA浓度的增加,发射光谱强度呈规律性变化。图4c展示了不同CEA浓度偶联下的光学图像,可见随浓度降低,荧光强度逐渐减弱。通过对不同浓度下获取图像的灰度及RGB色彩空间分析(图4d),其信号强度随CEA浓度增加呈现增长趋势。如图4e所示,通过机器视觉算法计算的CIE强度在CEA肿瘤标志物浓度从空白到50 ng mL⁻1范围内,展现出更优的增长趋势与定量关系。图4f展示了相关原理示意图,可见拜耳滤镜由红、绿、蓝三种原色组成,其中绿色像素占比达50%,是另外两种颜色的两倍,这种设计使其色彩敏感度与人眼更为接近。图4g则对比了三种不同图像分析方法的鉴别值,该值通过空白样本与最高浓度样本的荧光强度比值计算得出。
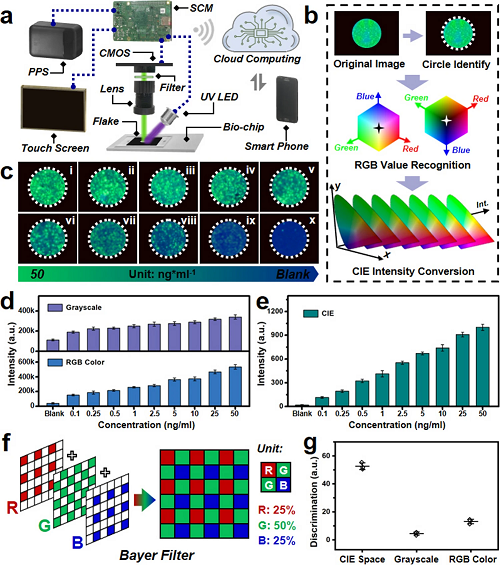
图4. 基于机器视觉算法的即时智能生物检测平台。(a) 集成式即时智能生物传感平台原理示意图;(b) 机器视觉算法图像识别工作流程;(c) 不同CEA浓度下微流控生物芯片分离区的光学图像;(d) 智能传感平台检测的CEA灰度强度与RGB强度计算结果;(e) 不同CEA浓度下智能传感系统的CIE强度响应;(f) CMOS电子元件所用拜耳滤镜原理示意图;(g) 基于CIE空间、灰度及RGB色彩空间的图像识别分析鉴别值对比。
VI 与LFA条的诊断特性比较
进一步对所设计的智能即时生物传感平台的实际应用潜力进行了评估。如图5所示,本研究采用了一系列测试样本,包括纯化人源CEA蛋白和人工唾液溶剂,以验证平台的检测能力。其中,人工唾液溶剂的制备流程参考已有研究,其原理示意图如图5a所示。如图5b所示,展示了两种商用LFA试纸条在不同CEA蛋白添加量下的光学图像。其中,上部图像为胶体金标记的比色法LFA试纸条(LFA-1),下部则为荧光法LFA试纸条(LFA-2)。为更客观比较诊断能力,图5c选取了各试纸条检测线的平行区域进行信号分析。此外,如图5d及补充图S18所示,本研究设计的智能生物传感平台同样被用于CEA肿瘤标志物唾液样本的检测性能评估。结果显示,随着CEA蛋白浓度的增加,CIE强度值呈现增长趋势。
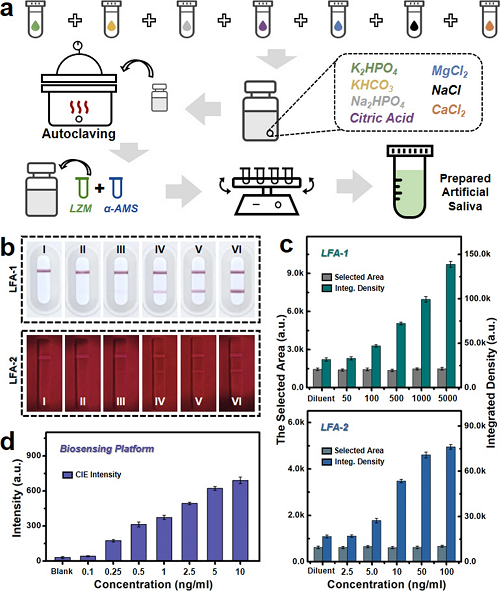
图5. CEA肿瘤标志物模拟样本检测性能对比。(a) 人工唾液溶剂制备原理示意图;(b) 两种商用CEA肿瘤标志物试纸条光学图像;(c) 商用试纸条检测线选定区域灰度值统计直方图;(d) 不同CEA浓度下智能生物传感平台CIE强度响应柱状图。
VII 总结
综上所述,本研究开发了一种基于微流控生物芯片与机器视觉算法的智能即时生物传感平台,用于CEA肿瘤标志物的检测。该平台采用具有优异发光性能的CdSe/ZnS核壳量子点作为夹心结构免疫分析的光学标记物,并结合分离清洗性能卓越的微流控生物芯片作为功能室组件,实现了约0.021 ng mL⁻1的高灵敏度诊断。同时,开发了基于Python的机器视觉算法,用于即时CEA检测的图像识别与分析。在唾液样本的实际应用评估中,与常用商用CEA试纸条相比,该平台展现出卓越的检测截止值。凭借其突出的系统设计与诊断能力,该智能生物传感平台在未来即时肿瘤标志物检测领域展现出巨大的应用潜力。
作者简介

郝建华
本文通讯作者
香港理工大学 讲座教授
▍主要研究领域
主要从事功能薄膜和二维材料及器件,应用于光电子、生物医学的掺杂发光材料和纳米能源的研究。
▍主要研究成果
香港理工大学应用物理学系讲座教授(Chair Professor)。香港研资局高级研究学者,美国光学学会会士、英国物理学会会士和英国皇家化学会会士。发表了SCI学术论文~400余篇,包括近年来以通讯作者发表在国际著名期刊Nature Materials, Nature Commun., Adv. Mater., JACS, Angew. Chem. Int. Ed., Chem. Soc. Rev., Appl. Phys. Rev., Adv. Energy Mater., Nano Energy, ACS Nano, Adv. Funct. Mater., Nano Lett. 等论文。主持包括CRF,GRF,ITF,NSFC等20多项重要科研项目。获得教育部自然科学奖、TechConnect全球创新奖、日内瓦国际发明特别优异奖和金奖、校长特设个人卓越成就奖等奖项。目前担任InfoMat(影响因子:22.7)杂志的副主编,Adv. Opt. Mater. 等国际杂志的编委。
▍Email:jh.hao@polyu.edu.hk
撰稿:原文作者
编辑:《纳微快报(英文)》编辑部
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2023 JCR IF=31.6,学科排名Q1区前3%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
转载本文请联系原作者获取授权,同时请注明本文来自纳微快报科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3411509-1486377.html?mobile=1
收藏

