 精选
精选
研究背景
巨噬细胞是先天免疫系统的重要细胞成分。由于其异质性和可塑性,巨噬细胞极化(M1/M2)保持动态平衡,在维持组织稳态方面发挥至关重要的作用。巨噬细胞极化和其代谢紧密相关。相比于M2巨噬细胞拥有完整的氧化磷酸化(OXPHOS)代谢轴,M1巨噬细胞协调代谢重布线,并伴随大量代谢参数改变。这些改变极大影响巨噬细胞基因表达,引起其极化失衡,导致多种疾病发生发展。鉴于代谢、极化、疾病之间紧密关系,巨噬细胞代谢的原位示踪对于阐明疾病进展具有重要意义。此外,干预代谢以加剧代谢失衡或恢复代谢稳态已被视为重塑巨噬细胞表型并引发相应免疫应答以对抗疾病的一种有效策略。然而,目前缺乏关于纳米材料(NMs)介导巨噬细胞可视化和协调代谢重布线以维持表型平衡的全面总结。本文综述了基于NMs的代谢免疫疗法的最新进展,并探讨了免疫疗法未来发展趋势。
Nanomaterial-Based Repurposing of Macrophage Metabolism and Its Applications
Tingting Meng, Danfeng He, Zhuolei Han, Rong Shi, Yuhan Wang, Bibo Ren, Cheng Zhang, Zhengwei Mao*, Gaoxing Luo* & Jun Deng*
Nano-Micro Letters (2024)16: 246
https://doi.org/10.1007/s40820-024-01455-9
本文亮点
1. 首次系统性总结了相比于M2表型,M1型巨噬细胞经历大规模代谢适应,多种改变的代谢参数可作为潜在治疗靶点。
2. 本文系统阐述了基于NMs的巨噬细胞代谢再利用及其应用。
3. 本文强调了为加速临床转化,NMs介导巨噬细胞免疫疗法所面临的潜在挑战、未来发展趋势等。
内容简介
巨噬细胞免疫疗法是一种新兴的调节免疫反应以缓解疾病症状的治疗方法。相比于M2巨噬细胞(抗炎),M1巨噬细胞(促炎)经历大规模的代谢适应如氧化磷酸化转变为糖酵解,多种改变的代谢参数如显著升高的活性氧/氮(RONS)、琥珀酸可作为巨噬细胞诊疗的潜在靶点。纳米材料(NMs)可用于示踪巨噬细胞代谢以揭示疾病进展,并通过自身或传递调节信号进一步模拟复杂的生理信号模式,从而重编程其代谢来调控巨噬细胞表型,以裁剪巨噬细胞命运。陆军军医大学邓君教授和罗高兴教授、浙江大学毛峥伟教授团队首先探讨了巨噬细胞代谢、极化和疾病之间关系。随后概述NMs介导巨噬细胞可视化以揭示疾病进展和进一步协调代谢重布线以逆转疾病进展的代谢免疫疗法。最后,为加速临床转化,本文对巨噬细胞代谢免疫疗法所面临的挑战、前景以及未来研究方向进行全面的讨论,为研究人员在巨噬细胞或其他免疫工程领域开发新的代谢干预免疫调节剂提供有价值的参考。
图文导读
I 巨噬细胞代谢:裁剪巨噬细胞中心疾病的潜在治疗靶点
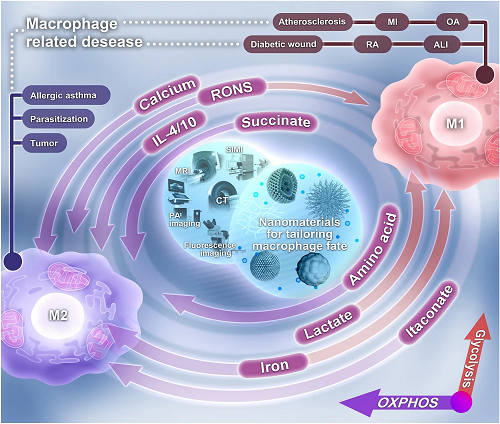
巨噬细胞代谢重编程与其极化密切相关(图1)。相比于M2巨噬细胞具有完整的三羧酸(TCA)循环,通过OXPHOS和脂肪酸氧化(FAO)维持ATP的持续供应,M1巨噬细胞糖酵解代谢增强和OXPHOS受损以适应缺氧微环境,并经历大规模的代谢重写,伴随着多种代谢参数的改变(如RONS、琥珀酸、衣康酸、钙、乳酸),可概括为以下几类:
(1)中断的TCA循环和上调的戊糖磷酸途径(PPP),引起ROS暴释。
(2)发生在琥珀酸脱氢酶(SDH)处的第二个代谢断点引起琥珀酸积累和SDH介导的琥珀酸氧化上调,引起ROS暴释。
(3)增强的IRG1将柠檬酸重新定向为衣康酸,从而抑制SDH介导的琥珀酸氧化,减少ROS产生。
(4)补偿的AASS循环和尿素循环触发NO大量产生。
(5)上调的iNOS与Arg-1竞争精氨酸并将其代谢为NO。
(6)谷氨酰胺回补形成α-KG,为IDH1处的第一个断点提供燃料,维持TCA循环运行。
(7)持续的Ca²⁺内流诱导[Ca²⁺]i超载损害线粒体产生线粒体ROS(mtROS)。
(8)铁转运失衡引发铁超载,过载的铁诱导芬顿反应引起氧化应激。
(9)IL-4将抗炎功能与上调的FAO联系起来,以支持M2应答。
(10)IL-10阻断mTORC1通路并降低iNOS/Arg比值以抑制糖酵解。
(11)尽管得出了相互矛盾的结论,但乳酸耗竭倾向于驱动M2表型。
利用这些改变的代谢参数作为潜在靶点可指导相关生物材料的设计。
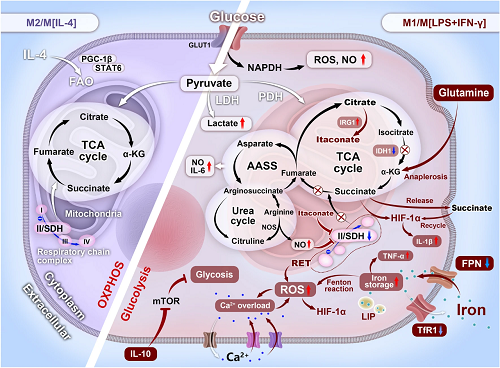
图1. M1和M2巨噬细胞对微环境线索的代谢适应:巨噬细胞治疗的潜在靶点。
II NMs介导巨噬细胞活性可视化和命运定制
根据M1/M2巨噬细胞差异性代谢(图2),本文后续部分将系统地阐述NMs借助多种成像技术示踪巨噬细胞的行为,和重新定向巨噬细胞表型,以定制其免疫治疗的命运。
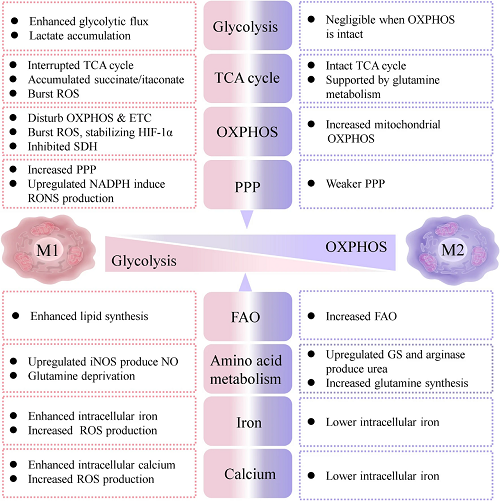
图2. 巨噬细胞表型(M1/M2)的可区分代谢特征示意图。
2.1 RONS
2.1.1 NMs可视化RONS以评估巨噬细胞活性
ROS是细胞内氧气通过电子传递产生的一系列化学活性物质,主要包括H₂O₂、OH•、O₂•–。ROS在调节巨噬细胞极化方面起着双刃剑的作用。低水平的ROS有利于维持M2表型,高水平的ROS驱动巨噬细胞M1极化。巨噬细胞通过形成储存或运输系统来保护自己免受NO损伤,但这种保护机制在炎症状态下可能会失效。LPS(+IFN-γ)激活的M1巨噬细胞NO显著升高,高出M2表型30倍左右,而NO会诱导硝化应激。
传统的ROS成像策略涉及应用多种荧光染料,当被ROS氧化时,猝灭的荧光基团如IR-780碘化物,或RNS响应的结构单元如邻二氨基苯重新发射出荧光,可视化RONS水平以评估巨噬细胞活性。但经济高效的荧光技术无法避免背景干扰,偏离真实结果,阻碍临床应用。临床常用的磁共振(NMR)等技术,能够高度程序化的准确分析这些代谢物,提供可靠的病理信息,但受到高成本和耗时测试的限制。然而在体内成像分析中经常遇到以下问题:(1)探针是否只聚集在特定的巨噬细胞亚型中?(2)如何对不同RONS的动态变化进行正交成像,并实时调整它们在病理生理过程中的关系?(3)单一成像模式是否容易受到环境干扰?多模态探针是否更有优势?
2.1.2 NMs调控RONS水平再教育巨噬细胞命运
M1巨噬细胞活化与上调TNF-α介导的炎症途径密切相关,如下游丝裂原活化蛋白激酶(MAPK)和核因子κB(NF-κB)途径。RONS清除主要通过以下几种机制操控M2极化:(1)通过抑制IκB磷酸化显著减少p65 NF-κB的核转位,从而失活NF-κB通路以沉默炎性基因,包括iNOS;(2)降低MAPK(ERK, JNK/SAPK, p38)的磷酸化,从而阻断MAPK级联反应;(3)抑制STAT-1磷酸化使JAK/STAT-1途径失活。相反,补充RONS可刺激这些信号通路,从而恶化M1应答,治疗肿瘤相关疾病。
受RONS在巨噬细胞活化中的双重作用启发,NMs通过调节RONS水平介导代谢重编程可激活所需表型,在疾病治疗中受到广泛的关注。策略主要集中在以下几类:(1)天然抗氧化酶,如谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD);(2)人工合成纳米酶,如Cu5.4O、CeO₂和Pt;(3)抗氧化物质,如维生素E/C、气体(如H₂)。这些策略各有优缺点,使用时应考虑具体情况。天抗氧化酶易受疾病微环境的影响,导致RONS清除效率较低。由于快速代谢和耗散抗氧化性,抗氧化物质表现出较低的ROS清除效率和较差的生物利用度。调节RONS的策略主要集中在具有优异抗氧化性能的含金属纳米酶上,由于不可降解的金属元素,可能会导致潜在的细胞毒性,因此需要进一步研究。未来我们应开发绿色RONS清除或供应平台来满足低毒性、高生物相容性和可持续性的需求。如微藻独特的光合特性和易于功能化的表面使其成为构建绿色RONS清除平台的理想候选者,可用于疾病治疗,如糖尿病创面。
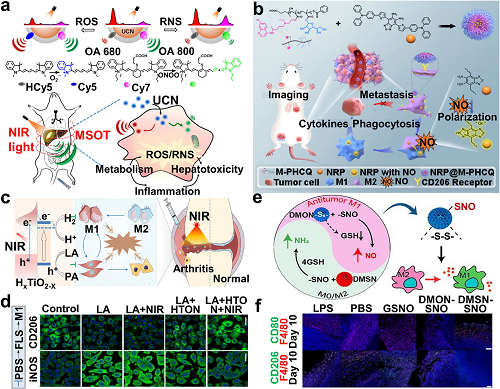
图3. a 近红外响应的UCN可视化体内内源性RONS。b NRP@M-PHCQ合成、基于NO的NIR-II成像和TAMs复极化示意图。c HTON通过近红外光催化调节关节炎滑膜微环境。d HTON光催化对LA/FLS刺激的巨噬细胞的影响。e DMON-SNO释放NO调节巨噬细胞极化示意图。f 纳米颗粒注射后第10天肿瘤组织中F4/80⁺CD80⁺和F4/80⁺CD206⁺细胞的IF染色。
2.2 琥珀酸代谢
LPS刺激的BMDMs中急剧积累的琥珀酸直接损害了PHD活性以稳定HIF-1α,HIF-1α驱动炎症信号IL-1β和其他HIF-1α依赖基因的表达,作为内源性炎症信号来调控免疫。SDH,也称为复合体II,是连接OXPHOS和电子传输的枢纽。有趣的是,LPS诱导的线粒体超极化和增强的SDH介导琥珀酸氧化共同重利用线粒体代谢,通过反向电子转移(RET)迫使电子回到复合物I中,导致ROS爆发。这一过程上调促炎基因谱,驱动M1应答。这一现象可被强效SDH抑制剂,丙二酸衍生物,丙二酸二甲酯(DMM)逆转,DMM可在细胞内快速水解为丙二酸,阻断琥珀酸依赖性ROS的产生,恢复抗炎基因稳态(IL-1β、IL-10和IL-1RA),重塑线粒体代谢,这可能是实现M1到M2极化有价值的策略。作为调节巨噬细胞代谢的极具吸引力的靶点,与RONS不同,研究人员需要进行更广泛的探索来研究NMs介导琥珀酸氧化驱动巨噬细胞极化,以填补这一相对空白领域。
2.3 衣康酸代谢
2.3.1 NMs可视化衣康酸以评估巨噬细胞活性
巨噬细胞维持衣康酸的生理池以抵抗炎症损伤。LPS刺激的巨噬细胞中衣康酸浓度>1 mM,而静息时水平低至微摩尔,这可能是由于上调的IRG1介导衣康酸合成。北京大学王初教授课题组在巨噬细胞中可视化衣康酸以评估巨噬细胞活性做出巨大的贡献。鉴于其抗炎功效,开发生物探针以实现巨噬细胞中衣康酸监测对于加深我们对衣康酯未知生物学功能的理解具有重要意义。目前的监测方法不可避免地依赖于液质联用仪(LC-MS),很少直接获得巨噬细胞中的衣康酸动态行为,需要更深入的研究来填补这一相对空白的领域。
2.3.2 NMs调控衣康酸水平再教育巨噬细胞命运
衣康酸(IA)在激活巨噬细胞中显著升高,作为抗炎代谢产物,介导免疫和代谢之间的串扰,通过多种机制在体内外负反馈调控炎症反应和驱动M2极化:(1)抑制SDH活性,阻断HIF-1α活性和IL-1β的产生,灭活NLRP3炎性小体。(2)由于存在亲电α,β-不饱和羧酸,通过迈克尔加成烷基化KEAP1残基,上调Nrf2的表达。(3)诱导亲电应激以抑制IκBζ翻译,该翻译通过上调ATF3而非Nrf2调节二次转录,被称为IκBζ-ATF3炎症轴。(4)去磷酸化IL-23,使之不能与IL-17启动子结合以抑制下游IL-17转录。(5)抑制NF-κB通路。
衣康酸的抗炎特性为开发基于免疫代谢疾病干预策略提供了新的方向。重写衣康酸代谢驱动M2极化的策略主要依赖于以局部按需方式将衣康酸输送到巨噬细胞中。由于衣康酸的细胞渗透性较差,有必要开发衣康酸或功能相似的衣康酸衍生物(衣康酸二甲酯[DMI]和衣康酸4-辛酯[4OI])负载的NMs。然而,这些衍生物可能不足以模拟内源性衣康酸。没有确凿的证据证实它们的治疗作用来自衣康酸,目前关于如何在细胞内有效递送衣康酸并未达成共识。通过仿生载体递送衣康酸以改变细胞内衣康酸代谢的新兴领域可能面临巨大的发展潜力和挑战。
2.4 铁代谢
2.4.1 NMs可视化铁以评估巨噬细胞活性
铁是一种参与多种代谢过程的必需微量元素。根据其独特的遗传程序,巨噬细胞在铁稳态中起着核心调节作用。铁在M1巨噬细胞中被滞留以抵抗细菌感染,而在M2表型中被释放以促进组织修复,但可能促进肿瘤生长。追踪铁代谢来评估巨噬细胞活性以了解疾病进展非常有前景,但仍具有巨大挑战性。当前示踪铁代谢手段主要集中在荧光探针、NMR、二次离子质谱(SIMS)。但NMR成像速度慢、成本高限制了其应用。虽然SIMS可以以高灵敏度和空间分辨率(高达37 nm)示踪铁,但昂贵的仪器和耗时的测试,限制其使用,。此外,巨噬细胞的行为是动态的,而目前的监测方法只能在特定的时间和环境下固定下来。如何动态监测代谢物尚未得到充分研究,这促使研究人员开发在生物系统中动态跟踪代谢物的方法。
2.4.2 NMs调控铁水平再教育巨噬细胞命运
铁过载激活M1巨噬细胞以微调先天免疫反应,铁剥夺可能会阻断M1应答。铁水平在细胞内操纵氧化还原稳态。捕获过量的铁可以通过沉默炎症途径(如NF-κB)来抑制ROS的形成,从而驱动M2极化,而补充铁会诱导氧化应激以激活NF-κB等途径,从而上调炎症级联反应以启动M1应答。
研究人员广泛探索负载铁调节剂的纳米载体释放调节剂,以操纵细胞内的氧化应激,塑造巨噬细胞表型,治疗巨噬细胞驱动的疾病。然而,在其他细胞内的不可控释放会导致剂量依赖毒性,这归因于非特异性螯合生理必需铁。用刺激响应基团修饰这些纳米载体可能实现可靶向细胞内化、延长循环半衰期、长期区域富集和可持续释放。与直接物理释放相比,它似乎更符合特定区域的按需释放需求。
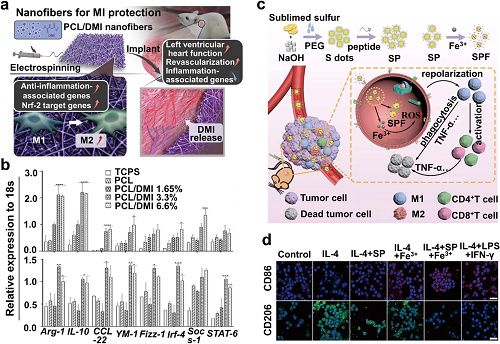
图4. a 负载DMI的PCL纳米纤维调节巨噬细胞M1到M2极化示意图。b 不同组处理24小时后RAW 264.7细胞(上)和BMDM(下)的M2相关基因表达。c 用于癌症免疫治疗的SP/SPF合成和SPF驱动巨噬细胞M2到M1极化示意图。d 不同组别处理LPS激活的RAW 264.7细胞后CD86(M1)和CD206(M2)的免疫荧光染色。
2.5 钙代谢
钙是调控多种细胞功能的关键信使。长时间的Ca²⁺内流会损害OXPHOS,促进M1应答。降低细胞内钙([Ca²⁺]i)会减少mtROS的产生,促进M2极化。巨噬细胞极化和Ca²⁺之间的串扰发生在多种疾病中。操纵Ca²⁺信号传导可以被视为一种潜在的辅助治疗。一种策略是封装Ca²⁺调节剂,如EGTA,捕获过量[Ca²⁺]i,恢复ROS介导的线粒体稳态紊乱,以抑制M1激活,治疗Ca²⁺超载驱动的疾病。另一种是通过干扰相关通道或信号通路来阻断不适当的Ca²⁺流动。与铁类似,负载Ca²⁺调节剂的纳米载体通过改变[Ca²⁺]i来微调巨噬细胞的命运,从而调节细胞内氧化应激。非特异性细胞内不受控释放不可避免地导致剂量依赖毒性,对离子通道或信号通路的干扰也是如此。此外,其功能背后的准确机制仍然知之甚少。加强对Ca²⁺信号传导机制的理解为开发基于Ca²⁺的治疗方法提供了更多机会。通过修饰靶向或刺激响应基团,建立针对特定巨噬细胞亚群的智能递送系统,实现其定向吞噬摄取、延长区域富集和时空释放,以及最大限度地减少对邻近细胞的毒性,仍然是一个挑战。
2.6 IL-4/10
JAK-STAT通路与巨噬细胞极化密切相关,IL-4/10是其中重要的一环。简单来说,IL-4与其受体结合,激活下游JAK2,诱导STAT6磷酸化,进入细胞核与白介素-4应答基因的启动子元件结合,从而转录M2谱系基因,驱动M2分化。而IL-10与受体结合激活JAK1刺激STAT3转运进入细胞核,从而与特定的DNA序列结合,启动DNA转录,上调M2相关基因,实现抗炎级联反应。IL-4/10将巨噬细胞代谢与其抗炎功能联系起来,而其易降解和半衰期短的特性限制了它们的作用。物理包封可以有效地维持IL-4/10的生物活性,但很难避免其不受控制的释放。利用化学刺激触发释放可以更好地满足按需释放的需要,同时可以减少脱靶效应引起的副作用。目前的策略在一定程度上解决了药代动力学挑战。然而,将IL-4/10与天然材料连接起来,开发具有高负载效率的递送平台,从而保持其有效的生物活性,并在靶标位点实现长期连续释放,仍是一大挑战。
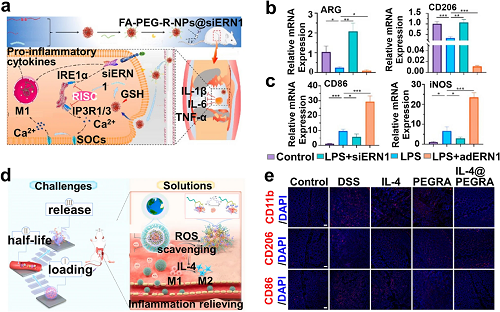
图5. a 递送的siERN1干扰IP3R和调节[Ca²⁺]i促进巨噬细胞M2极化的示意图。通过RT-qPCR检测b M2和c M1标记物的表达。d IL-4@PEGRA启动M1到M2极化用于IBD治疗示意图。e 治疗后第10天,IBD小鼠结肠组织中CD86⁺、CD206⁺和CD11b⁺细胞的IF染色。
2.7 氨基酸代谢
氨基酸代谢的改变是巨噬细胞极化过程中最早和最重要的代谢特征,并决定了巨噬细胞的亚型。最具有代表性的精氨酸,通过iNOS/Arg-1轴重塑巨噬细胞表型,转录因子Fra-1通过沉默Arg-1上调炎症而重现M1型巨噬细胞。而另一种参与L-Arg代谢的酶Arg-2通过调节线粒体动力学,上调OXPHOS,使M1巨噬细胞极化为M2表型。因此,可利用Arg-2的抗炎潜力促进巨噬细胞M2再生。此外,瓜氨酸在LPS(+ IFN- γ)激活的BMDMs中迅速下降,精氨基琥珀酸合成酶1(ASS1) 介导的瓜氨酸缺失导致JAK2-STAT-1信号激活和炎性细胞因子的产生,刺激M1表型。丝氨酸缺乏通过激活p38依赖性的JAK-STAT-1轴刺激M1表型并抑制SATA-6介导的M2极化,因此瓜氨酸和丝氨酸也可以成为一个新的靶点。
2.8 乳酸代谢
M1巨噬细胞代谢适应导致Warburg型乳酸积聚。研究表明,乳酸是一种免疫调节剂并介导差异表达的基因产生,这表明乳酸可能是重塑能量代谢的白天鹅,而不是糖酵解的“废物”。来自非免疫细胞的代谢物已被证实影响免疫细胞的糖酵解-OXPHOS轴,然后重塑其表型。LPS(+ IFN-γ)驱动的BMDMs中积累的乳酸可以刺激赖氨酸残基组蛋白乳酸化(称之为“Kla”),而增加的Kla又可以通过表观遗传修饰激活M2样基因转录。
当前,两种主流策略乳酸消耗和补充都被认为支持巨噬细胞M2到M1极化是相互矛盾的。利用NMs调节乳酸水平调控巨噬细胞极化的具体机制仍未被阐明。乳酸不仅是糖酵解的副产物,也是通过Kla驱动M2极化的因素。如何选择性地消耗或供应乳酸以避免对其他生理细胞或组织的副作用可能是研究人员需要考虑的一个主要问题。
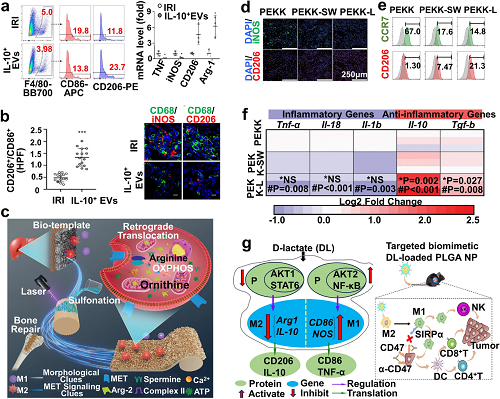
图6. a, b IL-10⁺EV促进巨噬细胞M2极化。c PEKK支架示意图,该支架重编程巨噬细胞代谢,以增加骨质疏松性骨整合。d, e 通过流式细胞术对在各种支架上培养的RAW 264.7细胞进行免疫荧光染色和生物标志物(CCR7和CD206)表达。f 不同组处理后表达的极化基因倍数变化热图。g DL调控TAMs M2到M1复极化的可能机制(左)以及通过递送的DL结合α-CD47重塑iTME用于HCC治疗的可能机制[右]。
III 结论
基于NMs的巨噬细胞代谢再利用在多种疾病场景中发挥相当大的潜力。我们在本综述中概述了NMs介导巨噬细胞代谢重编程应用的最新进展,为巨噬细胞代谢免疫疗法提供部分蓝图和新的见解。相信在多学科战略协作下,加深对代谢、极化和NMs之间的理解可加速探索性能最优的NMs。下面,我们介绍了一些未来需要解决的关键问题和研究重点。
(1)在进入临床研究之前,建立精确靶向巨噬细胞亚群的仿生特洛伊递送系统以增强细胞吞噬摄取,最大化的避免免疫系统清除和脱靶效应仍然是一个挑战。代谢性疾病的发病机制极其复杂,涉及多种参数的改变。受限于单个目标的次优效果和有限靶点筛选,观点应逐渐从“一个分子、一个靶点、一种疾病”的学说逐渐转变为基于多管齐下策略的“一体式”NMs,可调节巨噬协同细胞中的多种代谢靶点。
(2)更多代谢参数,如富马酸盐、α-KG、糖酵解酶(如丙酮酸脱氢酶)和其他氨基酸(如色氨酸)在巨噬细胞代谢适应中也会发生显著变化,可以作为潜在的治疗靶点。成像技术和代谢事件的结合使我们能够可视化和量化巨噬细胞的行为。为加速临床转化,应优先考虑临床成熟的成像技术(如NMR)和FDA批准的材料(如聚乙二醇)来开发纳米药物。
(3)大多数临床前结果来自细胞系和动物模型,而不是人类。毫无疑问,人体组织模型将被引入代谢研究,以消除对传统模型的长期依赖,如3D类器官。当前巨噬细胞纳米药物很少实现临床转化,其商业化程度有限就证明了这一点。为加快其临床应用,应遵循生物纳米实验文献(MIRIBEL)标准中的最低信息报告。我们可以利用计算毒理学、微型“芯片上器官”设备和高通量药物筛选等来探索内化NMs的细胞内行为,以建立药代动力学-药效学模型,阐明其毒理学途径和治疗价值。
(4)精准纳米医学可能是未来的研究趋势。这种策略可避免不考虑患者异质性的 “一刀切”治疗引起的不良药物反应。算法(如人工智能)对于实施精准医疗可能是必不可少的,这有助于NMs的设计,例如预测最佳尺寸、药代动力学和预筛选NMs以提高患者依从性。
总之,尽管这些研究突显了巨噬细胞免疫疗法巨大的临床前潜力,但很少能直接进入临床领域,这促使一些专家提出了挑衅性问题。在已经取得的显著进展的鼓舞下,我们相信巨噬细胞免疫纳米药物最终将会进入临床和市场。
作者简介

邓君
本文通讯作者
陆军军医大学第一附属医院 教授
▍主要研究领域
疾病早期诊断、生物材料与组织再生修复研究。
▍个人简介
陆军军医大学第一附属医院(西南医院)烧伤外科教授、PI、博导、科室副主任,创伤与化学中毒全国重点实验室主任助理。先后获得国家优青、重庆市杰青,军队青年科技英才、重庆市中青年高端医学人才等荣誉称号。以第一或通讯作者在Adv. Mater.、Nat. Commun.、Adv. Funct. Mater.、Nano Today、Bioact. Mater.、Biomaterials、Acta Pharmaceutica Sinica B 等高水平SCI期刊上发表SCI论文50余篇,总影响因子超过500, 其中影响因子IF > 10的论著,30余篇。先后主持国家自然科学基金4项, 军队173重大项目课题1项,军队科技创新人才项目1项,重庆市自然基金3项,国家重点实验室优秀青年基金和重点开放课题各1项等;获得国家发明/实用新型专利5项;主要参与人获得“中华医学科技一等奖”1项,科技部重点领域创新团队1项。
▍Email:djun.123@163.com

罗高兴
本文通讯作者
陆军军医大学第一附属医院 教授
▍主要研究领域
危重烧伤救治和创面修复研究。
▍个人简介
陆军军医大学西南医院全军烧伤研究所所长、科主任、教授,博士生导师,国内著名烧伤救治专家。先后任职亚太烧伤学会主席、《中华烧伤杂志》总编辑等,并获得国家重点研发计划干细胞专项首席科学家、第六批军队科技创新领军人才等人才称号。先后主持国家重点研发计划干细胞专项、国家自然基金重点项目、国家自然基金重点国际合作项目、国家科技部创新团队项目等科研项目30余项,科研经费5000余万元。以第一作者或通讯作者在Sci. Adv.、Nat. Commun.、Adv. Mater.、Adv. Sci.、Burns &Trauma、Burns等杂志发表论文200余篇,其中SCI论文100余篇,影响因子大于10论文20余篇;总被引3000余篇次,单篇最高被引390余篇次。
▍Email:logxw@hotmail.com

毛峥伟
本文通讯作者
浙江大学 教授
▍主要研究领域
纳米生物材料和高分子组织粘附和止血材料研究。
▍个人简介
浙江大学高分子科学与工程学系教授,博士生导师,副主任。先后主持国家自然科学基金杰出青年项目、国家自然科学基金优秀青年项目、科技部中葡国际合作项目、浙江省杰出青年基金项目等科研项目。在Nat. Nanotechnol.、Adv. Mater.、Nat. Commun.、Sci. Adv.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.等顶级期刊上发表SCI论文100余篇。论文被他人正面引用8000余次,H因子为52。2017年在美国化学年会上获得CAB-AB Young Investigator award。2018年获得浙江省自然科学一等奖(排名第二)。2019年获得中国生物材料学会生物医用高分子材料分会颁发的“青年学者优秀奖”。2020年获得浙江省科技进步一等奖(排名第三)。目前担任期刊Acta Biomaterialia编辑。
▍Email:zwmao@zju.edu.cn
撰稿:原文作者
编辑:《纳微快报(英文)》编辑部
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2023 IF=31.6,学科排名Q1区前3%,中国科学院期刊分区1区期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
转载本文请联系原作者获取授权,同时请注明本文来自纳微快报科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3411509-1449663.html?mobile=1
收藏

