
郑州大学周震教授最新EER综述|金属-氧气电池中的单线态氧难题的破解:当前进展和未来展望
01 关于这篇文章
文章题目:
Solving the Singlet Oxygen Puzzle in Metal-O2 Batteries: Current Progress and Future Directions
作者:
Yaying Dou1,2,Shuochao Xing1,Zhang Zhang1,Zhen Zhou1*
作者单位:
1Zhengzhou University, China
2Nankai University, China
引用信息:
Electrochem. Energy Rev. 2024, 7(1), 6.
DOI:
https://doi.org/10.1007/s41918-023-00201-w
全文链接:
https://link.springer.com/content/pdf/10.1007/s41918-023-00201-w.pdf

长按/扫描阅读全文
02 图文摘要
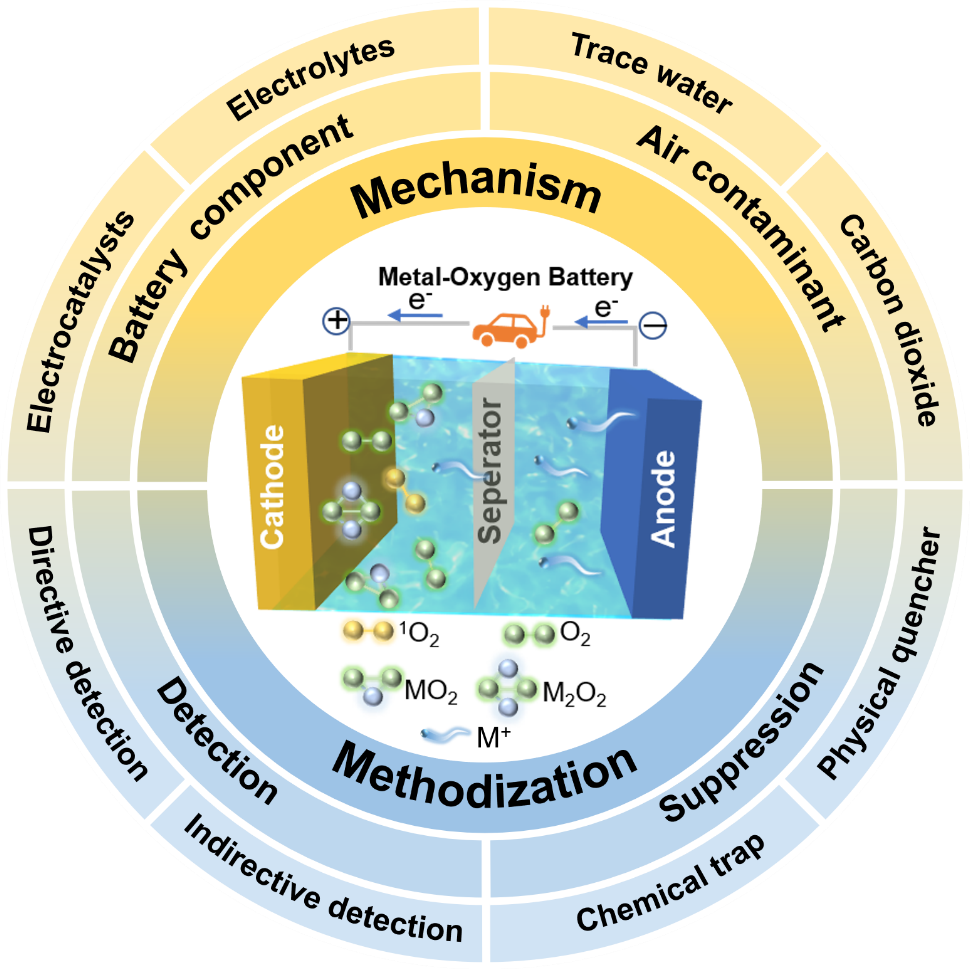
03 目录简介

04 综述亮点
1. 探讨了单线态氧1O2的特性及对应的检测策略。
2. 重点讨论了金属-氧气电池中1O2的形成机制。
3. 总结了金属-氧气电池中1O2相关研究面临的挑战,并展望了未来的研究方向。
05 图文导读
1 前言
目前大力发展的风能、太阳能、潮汐能等清洁能源面临着生产不连续、地理分布不均匀等严峻挑战。鉴于此,发展低成本、高稳定性、高能量密度的储能技术势在必行。在过去的40年里,研究人员致力于开发先进的锂离子电池(LIBs)。然而,由于电极材料的限制,当前的LIBs无法满足未来不断增长的能源储存需求。因此,迫切需要寻找更先进的新型能源储存系统。可充电非水金属-氧气电池(M-O2,M = Li、Na、K)因其超高的理论比容量和环境友好特性受到广泛关注。
M-O2电池包括碱金属负极、多孔空气正极以及分隔它们的薄层电解质。其运行主要通过氧分子和碱金属离子之间的可逆化学反应来实现。在放电过程中O2被还原形成固体超/过氧化物(ORR),充电过程则主要是产物分解析出氧气(OER)。由于空气中有充足的氧气供应,它们的理论能量密度远高于最先进的LIBs。然而,Li-O2、Na-O2和K-O2技术仍处于发展初期,它们的实际应用主要面临两个挑战。第一,反应动力学迟缓,导致过电势大、可逆性差且循环寿命短。其次,也更为棘手的是副反应,它们不仅侵蚀电池组件,还产生大量难以分解的副产物,例如碳酸盐和羧酸盐。放电产物的产率反映了副反应发生的程度,其中K-O2、Na-O2和Li-O2电池的放电产物产率分别为98%~100%、90%~95%和50%~90%。过去,由于活性氧物种(ROS)的强亲核性、碱性和自由基特性,M-O2电池中的副反应通常被归因于此。然而,具有超高活性的KO2可以可逆循环,因此推测可能存在其他诱导副反应的途径。最近,Freunberger提出三线态基态(3O2)的第一激发态单线态氧(1O2)是Li-O2和Na-O2电池中副反应的主要原因;1O2的存在对于其他涉及氧化还原的非水电池也是一个挑战。这些发现将M-O2电池的研究重点从降低过电势转向提高对1O2的化学稳定性。然而,对电极反应的理解不足阻碍了M-O2电池的进一步发展。因此,迫切需要对1O2的形成机制以及相应的改进策略进行全面系统的讨论。一些经验丰富的研究团队已经对M-O2电池的各种问题进行了认真讨论,主要包括稳定的金属负极、电解质、高效的正极催化剂、先进表征方法等。基于这些结论,M-O2电池的可逆性和循环稳定性有了显著提高。然而,1O2所带来的挑战尚未得到足够的关注和系统的讨论。幸运的是,关于M-O2电池中1O2的研究正在成为一个值得关注的科学领域。图1列出了一些代表性的研究。只有对1O2相关的化学和电化学反应有更深入的理解,才能提出可靠的改进策略,推动M-O2电池的实际应用。

图1 M-O2电池中1O2主要的研究进展
本文综述了1O2的物理性质和对应的检测方法,并重点讨论了M-O2电池中1O2的形成机制以及杂质气氛和电池组件对1O2形成的影响。最后,指出了1O2研究中存在的挑战和未来研究方向,并为开发对应的防御策略提供了独特见解。
2 什么是1O2
根据图2所示的轨道电子排布可以更好地理解分子氧的电子构型和化学性质。在三重基态氧分子(3Σg−或3O2)中,两个电子占据独立的反键2πg轨道,自旋不配对。当基态氧分子处于激发态时,电子既可以同时占据一个2πg轨道,也可以分别占据两个2πg轨道,分别定义为1Δg和1Σg+。其中,1Σg+处于高激发态,其能量比基态氧分子高1.565 eV,而低激发态1Δg能量高于基态氧分子0.974 eV。两个激发态均处于亚稳态,具有瞬时性和高度化学活性。在理想气体中,它们的寿命分别为45 min和7~12 s,而在实际溶液中则分别为3~10 s和9~10 s。由于能量相对较低,寿命较长,默认的单线态氧通常指1Δg,它对氧气化学的影响更为显著。Khan和Kasha于1963年首次发现并确认1O2是化学反应的产物。
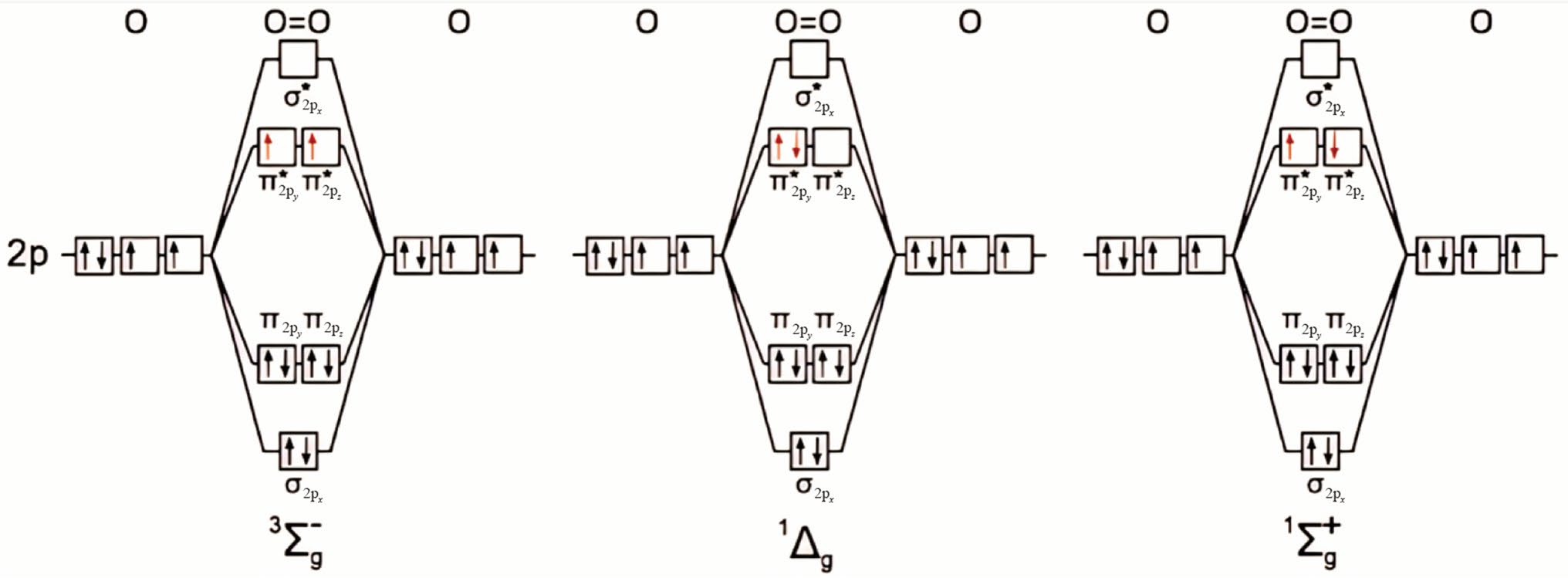
图2 分子氧不同自旋态的2p轨道图。(Copyright © 2021, American Chemical Society)
3 1O2检测技术
3.1 直接检测
光物理辐射是1O2直接检测的基础。在此过程中,1O2通过辐射弛豫到三重基态(1Δg → 3Σg−),并伴随着磷光激发。该现象可持续数微秒,因此易于检测。跃迁模式主要包括1O2 → O2 + hv(1 270 nm)和21O2 → 2O2 + hv(604 nm和703 nm)。前者被广泛认为是1O2的特征发光,可以作为1O2存在的明确标志。这种方法已经发展成为1O2的标准检测技术,特别是用于测定1O2的产量、耐久性和失活速率常数。然而,由于1O2的磷光量子产率低、反应性高、寿命短暂,通常需要放大磷光信号以满足相关的检测要求。虽然1 270 nm处的磷光信号可以更精确、更可靠地测量1O2,但M-O2电池复杂的结构设计和化学环境对该技术的应用提出了挑战。
3.2 间接检测
为了更便捷准确地检测1O2,研究人员基于自旋捕获剂提出了各种间接检测方法。与直接检测相比,间接检测的信号更强,操作更简便,有望克服M-O2电池中1O2寿命短、浓度低的限制。1O2可与特定自旋捕获剂反应形成稳定的自由基。例如,Wandt等人证明了自旋捕获剂2,2,6,6-四甲基-4-哌啶酮(4-oxo-TEMO)可选择性地捕获1O2,形成具有顺磁性的稳定自由基 4-oxo-2,2,6,6-四甲基-4-哌啶氧基(4-oxo-TEMPO),可通过其特征电子顺磁共振(EPR)光谱进行识别。基于此,他们首次提出Li-O2电池充电时会形成1O2。然而,这一策略存在缺陷。据Zhang等人报道,超氧自由基和CO2共存时会形成高活性的氧化剂。由于M-O2电池中非水电解质分解会形成CO2,因此即使不施加任何电势,4-oxo-TEMO也可能被化学氧化为4-oxo-TEMPO,干扰检测结果。因此,理想的1O2捕获剂除了需要具有高灵敏度、快的响应速度和良好的可逆性,还要与电池操作环境兼容。此外,EPR易受未成对电子、共存离子和溶剂的影响,可能干扰检测信号,造成定量检测的偏差较大。因此,必须认真考虑自旋捕获剂在特定实验条件下的适用性和可信度。
为了克服这些问题,研究人员提出了一些更稳定、灵敏度更高的1O2捕获剂,例如9,10-二甲基蒽(DMA)和9,10-二苯基蒽(DPA)。这些捕获剂可以选择性地与1O2反应,形成稳定的非荧光内过氧化物。通过监测捕获剂或其反应衍生物的吸光度和荧光变化等,可以考察1O2的形成和产量。目前,捕获剂已成功应用于多种涉及1O2生成的系统,包括M-O2电池、光动力疗法和光化学反应等。然而,DPA捕获剂不稳定,易受到光和氧气的影响而氧化。相比之下,DMA更稳定且与1O2反应的速度更快。此外,DMA的工作电压范围相比其他捕获剂更宽,因此可以在电池运行的全阶段监测1O2。尽管如此,由于受化学环境和操作条件的影响,在M-O2电池中精确检测1O2仍然极具挑战性。
适用于M-O2电池的1O2捕获剂需满足以下条件:(1)可与1O2发生特异性反应且反应速度快,从而准确捕获1O2的动力学和机制信息;(2)捕获剂应与M-O2电池系统兼容,包括电池组分、工作电压和操作温度等;(3)应具有高度的化学稳定性,避免受到ROS和其他物质(如Li2CO3、O2或CO2)的化学攻击。此外,对应的检测技术应该准确且可重复,从而提供定量数据,阐明电池系统中1O2的行为。合适的捕获剂和检测技术对于理解M-O2电池中的电化学机制和降解途径至关重要。
4 M-O2电池中的1O2
4.1 形成机制
1O2是生物衰老的主要原因,同时严重挑战了电池的化学稳定性。众所周知,副反应严重削减了M-O2电池的可逆性和循环寿命。研究人员最初认为高化学活性的超氧自由基是副反应的主要诱因,但是实际并非如此,因为基于KO2的K-O2电池可以可逆循环。除超氧自由基的攻击外,1O2是唯一有可能的降解源。阐明M-O2电池中1O2的形成机制,不仅有助于理解电池内在基元反应,还可以指导未来的研究,最终实现更高效的能源存储系统。
过氧化物(如H2O2、Li2O2和Na2O2)可化学氧化产生1O2,氧气的三重态和单重态氧之间的能量差约为1 eV。因此。研究人员推测将Li2O2充电至3.5~3.9 V vs. Li/Li+可以析出1O2。然而,受检测方法的限制,相关实验探究直至2016年才进行。通过原位EPR实验,Wandt等人发现当Li-O2电池充电至3.55 V以上时,4-oxo-TEMPO的含量明显增加(图3a),说明Li-O2电池充电过程会形成1O2。尽管该发现能够解释碳材料在3.55 V以上电压的分解现象,但未能阐明充电初始阶段副产物的形成原因。统计数据显示,1O2的产率至少占所析出氧气总量的0.5%。但是,这个值仅代表了1O2实际产量的下限,因为1O2在被捕获之前可能会被电池组分消耗。值得注意的是,4-oxo-TEMP捕获剂在3.75 V处易发生自发电化学氧化从而失效,因此与放电和高充电电位条件不兼容。另外,该工作未深入阐明1O2的形成机制,严重阻碍了高效M-O2电池的开发。
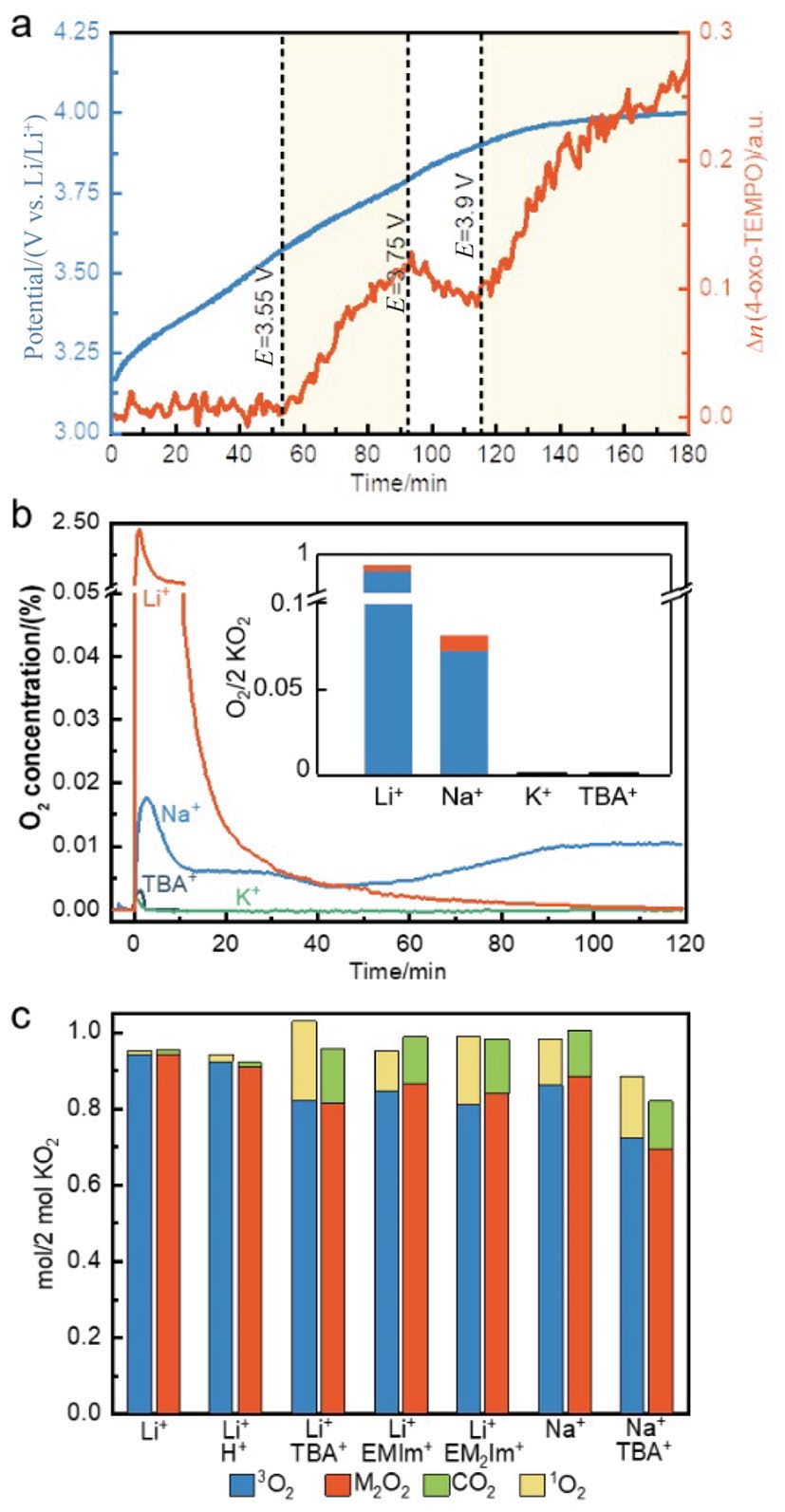
图3 a 以4-oxo-TEMP为自选捕获剂的Li-O2电池充电电压曲线以及对应的EPR信号强度;b 在含有30 mmol L−1 DMA以及0.1 mol L−1 K+/Li+/Na+/TBA+的四乙二醇二甲醚(TEGDME)中加入KO2后的氧气析出情况,插图为对应的3O2和1O2产率;c 含有18-冠醚-6、30 mmol L−1 DMA、0.5 mol L−1 Li+/Na+、0.1 mol L−1 TBA+、3-乙基-1-甲基-1H-咪唑-3-鎓(EMIm+)、 3-乙基-1,2-二甲基-1H-咪唑-3-鎓(EM2Im+),或三氟乙酸(CF3COOH)以及空白电解液中加入KO2后所得的O2、1O2、CO2和M2O2(M = Li或Na)产率。(Copyright © 2016, Wiley-VCH;Copyright © 2019, The Royal Society of Chemistry)
为了更深入探究1O2的形成机制,Mahne等人采用DMA作为1O2捕获剂,通过原位荧光识别DMA的消耗并结合原位高效液相色谱(HPLC)测量DMA向DMA-O2的转变来检测1O2。结果表明,Li-O2电池在运行全阶段(包括放电和初始充电阶段)都会产生1O2。1O2的产量随充电电压升高而增加,与副反应发生的程度一致。因此,他们认为超氧化锂的歧化反应(2LiO2→ (LiO2)2→ Li2O2+1O2,定义为化学路径)是1O2形成的原因。对于以过氧化物为产物的M-O2电池而言,其ORR和OER过程均涉及超氧化物的歧化反应,因此1O2很有可能是Li-O2和Na-O2电池可逆性差的主要原因。需要注意的是,该工作在ORR过程中加入了痕量水,因此放电阶段观测到的1O2极有可能与质子促进的歧化反应相关。
Mourad等人以KO2作为超氧源进行化学模拟,证实了超氧离子的歧化反应是1O2的主要成因。如图3b所示,M+的路易斯酸性对M+-O2配对的超氧和过氧化物的相对热力学稳定性以及1O2的产生有显著影响。强路易斯酸性的Li+或Na+更有利于过氧化物和O2的形成,而弱路易斯酸更有利于超氧的形成(图3c)。值得注意的是,当弱路易斯酸阳离子与强路易斯酸结合时,1O2的含量进一步增加,这也就是为什么离子液体(ILs)在M-O2电池中副反应比常规电解质更严重。减少的过氧化物产量的与1O2的产量密切相关,意味着1O2是M-O2电池中大部分副产物的诱因。然而,Pierini等人认为LiO2歧化形成1O2需要克服1.5 eV的活化能壁垒,这在常温下几乎无法实现。由于理论结论是在真空条件下得到的,因此可能与实际情况有偏差。同时,迫切需要直接的实验证据揭示1O2的形成机制。
为了更深入地探究1O2与超氧化物歧化之间的关系,Dong等人采用同位素标记法研究了Li-O2电池的放电过程,如图4a所示。16O18O气体的存在证明了放电过程中O–O键的断裂和重组。由于O–O键断裂过程产生了1O2,因此为歧化反应形成1O2这一观点提供了明确的实验证据。一般来讲,歧化反应是Li-O2电池实现大容量和良好倍率性能的关键。因此,在提高Li-O2电池电化学性能参数时需要慎重考虑。对溶液中LiO2和O2−的歧化反应速率对比发现,O2−(sol)的歧化反应在热力学上更有利于产生1O2。同时,Zaichenko等人认为相比于析出氧气,LiO2形成1O2需要更大的解离能(图4b)。这意味着LiO2的解离可能不会形成1O2,背后隐藏着更复杂的反应机制。为了得出更准确可靠贴合实际的结论,还应考虑更多的热力学和动力学信息,如标准电位、平衡常数和反应速率等。
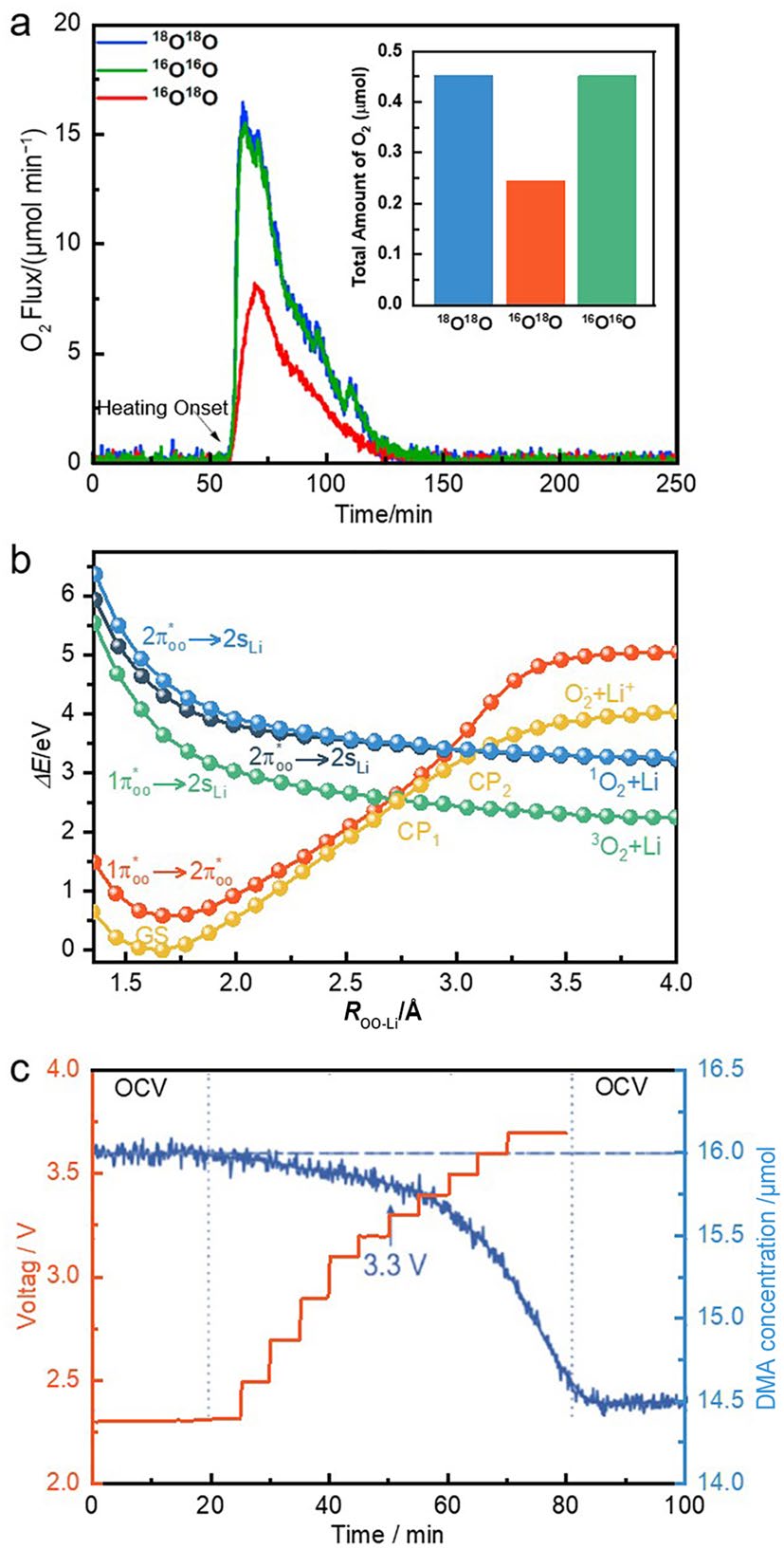
图4 a 含有30 mmol L−1 DPA捕获剂的预放电Li-O2电池中16O16O、18O18O和16O18O气体的析出情况。DPA与1O2反应生成内过氧化物(DPA-O2),该物质经加热后析出氧气同时产生DPA;b 理论计算所得五个能量最低的双电子态的解离能曲线;c Na-O2电池在静电以及充电过程中的电压曲线和对应的DMA浓度变化。(Copyright © 2022, Elsevier;Copyright © 2020, Wiley-VCH)
非水系Na-O2电池的稳定性高、成本低且过电位小,被认为是一种有望取代Li-O2电池的候选方案。然而,Na-O2电池在实际应用中同样受到副反应的限制。受Li-O2电池相关研究的启发,Schafzahl等人对Na-O2电池OEE和OER过程中1O2的形成机制进行了深入的研究。如图4c所示,在以NaO2为主要产物的Na-O2电池体系中,电池在运行的全阶段(放电、充电和静置)均会产生1O2。当充电电压超过3.3 V时,DMA含量明显减少,意味着1O2的产量增加。与室温下不稳定的LiO2不同,NaO2在热力学上是稳定的。因此,与Na-O2电池中形成的1O2可能由NaO2的电化学氧化分解引起。理论计算表明,通过电化学路径形成1O2所需的能垒为0.97 eV,对应的热力学电压为3.24 V。然而,实验结果表明,1O2可以在低于该电位下形成,这表明可能存在其它的1O2形成途径。基于对质子相转移催化的理解,他们推测质子促进了超氧化物的歧化反应,从而导致1O2在放电、静置和低于3.3 V的充电过程中形成。考虑到超氧自由基的浓度随电池充电电压升高而增加,Houchins等人提出了另一种解释,即1O2是通过超氧自由基的歧化反应产生的。该反应的能垒较低,因此整个充电阶段都会产生1O2。在放电过程中,主要通过溶解的NaO2的歧化反应形成了1O2。因此,Na-O2电池中的1O2主要通过化学路径产生,电化学路径形成的1O2可能只占较小的比例。需要注意的是,在低供体数(DN)溶剂(如乙腈)中,NaO2的歧化反应相对容易进行。因此,合理筛选电解质有望抑制1O2产生。相比之下,KO2的热力学和动力学稳定性更高,通常不会发生歧化反应,有效抑制了1O2的生成,确保K-O2电池反应的长期稳定性。
4.2 杂质气体对1O2的影响
4.2.1 痕量水
为了研究质子对1O2形成的影响,Mahne等人在电解液中加入痕量水。结果显示,在存在1 000 μmol mol−1水的情况下,DMA在整个放电过程中持续消耗,而干燥电解质中的DMA浓度几乎没有变化(图5a和b)。此外,充电过程中DMA的消耗在添加水的系统中比干燥电解质中更为明显,这表明痕量水加剧了充放电过程中1O2的形成。在存在H2O或其他质子源的情况下,超氧离子先质子化为HO2自由基(HOO•),随后通过超氧自由基的还原反应 (HOO• + O2− → HO4− → HOO− + 1O2) 或者歧化反应 (2HOO• + H2O → H2O4 → H2O2 + H2O + 1O2) 释放1O2。总反应表现为质子促进的1O2形成 (2O2− + 2H+ → H2O2 + 1O2),相关结论已被理论计算证实。同时,计算结果表明没有H+的情况下,1O2不可能形成。然而,一些研究认为H+对1O2的形成几乎没有影响。以三氟乙酸(CF3COOH)为质子源,KO2为超氧离子源时,只有少量的1O2可被观测到。目前,H2O和H+对1O2的影响存在较大争议,需要更加系统深入的研究。由于K金属极高的化学活性,K-O2电池中关于水的研究较少。然而,H2O可与KO2反应析出1O2,因此在制备电解质或通入氧气时必须进行干燥处理,同时也要注意除去高比表面正极上吸附的水分。
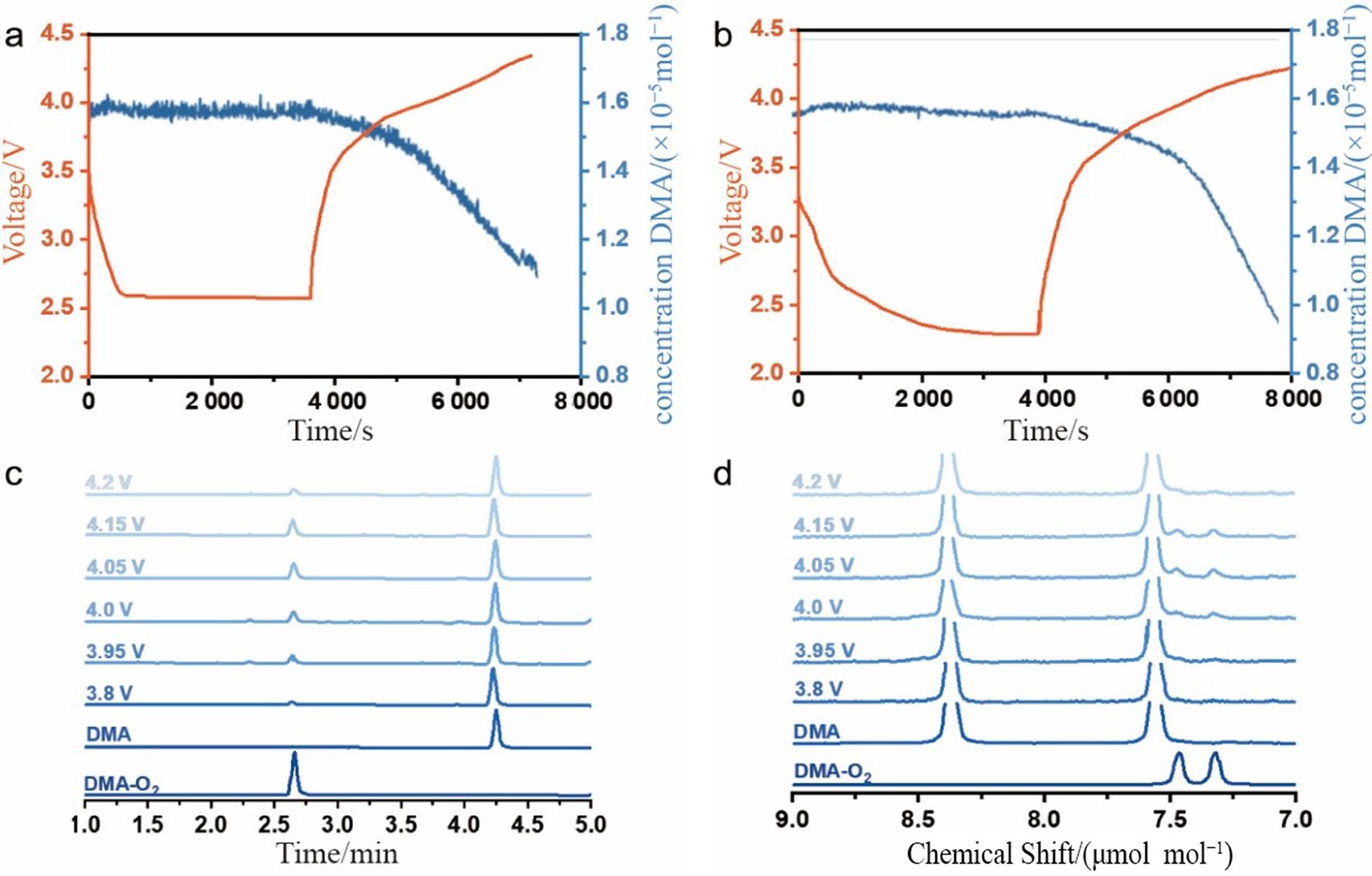
图5 质子对1O2形成的影响。含不同电解液的Li-O2电池充放电曲线及荧光观测到的DMA浓度变化:a 干燥电解液;b 含1 000 μmol mol−1水的电解液。c 采用HPLC和 d 1HNMR探究预负载Li2CO3的电池充电过程中DMA-O2的形成情况。(Copyright © 2017, Springer Nature;Copyright © 2020, Wiley-VCH)
4.2.2 CO2
此外,由于空气中CO2的干扰,固态碱金属碳酸盐(如Li2CO3和Na2CO3)在M-O2电池中较为常见。这些副产物在循环过程中不断积累,导致较低的能量效率和寿命,充分理解它们的分解机制至关重要。以Li2CO3为例,虽然理论上可以在电压超过3.8 V时分解释放CO2和O2,但是实验观察到的O2释放量明显偏离理论值。当预负载Li2CO3的电极充电至3.8 V时,DMA-O2被明显观测到(图5c和d),说明Li2CO3的氧化分解会生成1O2。与空白碳电极相比,预负载Li2CO3的电极在充电过程中析出大量H2和CO,可能与形成的1O2相关。这意味着Li-O2电池中的Li2CO3不仅钝化电极,还会加剧副反应。由于过渡金属氧化物正极材料常被Li2CO3污染,其他工作电压高于3.8 V的非水锂电池中可能也存在此现象。Wandt等人在不同类型的LiNixCoyMnzO2基电池体系中检测到了1O2,他们认为1O2由表面Li2CO3的氧化引起。最近的研究揭示,CO2存在条件下超氧离子的歧化反应也会导致1O2的形成,这有助于解释碳酸盐氧化过程中形成的1O2。因此,必须制定抵御1O2攻击和抑制Li2CO3形成的策略。例如,使用化学捕获剂使1O2失活、开发稳定的电解质、对电极进行表面修饰增强稳定性等。此外,为了指导高性能M-O2/CO2电池和其他涉及碳酸盐的电池的进一步发展,有必要深入研究1O2和其他碱金属碳酸盐(如Na2CO3和K2CO3)之间的关系。
4.3 电池组分对1O2的影响
4.3.1 电解液
早期研究表明,溶剂、盐和功能添加剂对M-O2电池反应中间体的稳定性以及ORR和OER机制有较大影响。对于高DN溶剂〔例如二甲基亚砜(DMSO)和N,N'-二甲基丙烯脲(DMPU)〕而言,Li+或含Li+中间体易被其溶剂化,诱导超氧自由基反应释放1O2,如图6a和b所示。此外,高DN溶剂可以稳定超氧物种,使其不受阳离子干扰发生歧化反应。类似的机制也存在于充电过程,这种情况下,高DN溶剂可以将固态产物强溶解为Li2−xO2,从而提高超氧物种浓度。相比之下,低DN溶剂〔例如1,2-二甲氧基乙烷(DME)和乙腈(ACN)〕对Li+的溶解作用较弱,这种情况下,超氧中间体倾向通过二次电化学还原生成Li2O2膜,从而抑制1O2的产生。然而,Li-O2电池中的相关结论并不适用于Na-O2电池。因为对于Na-O2电池而言,NaO2的歧化反应更易在低DN溶剂中进行。客观来讲,当前的研究对于1O2形成与电解质性质之间的关系缺乏全面的理解和强有力的证据,未来应多关注相关领域。

图6 1O2产量与溶剂的DN和AN之间的关系。(Copyright © 2020, American Chemical Society)
电解质添加剂也会影响M-O2电池中间体的溶解性和反应机制。比如,NO3−阴离子可以提高电解质的DN,从而促进超氧物质的歧化反应。此外,水以及其他作为相转移催化剂的质子性物质也可以诱导超氧物种的歧化反应,使得1O2的产量进一步提高。一般来讲,中间体的稳定性可以通过路易斯酸碱理论解释。比如,O2−(sol)的碱性较弱,可以被K+和Cs+等弱路易斯酸稳定,这种稳定作用可以加剧1O2的形成。因此,调控电解质成分时必须考虑到对1O2的影响,必要时采取适当的防御措施。
4.3.2 电催化剂
4.3.2.1 固体催化剂
电催化剂是M-O2电池的关键成分,对降低过电位和提高能量效率起着至关重要的作用。催化剂通过调控充放电过程的基元反应影响产物的特性,包括其晶体结构、尺寸和形态。基于第4.1节的讨论不难推测,电催化剂可能影响1O2形成的(电)化学路径。然而,具体机制尚不清楚,阻碍了催化剂的进一步设计和优化。
根据Pierini等人的计算结果,当过电位超过0.5 V时,1O2析出的活化能不足1.0 eV。这意味着阻碍能量从极化过电位传递到LiO2能够抑制1O2形成。理论计算表明,2D-MoO3纳米片可通过提高Li-O2电池中超氧二聚体的形成能垒降低1O2的产量。在Na-O2电池中,2D-MoO3纳米片则提高了二聚中间体形成1O2分子的能量,从而抑制了1O2的形成。尽管理论计算结果较为正向,但还需要实验研究进一步验证。Samojlov等人制备了一系列代表性的电催化剂,系统探究了电催化剂对Li-O2电池中1O2形成的影响。结果表明,过渡金属氧化物MnO2和Co3O4减小了超氧离子的歧化能垒,促进了1O2的形成;而导电材料〔如炭黑Super P(SP)、亲水性Super P(SP hp)、Pd和TiC〕则有效抑制了1O2的产生(图7a)。然而,当痕量水存在时,电催化剂可以促进HO2中间体的歧化反应(2HO2 → H2O2 + 3O2/1O2;2H2O2 → 2H2O + 3O2/1O2),导致更多的1O2产生。因此,在筛选电催化剂材料时,除了关注电化学性能参数外,还应认真考察它们对反应可逆性的影响。最近,Lin等人提出,电催化剂能够通过调节放电产物的成分来影响1O2的形成。与纯CNT相比,Co3O4/CNT复合材料减少了类LiO2的形成,从而同时抑制了1O2形成的化学路径和电化学路径(图7b)。然而,缺陷态的过氧化锂Li2−xO2是Li-O2电池较为理想的放电产物,因为它能够降低电荷转移电阻。此外,降低充电电位有望抑制1O2形成的电化学路径,实现高度可逆的电池运转。例如,当RuO2将充电电压降低到3.6 V以下时,1O2的产量从15.1 μmol L−1降至9.5 μmol L−1。这意味着合适的电催化剂能够有效抑制1O2形成。
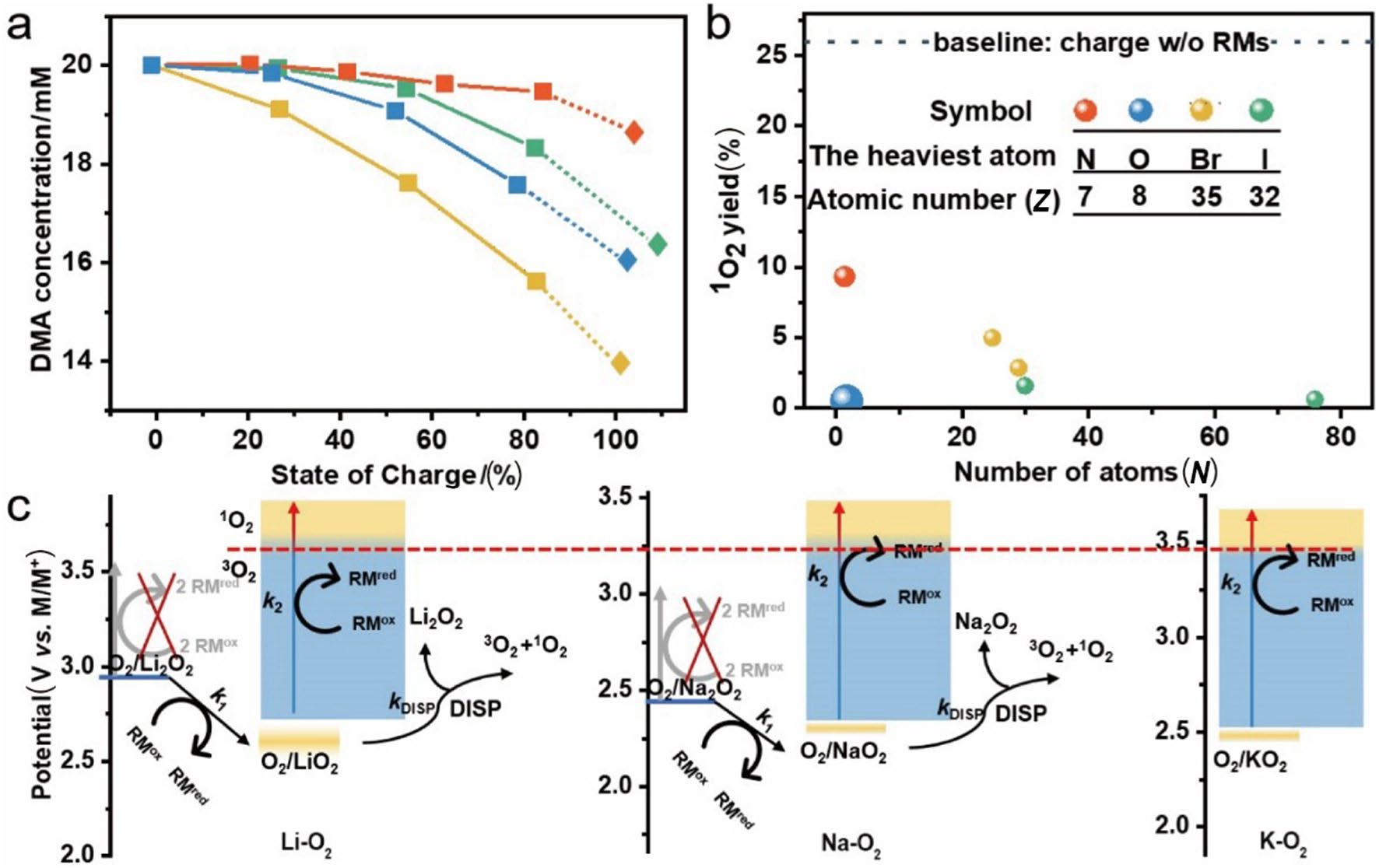
图7 a DMA在不添加RM或添加TEMPO、LiI或LiBr的Li-O2电池充电过程中的消耗量;b 1O2产量与RM所含原子数和最重原子的原子数之间的关系;c RM作用下的产物(Li2O2、Na2O2 和 KO2)氧化机理。(Copyright © 2020, Royal Society of Chemistry;Copyright © 2021, Springer Nature)
4.3.2.2 可溶性氧化还原介质
可溶性氧化还原介质(RMs)是M-O2电池中另一种代表性电催化剂,在提高反应动力学和能量效率方面表现出色。然而,对于多电子转移的RMs,如TEMPO、四硫富瓦烯(TTF)、2-氮杂金刚烷-N-氧自由基(AZADO),它们的单电子氧化中间态会与超氧离子反应形成1O2,严重损害M-O2电池的稳定性。合理设计电解质或许能够避免超氧中间体的形成。此外,Liang研究了RMs和1O2之间的相互作用。结果表明,在未添加RMs的电池中,1O2占氧气总析出量的27%,而当RMs存在时,1O2的形成受到了抑制(图7a)。他们将这种抑制作用归结于RMs作用下加强的系间窜越(ISC)。这种现象受两个因素影响(图7b)。首先,自旋-振动耦合(SVC)可以增强ISC速率,该模式与分子中的原子数量(以下简称为N)密切相关。此外,自旋-轨道耦合(SOC)也可以提高ISC速率。由于SOC的动量受核电荷的控制,因此这种耦合通常与原子的重量有关,并取决于对应原子序数的四次方。量化结果显示,相比于Li-O2电池中常用的猝灭剂1,4-二氮杂环[2.2.2]辛烷(DABCO),RMs对于抑制1O2的效率高出三个数量级。这可能是因为在RMs介导的OER过程中,氧活性反应中间体较少。类似地,2,2′,7,7′-四[N,N-二-4-甲氧基苯胺]-9,9'-spirobi-芴(Spiro-OMeTAD)也可以同时充当RMs和1O2猝灭剂,猝灭作用主要通过芳香胺和富电子多环芳烃实现。然而,RMs催化的电池的电化学性能特别是循环寿命,尚未得到显著改善。最初,研究人员将其归咎于“氧化还原穿梭”,但即使采用物理和化学手段将RMs限制在正极区域,循环性能仍然不理想。考虑到大多数RMs是有机化合物,如同碳或有机电解质一样,它们易受到ROS的攻击而分解。据报道,氯或二茂铁可以作用于过氧化物和超氧化物的化学氧化,从而促进1O2的产生,因此推测RMs可能也存在这种情况。此外,一些氧化还原电位高于3.5 V的RMs可以通过促进超氧化物氧化而加速1O2的形成,如图7c所示。1O2的产量受相对反应动力学的影响,当氧化速率快于歧化反应时,可以抑制1O2的产生,这为抵御1O2攻击提供了一种新的策略。
5 1O2诱导的副反应
如前所述,1O2具有强亲电性,化学性质异常活泼。Freiberg结合在线气体分析和从头算方法研究了1O2与碳酸乙烯酯(EC)之间的反应。他们发现1O2会攻击EC中的乙烯基团(–CH2–CH2–),产生乙烯碳酸酯(VC)中间体和过氧化氢(H2O2)分子,同时析出CO2。不同碳酸盐溶剂与1O2之间的反应差异很大。与环状EC相比,线性碳酸盐二甲酸甲酯(DMC)对1O2更为稳定。密度泛函理论(DFT)的结果表明,1O2通过两种途径使DME失活:(1)1O2攻击乙烯基团,形成C–C双键和H2O2;(2)攻击甲基基团形成H2O2。与乙醚碳上的C–H断裂相比,甲醚碳上的脱氢在动力学上更有利,合理解释了DME分解比TEGDME更严重的原因。Mahne等人发现在1O2的存在下,大量CO2析出,同时伴随着甲酸锂和乙酸锂的生成。他们认为1O2与DME溶剂反应产生了包括ROOH、R•和ROO•等在内的中间体。这些中间体比活性氧化学性质更活泼,是电解液分解的主要原因。然而,电解液基团与1O2之间具体的反应机制尚未被明晰。
此外,1O2的亲电性特征使其易与富电子化合物发生反应。例如,石墨碳的边缘有丰富的富电子区域,可以通过Diels-Alder [2+2]和[4+2]模式与1O2发生反应,从而在石墨表面形成含氧功能团。在M-O2电池中,研究人员对有机RMs对1O2的稳定性开展了研究。由于1O2对富电子成分易发生亲电加成,因此,相比于O2、超氧和过氧化物,RMs更容易受到1O2的影响。这在很大程度上取决于RMs的分子结构和氧化还原状态。基于这些发现,1O2被认为是RMs失活的主要因素。因此,有必要开发耐1O2攻击的RMs,或采取措施抑制1O2的生成。
6 1O2失活策略
6.1 化学捕获剂
一般而言,化学捕获剂(T)可以选择性地与1O2反应,形成不会干扰电池反应的内过氧化物(T + 1O2 → T-O2)。DMA已经被证明是一种经典的化学捕获剂,可以保护电池成分免受1O2的攻击。然而,不可逆的失活过程阻碍了它们的实际应用。具体来讲,被捕获的O2无法在电池中可逆释放,导致后续循环中活性物质的损失。此外,捕获剂无法被可逆利用,因此无法完全终止副反应。因此,对于电池体系而言,化学捕获剂并不是一种理想的消除1O2的策略。
6.2 物理淬灭剂
相比之下,物理猝灭剂(Q)是一种可逆的1O2失活策略,它可以使1O2转变为3O2,而不消耗或产生其他化学物质。因此,相比于化学捕获剂,物理猝灭剂在M-O2电池中的适用性更强。然而,物理猝灭剂在电解液中的溶解度较低,扩散速度较慢,一定程度上限制了其功能发挥。
电子-振动能量转移(ET)和电荷转移(CT)等非辐射方法可以用于物理猝灭1O2。对于ET猝灭,猝灭剂的激发态能量低于1O2的能量,其中代表性的分子是类胡萝卜素。然而,类胡萝卜素的氧化稳定性较差,因此与电池系统不兼容。CT机制的猝灭速率明显快于ET机制。淬灭过程中首先形成一个激发态复合物[1O2...Q]*和一个单线态CT复合物1(Q1Δ)CT,随后通过能量释放形成三线态复合物3(Q3Σ)CT,最终解离为Q和3O2。这种机制常见于富电子物质,如胺类、类胡萝卜素、有机金属化合物和叠氮化物等。
作为代表性的物理猝灭剂,DABCO在有机溶剂中的作用已被广泛研究。然而,DABCO在3.6 V以上会电化学分解,无法在Li-O2电池的高充电电压下工作。因此,研究人员致力于降低Li-O2电池的充电电位并设计电化学性质更稳定的猝灭剂。如图8a和b所示,采用二甲基苯并吡嗪(DMPZ)将充电电位降低到3.2 V,不仅有效减小了1O2引起的副反应,而且保护了DMPZ免受1O2的攻击。然而,这种方法使电池体系变得更为复杂并降低了体系的能量密度。此外,穿梭效应可能导致DMPZ逐渐失效。因此,迫切需要更可行且有效的1O2失活策略。通过单烷基化将DABCO转变为对应的铵盐(DABCOnium),可以形成电化学稳定窗口超过5 V的离子液体。一方面,DABCOnium能够有效地猝灭1O2;另一方面,形成的ILs不易挥发,对ROS稳定且与Li金属相容。因此,尽管充电电位很高,该体系仍然表现出了超长的循环寿命。鉴于1O2对M-O2电池可逆性的重要性,进一步研究1O2猝灭机制非常必要。最近,Jiang等人阐明了富电子化合物三苯胺(TPA)猝灭1O2的具体机制。如图8c所示,在Li-O2电池循环过程中,TPA与亲电的1O2发生作用,形成一个自由能高达0.99 eV的单线态电荷转移复合物(1 CT),然后通过快速的非辐射ISC过程自发地转化为自由能较低(−0.78 eV)的三线态电荷转移复合物(3 CT),从而有效抑制了由1O2引起的副反应。不足的是,该体系过电位较大,不利于M-O2能量密度的发挥。
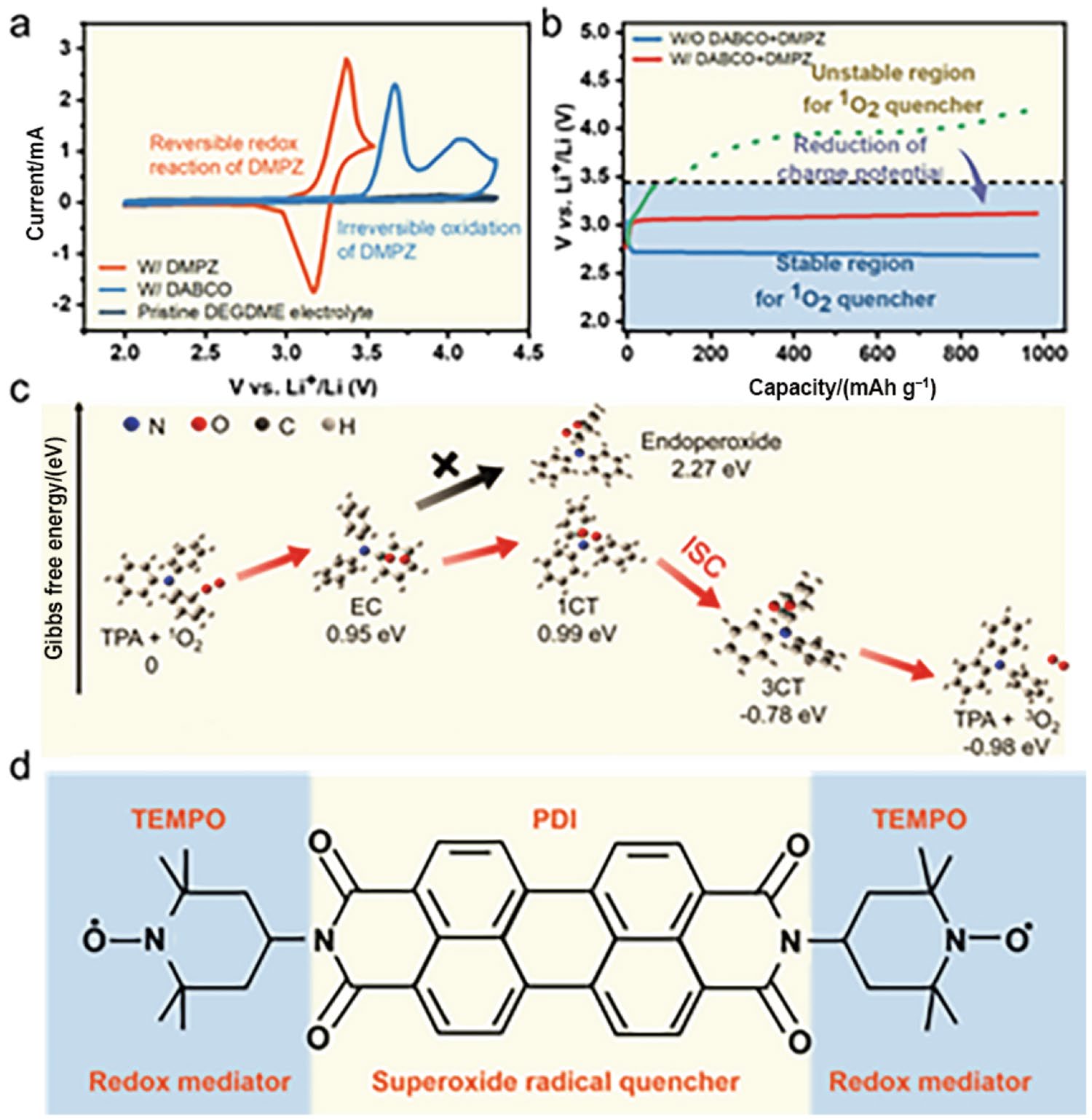
图8 a 不同电解液的循环伏安曲线;b 不同电解液组成Li-O2电池的充放电曲线;c TPA淬灭1O2的机制示意图;d PDI-TEMPO 的分子结构示意图。(Copyright © 2019, American Chemical Society;Copyright © 2022, The Proceedings of the National Academy of Sciences of the United States of America;Copyright © 2022, The American Association for the Advancement of Science)
理论上讲,开发具有1O2猝灭能力的电解质对于M-O2电池的实际应用更有意义。Nishioka等人发现,N,N′-二甲基乙酰胺基电解质可以使1O2失活,其猝灭能力与含有数毫摩尔浓度DMA的TEGDME相当。此外,尽管N,N-二甲基乙酰胺基电解质对O2−耐受性较差,但是该体系中的Li2O2更易分解,因此循环性能更好。可见,1O2对M-O2电池的损害比O2−更严重。因此,对1O2的耐受性应该是筛选电解质的首要标准。一些具有高频振动的溶剂可以通过电子-振动耦合使1O2失活,为开发有效的1O2猝灭剂提供了新方向。当然,实际应用时还需考虑电解质的稳定性和电池电化学性能之间的关系,同时兼顾到与电池其它成分的兼容性。
值得注意的是,1O2在被猝灭剂失活之前可能会与电池组分发生反应。因此,与通过物理或化学手段使1O2失活相比,从源头上抑制1O2形成更有意义。为此,Zhang等人提出了一种多功能超氧自由基猝灭剂N,N′-二-(2,2,6,6-四甲基-1-氧基-4-哌啶基)-苝并[3,4:9,10]二酸二酐(PDI-TEMPO),如图8d所示。其中,亚硝基自由基促进了Li2O2在溶液中的形成和分解,而苝并二酸二酐(PDI)骨架则有效猝灭了充放电过程中产生的超氧化物。基于此,超氧自由基的化学歧化反应和超氧/过氧化物的电化学氧化被制,意味着1O2的两种主要形成途径从根本上被消除。然而,根据最近的报道,当超氧化物歧化反应被功能性添加剂促进时,1O2的产量将会增加。在此,PDI-TEMPO表现出的正向结果可能是由于TEMPO的存在,因为已经证明TEMPO是一种有效的1O2抑制剂。
06 结论与展望
由于1O2与电池的稳定性和可逆性密切相关,了解其(电)化学性质非常重要。本综述总结了1O2的基本特性及其检测方法,包括直接的磷光检测和间接的化学捕获剂检测。详细讨论了M-O2电池中1O2的形成机制。通常情况下,超氧化物中间体的化学歧化反应和过氧(超氧)化物的电化学氧化分解都有助于1O2的形成。此外,强调了电池组分和空气污染物对1O2生成的影响。在CO2存在下,M-O2电池中的产物可能从过氧化物转化为对应的碳酸盐,而碳酸盐的电化学分解会导致1O2形成。与电解质和电催化剂的作用方式类似,痕量水可以通过调节反应途径或超氧化物的溶剂化来调控1O2的形成。因此,针对性地设计开发新型电解质或者对电极表面结构进行改性有望抑制1O2形成。M-O2电池的商业化应用很大程度上取决于对反应机制的理解。通过阐明1O2在电池副反应中所起的作用,研究人员可以制定对应的保护策略,从而有效延长电池寿命。关于M-O2电池中1O2未来的研究方向,我们提出了如下想法。
(1)形成机制。确定1O2生成的反应途径和涉及到的中间体,并研究不同电池组分对其形成的影响。为了精确检测M-O2电池中1O2的形成和演化,需要开发更先进的技术并进行互补使用。例如,紫外-可见光谱可以监测捕获剂衍生产物的形成和分解,而荧光光谱可以追踪1O2的产生和猝灭。此外,同位素标记技术可以确定参与反应的途径和中间体。通过结合这些技术,研究人员可以更全面地了解反应机制,并开发更高效稳定的M-O2电池。
(2)失活策略。通过开发可以选择性地与1O2反应的材料、添加剂和电解质,探索避免1O2形成或抑制1O2化学活性的新方法。尽管猝灭剂可以保护电池免受1O2的攻击,但它增加了系统的复杂性。这里,建议多关注分子工程,从而开发更简单、更有效的防御措施。例如,α-碳上没有任何氢原子的甲基化环醚2,2,4,4,5,5-六甲基-1,3-二氧兰(HMD),对1O2表现出极好的稳定性。此外,通过控制H2O和CO2的含量提高电池运行环境的清洁度,一定程度上也能够抑制M-O2电池中1O2的形成。
(3)相互作用机制。深入了解1O2与电池组分(电极材料、电解质、粘合剂等)之间的相互作用机制,特别是相关的热力学和动力学。尽管1O2被视为M-O2电池中寄生反应的罪魁祸首,但由1O2攻击引发的详细分解途径仍未知,这严重阻碍了高性能电池的发展。考虑到1O2的寿命短且浓度低,实验研究难度较大,理论计算和模拟或许能够提供一些指导。
07 主要作者简介

窦雅颖(第一作者),郑州大学化工学院直聘副研究员。2021年毕业于吉林大学凝聚态物理专业,获理学博士学位,期间在中国科学院长春应用化学研究所联合培养,师从彭章泉研究员。2021年8月加入郑州大学,主要研究方向为金属-空气电池,涉及反应机理揭示、催化机理探究与高效催化剂设计等方面。

周震(通信作者),郑州大学化工学院院长、二级教授、博士生导师。主持国家重点研发计划项目课题和国家自然科学基金重点项目等研究。通过高通量计算、机器学习与实验相结合开展新能源研究。在国内外期刊发表论文350余篇。论文被引用39 000余次,H-index为112。2014—2022年连续九年入选爱思唯尔“中国高被引学者”榜单。2018—2022年连续五年入选科睿唯安全球“高被引科学家”。2020年入选英国皇家化学会会士(FRSC)。现为Journal of Materials Chemistry A和Green Energy and Environment等期刊副主编、Interdisciplinary Materials学术编辑、Journal of Power Sources机器学习专刊客座编辑以及Batteries & Supercaps和《电化学》等七本期刊编委以及中国电子学会化学与物理电源技术分会第八届委员会委员、中国化学会理论化学专业委员会委员。
推荐阅读
1. 苏新教授/吴际教授/范丽珍教授最新EER综述|用于锂电池的聚乙烯基氧化物复合固态电解质:现状、低温和高压限制、前景
2. 同济大学林瑞教授最新EER综述|酸性环境下的电催化二氧化碳还原
3. 上海交通大学章俊良教授/沈水云教授团队最新EER综述| 离子液体修饰催化剂在质子交换膜燃料电池中的应用:从半电池到全电池
4. 美国西弗吉尼亚大学刘兴博教授课题组最新EER综述|聚焦水系锌离子电池的能量存储化学:从正极到负极
5. 哈尔滨工业大学(深圳)魏军教授团队最新EER综述|印刷固态电池
关于我们

Electrochemical Energy Reviews (《电化学能源评论(英文)》,简称EER),由上海大学主办,该期刊旨在及时反映国际电化学能源转换与存储领域最新研究进展。EER是全球首本专注于电化学能源的英文综述类期刊。EER覆盖电化学能源转换与存储所有学科,包括燃料电池、锂电池、金属离子电池、金属-空气电池、超级电容器、制氢-储氢、CO2转换等。EER为季刊,每年3月、6月、9月以及12月出版。创刊号在2018年3月正式出版。
2018年6月,经过激烈角逐(87选20),EER成功入选由中国科协、财政部、教育部、国家新闻出版署、中国科学院、中国工程院等六部门联合实施的中国科技期刊国际影响力提升计划D类项目,进入新刊国家队阵列。
EER目前已被收录的国内外重要数据库包括SCIE、EI、Scopus、CSCD等;入选“中国最具国际影响力学术期刊”榜单。2024年6月发布的爱思唯尔CiteScore为41.9,在3个学科(材料科学、化学工程、电化学)蝉联首位。2024年6月发布的JCR影响因子为28.4,在全球电化学学科排名第二。EER目前的文章篇均下载量超过5 400次。
欢迎关注和投稿
期刊执行严格的同行评议,提供英文润色、图片精修、封面图片设计等服务。欢迎关注和投稿。
联系我们

长按/扫描关注EER微信公众号

长按/扫描了解EER投稿指南

长按/扫描了解EER proposal模板
E-mail: eer@oa.shu.edu.cn
SpringerWeb: https://www.springer.com/journal/41918
ShuWeb: http://www.eer.shu.edu.cn
WeChat: ElectrochemicalEnergyReviews
原稿:作者提供
编辑:全海芹
初审:全海芹、陈昕伊
复审:何晓燕
终审:孙书会、李喜飞、徐海丽
转载本文请联系原作者获取授权,同时请注明本文来自何晓燕科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3390413-1478979.html?mobile=1
收藏

