实体瘤免疫治疗的关键挑战是缺乏肿瘤特异性抗原,导致T细胞不能识别肿瘤细胞并发挥特异性杀伤作用。而肿瘤特异HLA/肽复合物(pHLA)是理想靶点,TCR-T 和 CAR-T(基于TCR模拟抗体,TCR-mimetic antibodies)均可靶向pHLA,但两者疗效差异及机制存在不同。
TCRm 抗体衍生的 CAR-T 细胞是一种靶向肿瘤特异性 HLA / 肽复合物(pHLA)的工程化 T 细胞疗法,核心是将TCR 模拟抗体(TCRm)重构成嵌合抗原受体(CAR)并表达在 T 细胞上。
核心构成与设计逻辑
TCRm 抗体的作用:TCRm 抗体能模拟 T 细胞受体(TCR)的功能,特异性识别靶细胞表面由 HLA 分子呈递的肿瘤特异性肽段(即 pHLA 复合物),且无需 CD8 共受体辅助,解决了传统 TCR 依赖共受体的局限。
CAR 的结构组装:将 TCRm 抗体的轻链(VL)和重链(VH)可变区克隆为单链抗体(scFv),作为 CAR 的抗原结合域;下游串联共刺激信号域(CD28 或 41BB)和 CD3ζ 信号域,形成完整的 CAR 结构(如 CD28/z CAR、41BB/z CAR)。
T 细胞工程改造:通过慢病毒转导等方式,将上述 CAR 结构导入健康人供体 T 细胞,使 T 细胞获得特异性识别并杀伤表达目标 pHLA 的肿瘤细胞的能力。
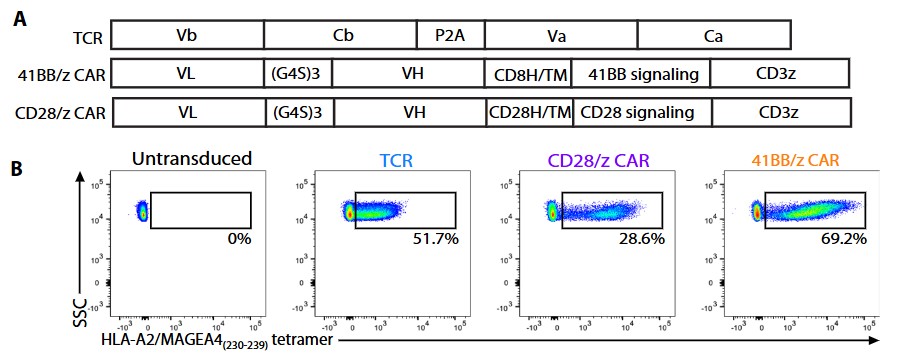
关键特性与优势
靶向特异性:仅识别肿瘤细胞特有的 pHLA 复合物,正常组织不表达该靶点,降低脱靶毒性。
抗原敏感性适配:虽对极低拷贝 pHLA(如 < 50 拷贝/细胞)的敏感性低于TCR-T 细胞,但能有效识别临床相关拷贝数(如:550 拷贝/细胞,与患者肿瘤活检样本一致)的 pHLA。
强效信号传导:通过 CAR 结构中的共刺激域(CD28 或 41BB)和 CD3ζ 域传递完整激活信号,促进 T 细胞增殖、细胞因子释放(如 IFN-γ)和肿瘤杀伤。
体内持久性强:相比 TCR-T 细胞易终端分化和功能耗竭的特点,CAR-T 细胞(尤其 41BB/z 型)能维持中心记忆表型,在肿瘤微环境中持续增殖并发挥长效抗肿瘤作用。
靶标选择:选取HLA-A2/MAGEA4₂₃₀–₂₃₉作为模型 pHLA,MAGEA4 在黑色素瘤、滑膜肉瘤等实体瘤中高表达,其衍生肽可激活 CD8⁺T 细胞,且在患者肿瘤活检中拷贝数约550拷贝/细胞。
研究目的:直接对比靶向同一低拷贝 pHLA 的 TCR-T 与 CAR-T 细胞的体内外疗效,揭示机制差异,并探索增强 T 细胞治疗效果的策略。
体外功能实验结果
特异性激活:60%-85% 的 CD8⁺TCR-T 和 CAR-T 细胞在与 A375 细胞共培养时表达激活标志物CD69,对 MAGEA4 敲除的A375细胞无反应;CD28/z CAR-T 的 CD69 几何平均荧光强度(gMFI)最高。
细胞毒性:在 2.5 小时细胞毒性实验中,两者对 A375(550 拷贝/细胞)和 Sk-Mel-37(640 拷贝/细胞)均有强效杀伤,对 A375MAGEA4KO 细胞(敲除了MAGEA4基因)A375细胞系无杀伤作用。
细胞因子释放:与靶细胞共培养时,TCR-T 和 CAR-T 细胞释放的 IFN-γ 较对照组高 50-400 倍,其中 41BB/z CAR-T 释放 IFN-γ 水平最高。
抗原敏感性:TCR-T 对低拷贝 pHLA 更敏感,在< 50 拷贝/细胞的靶细胞中仍有强反应;EC₅₀值显示,TCR-T 的敏感性是41BB/z CAR-T 的20.6倍、是CD28/z CAR-T的9.5倍。
体内抗肿瘤效果
体内实验是在免疫缺陷NOD-scid IL2Rγnull(NSG)小鼠中进行的,通过植入A375肿瘤细胞,然后给以TCR-T 或 CAR-T 细胞评估抗肿瘤效果。
肿瘤消退情况:
CD28/z CAR-T:给药后快速诱导肿瘤消退,100% 实现肿瘤清除。
41BB/z CAR-T:起效延迟,但最终可清除所有肿瘤。
TCR-T:仅在给药后10天内实现短暂肿瘤消退,随后所有肿瘤复发。
关键差异:
血清 IFN-γ:CD28/z CAR-T 在给药后2天达峰值,TCR-T与41BB/z CAR-T 诱导的IFN-γ水平相似。
T 细胞扩张:41BB/z CAR-T 在外周血中显著扩张,而 TCR-T 未能有效增殖和持续存在。
肿瘤浸润:CD28/z CAR-T 在给药后5天肿瘤内浸润量高;41BB/z CAR-T在12天时肿瘤内细胞数量增长约800倍,而TCR-T在12天未能积累。
TCR-T 细胞缺陷机制
表型分化:TCR-T 细胞倾向于终端分化(CD45RO⁻CCR7⁻ TEMRA 表型),而 41BB/z CAR-T 细胞维持更多 CD45RO⁺CCR7⁺中心记忆 T 细胞。
功能异常:在慢性抗原刺激下,TCR-T 细胞表达更高水平的 PD-1、LAG3、TIM3 等功能障碍标志物,且多次肿瘤再挑战后细胞毒性逐渐减弱。
共受体依赖:MAGEA4 TCR需CD8共受体辅助激活,CD4⁺TCR-T细胞无法有效激活,即使纯化CD8⁺TCR-T细胞或共表达CD8a,仍无法改善体内疗效。
研究结论
靶向相同低拷贝pHLA时,含共刺激信号域的CAR-T体内抗肿瘤疗效显著优于TCR-T细胞。
TCR-T细胞的核心缺陷是增殖和持久性不足,源于终端分化和功能异常,可通过共激活41BB 信号或联合靶向 IL-2 改善。
两种优化策略机制不同:41BB 信号既改善分化又增强增殖,IL-2 信号主要促进细胞扩张和持续存在,为实体瘤pHLA靶向细胞治疗的临床转化提供了方向。
Optimally engineered HLA/peptide-specific CAR-T cellsoutperform TCR-T cells to eradicate solid tumors. Sci. Adv. 12, 21 January 2026
转载本文请联系原作者获取授权,同时请注明本文来自阎影科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3302154-1519656.html?mobile=1
收藏

