循环肿瘤反应性淋巴细胞(Circulating Tumor-Reactive Lymphocytes,)的研究在 2023 年后取得了显著进展,尤其是在技术转化和临床前研究方面。
技术转化与公司动态
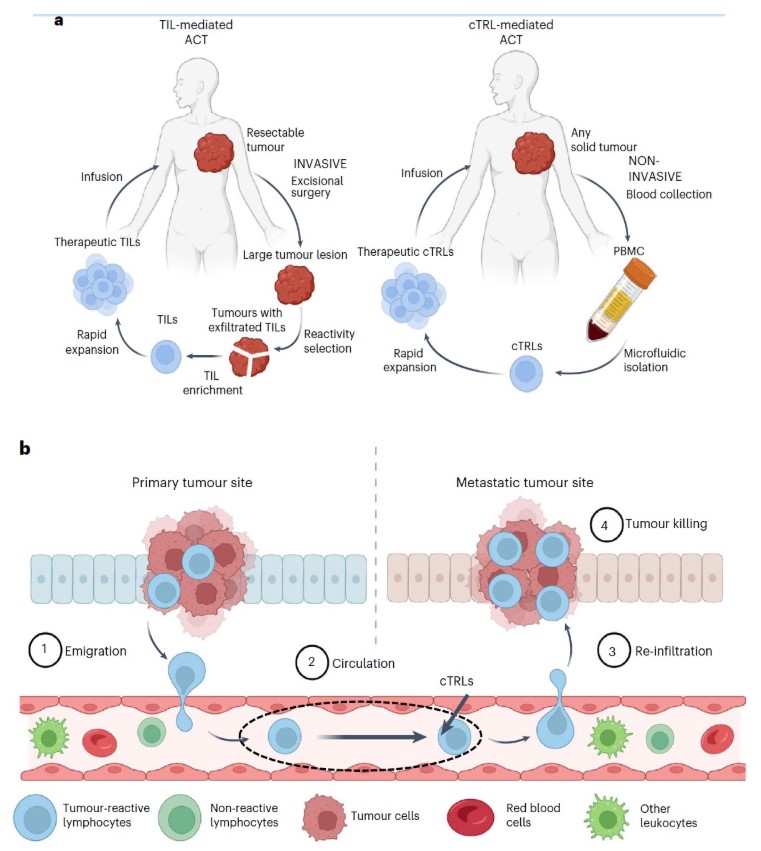
美国西北大学Shana Kelley团队于 2023 年 4 月首次从血液中非侵入性分离出 cTRL 后,迅速推进技术转化。其创立的生物技术公司CTRL Therapeutics在2023年4月完成1000万美元种子轮融资,并计划向 FDA 提交临床试验申请。该公司开发的专有平台IsoQore™可从外周血中高效分离和扩增 cTRL,显著降低了传统肿瘤浸润淋巴细胞(TIL)疗法对手术切除肿瘤的依赖。2024年11月SITC 年会上展示两项关键研究,分别针对黑色素瘤和结直肠癌患者的cTRL特性,显示 cTRL 在抗肿瘤活性和免疫耗竭水平上的优势。
临床前研究突破
CTRL 公司的研究显示,从免疫检查点抑制剂(ICI)治疗失败的黑色素瘤患者血液中分离的 cTRL,仍能对自体肿瘤细胞产生显著杀伤作用。这些cTRL的T细胞受体(TCR)克隆型与患者肿瘤浸润淋巴细胞(TIL)高度重叠,表明其保留了肿瘤特异性反应能力。这一发现为 cTRL 在耐药患者中的应用提供了理论依据;另一项针对结直肠癌(CRC)患者的研究发现,cTRL 在体外对自体肿瘤细胞的反应性显著高于TIL,且表现出更低的免疫耗竭标志物(如 PD-1、TIM-3)表达。这意味着 cTRL 可能在过继细胞疗法中具有更持久的抗肿瘤活性。
cTRL与TIL的疗效对比
动物实验表明,从血液中分离的CD8+ CD103+ cTRL 在肿瘤模型中的杀伤效力与 TIL 相当,且对免疫检查点阻断(如抗 PD-1抗体)的反应相似。这一特性为 cTRL 联合免疫治疗提供了可行性依据。
为什么从外周血分离CD8⁺CD103⁺细胞?
CD8⁺CD103⁺T 细胞是一类具有特殊归巢能力和功能表型的T细胞亚群,其核心特征与CD103(整合素αEβ7) 的分子功能直接相关:CD103 是整合素家族成员,与β7亚基形成异二聚体,特异性结合E -钙粘蛋白(E-cadherin)—— 一种广泛表达于上皮细胞(如肠道、肺、乳腺、皮肤等)的黏附分子。这种结合是T细胞黏附于上皮组织、穿透肿瘤微环境的关键机制。
CD8⁺CD103⁺T 细胞通常兼具细胞毒性(高表达颗粒酶B、穿孔素)和记忆性(高表达 CD45RO)特征,部分还表达组织驻留记忆T细胞(TRM)标志物(如 CD69)。尽管传统上 TRM 被认为局限于组织中,但血液中存在的CD8⁺CD103⁺细胞被证实是循环性TRM 前体或具有迁移能力的功能性亚群,既能在血液中循环,又能响应趋化信号迁移至肿瘤组织。
从血液中分离CD8⁺CD103⁺细胞的核心意义:
非侵入性获取肿瘤反应性T细胞,可突破TIL疗法的局限性。传统TIL疗法依赖手术切除肿瘤组织获取T细胞,对无法手术(如晚期转移)的患者可行性很低。而血液中 CD8⁺CD103⁺细胞可通过外周血采集获得,无需依赖肿瘤组织,显著降低患者创伤和治疗门槛,可及性近乎达到所有患者。
研究证实,血液中 CD8⁺CD103⁺细胞的TCR克隆型与肿瘤内的TIL高度重叠(尤其在黑色素瘤、结直肠癌中),表明其保留了肿瘤特异性识别能力,可直接用于过继细胞治疗。
多数实体瘤(如肺癌、乳腺癌、结直肠癌、黑色素瘤)起源于上皮组织,其肿瘤微环境中高表达 E-钙粘蛋白。CD8⁺CD103⁺细胞通过 CD103与E-钙粘蛋白的结合,可特异性黏附并穿透肿瘤基质,克服T细胞浸润不足的难题(这是多数免疫治疗耐药的核心原因)。
动物实验显示,输注CD8⁺CD103⁺细胞后,其在肿瘤内的富集量是普通 CD8⁺T 细胞的 3-5 倍,且肿瘤缩小速度显著更快。此外,低耗竭、高持久性,提升治疗耐久性。血液中 CD8⁺CD103⁺细胞通常表达低水平的免疫耗竭标志物(如 PD-1、TIM-3),且高表达抗凋亡分子(如 Bcl-2)。这使其在过继输注后能更持久地存活并发挥杀伤作用,避免传统TIL疗法中部分细胞快速耗竭的问题。
CD103 的特异性使其成为筛选“高效肿瘤靶向T细胞”的理想标志,其核心原因包括:CD103⁺CD8⁺T细胞的肿瘤浸润能力。研究显示,CD103⁺CD8⁺T 细胞在肿瘤内的浸润密度显著高于CD103⁻细胞,且其密度与患者预后正相关(如黑色素瘤患者中,CD103⁺T细胞浸润高者5年生存率提升40%)。
CD103的表达与T细胞的抗原经历密切相关:在肿瘤抗原刺激下,T 细胞会上调 CD103表达以增强组织归巢。因此,CD103可作为“肿瘤抗原经验性T细胞”的筛选标签,显著提高从血液中富集肿瘤特异性T细胞的效率(较随机分选提高10-15倍)。
此外,CD103⁺CD8⁺T细胞不仅能杀伤肿瘤细胞,还能通过分泌IFN-γ等细胞因子重塑肿瘤微环境(如减少纤维化、抑制血管生成),间接增强其他免疫细胞的浸润。这种 “双重功能” 使其优于单一细胞毒性的T细胞亚群。
2024年CTRL公司在SITC年会上公布的数据显示:从黑色素瘤患者血液中分离的 CD8⁺CD103⁺cTRL,在体外对自体肿瘤细胞的杀伤率达72%(显著高于CD103⁻细胞的35%);在小鼠模型中,输注该亚群后肿瘤完全缓解率达60%,而传统TIL疗法为 45%。这进一步证实了 CD8⁺CD103⁺细胞在临床转化中的潜力。
临床应用前景
cTRL 不仅存在于黑色素瘤、结直肠癌中,还在肺癌、乳腺癌等实体瘤患者血液中被检测到。其广谱性为治疗多种难治性癌症提供了可能。研究人员正在探索 cTRL 与ICI免疫治疗和个性化癌症疫苗的联合应用的前景。例如,cTRL可作为疫苗诱导的外周血T细胞扩增的补充,增强系统性抗肿瘤免疫。
技术优势与挑战
与TIL相比,cTRL的分离无需手术切除肿瘤,显著降低了患者风险和治疗成本。微流控免疫磁性细胞分选技术的优化(如 IsoQore™平台)可在短时间内从少量血液中富集数百万 cTRL,满足临床级细胞治疗需求。然而,cTRL 在血液中的天然丰度较低,如何进一步提高分离效率仍是技术难点。
临床试验推进
CTRL公司计划于 2025 年启动CTRL-001(基于 cTRL 的过继细胞疗法)的I期临床试验,评估其在实体瘤患者中的安全性和初步疗效。该试验将聚焦于黑色素瘤、结直肠癌和非小细胞肺癌。
机制研究的深化
目前cTRL迁移至肿瘤微环境的分子机制尚不明确。未来研究将探索趋化因子受体(如 CCR5、CXCR3)在 cTRL 归巢中的作用,以及肿瘤微环境对 cTRL 功能的调控;寻找预测cTRL 疗效的生物标志物(如血液中cTRL 频率、TCR多样性)是当前研究重点。例如,外周血中高频率的cTRL可能与患者对免疫治疗的响应相关性。
cTRL的发现为实体瘤免疫治疗带来了新范式。其非侵入性分离、广谱抗肿瘤活性及与现有疗法的协同潜力,使其成为极具前景的治疗手段。尽管仍需解决技术优化和临床验证问题,但 cTRL 已展现出改变实体瘤治疗格局的潜力。随着临床试验的推进和机制研究的深入,cTRL有望在未来 5-10 年内成为癌症治疗细胞治疗的重要组成部分。
转载本文请联系原作者获取授权,同时请注明本文来自阎影科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3302154-1495197.html?mobile=1
收藏

