在生物制药领域,支原体污染可能影响产品安全性和有效性,因此检测方法需具备高灵敏度、特异性和可靠性。目前该领域支原体检测的主流方法如下:
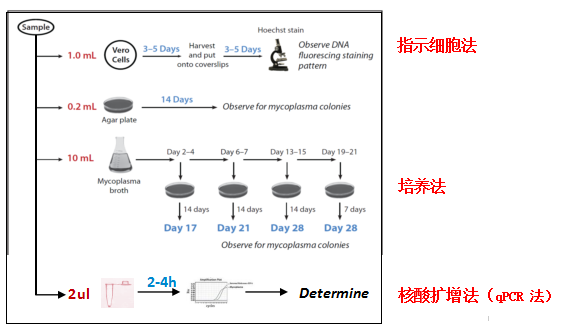
原理:通过设计针对支原体保守基因的特异性引物,利用 PCR 或实时荧光定量 PCR(qPCR)技术扩增样本中的支原体核酸,通过荧光信号或电泳结果判断是否存在污染。特点(qPCR法):
灵敏度高:配合抽提方案,可检测低至 101 CFU/mL 的支原体。
速度快:2-4 小时内可出结果,优于传统培养法。
特异性强:引物针对支原体特有序列,减少其他微生物干扰。
适用范围广:可检测细胞培养上清、发酵液、纯化产物等多种样本类型。应用场景:生物制药生产过程中的中间产物,以及细胞库、培养基的常规监控。
二、支原体培养法(经典金标准)原理:将样本接种于含血清、酵母提取物等营养成分的特殊培养基(如 Hayflick 培养基、PPLO 培养基)中,在适宜温度(35-37℃)和气体环境下培养,观察是否出现典型的 “油煎蛋” 状菌落。特点:
准确性高:可直接培养并鉴定活支原体,是药典(如《中国药典》3301 支原体检查法)规定的参考方法。
可进行药敏试验:若培养阳性,可进一步测试抗生素敏感性,指导污染处理。
缺点:培养周期长(需 21 天以上),操作复杂,对实验室环境和技术要求高。应用场景:用于法规要求的最终产品放行检测。
三、指示细胞法
原理:是一种通过观察特定细胞(指示细胞)在支原体污染后的形态或功能变化,来间接检测支原体的方法。
特点:
直观性:通过细胞形态或代谢变化直接反映支原体感染,无需复杂仪器,适合基层实验室。
模拟生理环境:指示细胞与支原体的相互作用更接近实际感染场景,可检测部分难以用核酸或培养法发现的苛养型支原体。
缺点:需较高浓度的支原体(10⁴-10⁵ CFU/mL)才能观察到明显变化,易漏检早期或低水平污染;耗时较长,共培养需 3-7 天;特异性差,结果判断易受人为因素影响。
应用场景:初步筛查,在缺乏 PCR 设备的实验室中,作为支原体污染的初筛手段,尤其是细胞培养过程中的日常监控。
几种方法的对比
检测方法 | 灵敏度 | 检测时间 | 特异性 | 操作复杂度 | 法规符合性 |
指示细胞法 | 低 | 3-7 天 | 低 | 低 | 非药典主流方法 |
培养法 | 中 | 21 天以上 | 高 | 高 | 药典金标准 |
核酸扩增法(qPCR 法) | 高 | 2-4 小时 | 高 | 中 | 药典可选:经过验证后,可以选用 |
转载本文请联系原作者获取授权,同时请注明本文来自邓倩云科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3140696-1491869.html?mobile=1
收藏

