精选
精选
为何Nature同日连发同一研究小组的三篇论文?
诸平
据美国霍华德·休斯医学研究所(Howard Hughes Medical Institute简称HHMI)2024年11月18日提供的消息,打破生物学定律:科学家揭露癌症的秘密武器(Breaking the Laws of Biology: Scientists Expose Cancer’s “Secret Weapon”)。
DNA通常存在于染色体内,但某些肿瘤在染色体外储存促癌基因(cancer-promoting genes),如染色体外DNA (extrachromosomal DNA 简称ecDNA)。新的研究正在研究ecDNA如何违背遗传惯例来驱动各种癌症,同时也提供了对抗这些侵袭性恶性肿瘤的潜在策略。
当它与身体对抗时,癌症欺骗了我们。新的研究调查了它的一个更大胆的把戏:将致癌基因隐藏在染色体外的环状DNA片段中。
由“癌症大挑战”(Cancer Grand Challenges)资助的三项新研究揭示了这种染色体外DNA (ecDNA)赋予肿瘤的不公平优势。霍华德·休斯医学研究所研究员、内科科学家霍华德·张(Howard Y. Chang)与斯坦福大学(Stanford University)的同事保罗·米歇尔(Paul Mischel)共同领导了两项研究,后者是2024年11月6日发表的三篇论文的主要作者。
King L. Hung, Matthew G. Jones, Ivy Tsz-Lo Wong, Ellis J. Curtis, Joshua T. Lange, Britney Jiayu He, Jens Luebeck, Rachel Schmargon, Elisa Scanu, Lotte Brückner, Xiaowei Yan, Rui Li, Aditi Gnanasekar, Rocío Chamorro González, Julia A. Belk, Zhonglin Liu, Bruno Melillo, Vineet Bafna, Jan R. Dörr, Benjamin Werner, Weini Huang, Benjamin F. Cravatt, Anton G. Henssen, Paul S. Mischel, Howard Y. Chang. Coordinated inheritance of extrachromosomal DNAs in cancer cells. Nature, 2024, 635(8037): 201-209. DOI: 10.1038/s41586-024-07861-8. Epub 6 November 2024.
Chris Bailey, Oriol Pich, Kerstin Thol, Thomas B. K. Watkins, Jens Luebeck, Andrew Rowan, Georgia Stavrou, Natasha E. Weiser, Bhargavi Dameracharla, Robert Bentham, Wei-Ting Lu, Jeanette Kittel, S. Y. Cindy Yang, Brooke E. Howitt, Natasha Sharma, Maria Litovchenko, Roberto Salgado, King L. Hung, Alex J. Cornish, David A. Moore, Richard S. Houlston, Vineet Bafna, Howard Y. Chang, Serena Nik-Zainal, Nnennaya Kanu, Nicholas McGranahan, Genomics England Consortium, Adrienne M. Flanagan, Paul S. Mischel, Mariam Jamal-Hanjani, Charles Swanton. Origins and impact of extrachromosomal DNA. Nature, 2024, 635(8037): 193–200. DOI: 10.1038/s41586-024-08107-3. Epub 6 November 2024.
Jun Tang, Natasha E. Weiser, Guiping Wang, Sudhir Chowdhry, Ellis J. Curtis, Yanding Zhao, Ivy Tsz-Lo Wong, Georgi K. Marinov, Rui Li, Philip Hanoian, Edison Tse, Salvador Garcia Mojica, Ryan Hansen, Joshua Plum, Auzon Steffy, Snezana Milutinovic, S. Todd Meyer, Jens Luebeck, Yanbo Wang, Shu Zhang, Nicolas Altemose, Christina Curtis, William J. Greenleaf, Vineet Bafna, Stephen J. Benkovic, Anthony B. Pinkerton, Shailaja Kasibhatla, Christian A. Hassig, Paul S. Mischel, Howard Y. Chang. Enhancing transcription–replication conflict targets ecDNA-positive cancers. Nature, 2024, 635(8037): 210-218. DOI: 10.1038/s41586-024-07802-5. Epub 6 November 2024.
霍华德·张说:“正常细胞遵循一些规则。癌症获胜的方式之一是它不按同样的规则行事。我们要做的是找出它的曲目中有哪些额外的动作。”
正常的人类细胞通常将DNA保存在染色体中。但这并不是ecDNA无视规范的唯一方式。霍华德·张和保罗·米歇尔团队的研究,描述了它是如何违背控制遗传的基本原则之一来帮助肿瘤生长并使其更具弹性的。与国际合作者一起,他们展示了ecDNA对癌症的贡献范围,特别是对最致命的病例。该小组还报告了一种针对ecDNA的治疗策略,以战胜含有ecDNA的肿瘤。
这三篇论文都是由保罗·米歇尔领导的eDyNAmiC团队及其国际合作者从各种角度研究ecDNA的成果。通过癌症大挑战,eDyNAmiC团队由英国癌症研究院(Cancer Research UK)和美国国家癌症研究所(US National Cancer Institute)资助,并得到爱默生集团(Emerson Collective)和Kamini与Vindi Banga家族信托基金(The Kamini and Vindi Banga Family Trust)对英国癌症研究院的支持。
一对一(‘Pound for pound’)
就其本身而言,ecDNA并不新鲜。科学家们在20世纪60年代首次报道了它的存在,它是染色体外的DNA小点,其中包含包裹着蛋白质的细胞DNA。直到最近,科学家们才把它当作一种罕见的、可能微不足道的癌症特征,在大约1.4%的肿瘤中发生。
这种看法大约在十年前开始改变,当时保罗·米歇尔和他的团队追踪了肿瘤中经常发现的癌症驱动基因(或致癌基因)的大量拷贝,并将其定位到ecDNA而不是染色体上。
在对癌细胞进行分析后,霍华德·张发现了一个巨大的信号,表明癌细胞的染色质(染色体中的DNA -蛋白质物质)是开放的,因此可以用于基因表达,于是他加入了保罗·米歇尔的研究。他随后认定ecDNA应对此负责。他说,相对于它拥有的每一个基因拷贝,“一对一的ecDNA都能产生更多的基因输出。”
研究人员已经确定,这是ecDNA分子如何导致癌症的核心:它们的DNA被转录或转化为mRNA,这是基因表达的早期步骤,是染色体上相同序列的四倍。
在某种程度上,他们通过合作获得了这种优势。在2021年发表的一项研究——King L Hung, Kathryn E Yost, Liangqi Xie, Quanming Shi, Konstantin Helmsauer, Jens Luebeck, Robert Schöpflin, Joshua T Lange, Rocio Chamorro, Natasha E Weiser, Celine Chen, Maria E Valieva, Ivy Tsz-Lo Wong, Sihan Wu, Siavash R Dehkordi, Connor V Duffy, Katerina Kraft, Jun Tang, Julia A Belk, John C Rose, M Ryan Corces, Jeffrey M Granja, Rui Li, Utkrisht Rajkumar, Jordan Friedlein, Anindya Bagchi, Ansuman T Satpathy, Robert Tjian, Stefan Mundlos, Vineet Bafna, Anton G Henssen, Paul S Mischel, Zhe Liu, Howard Y Chang. ecDNA hubs drive cooperative intermolecular oncogene expression. Nature, 2021, 600(7890): 731–736. DOI: 10.1038/s41586-021-04116-8.霍华德·张与保罗·米歇尔等人合作发现,ecDNA聚集在一起形成中枢(hubs)。当距离很近时,不同的ecDNA分子相互作用,其中一个上的表达增强元件提高了不同ecDNA上致癌基因(oncogenes)的活性。
在正常的继承规则下,这种有毒的协同作用不应该持续下去。然而它确实如此。霍华德·张与保罗·米歇尔团队的新研究表明了这一点。
打破戒律(Breaking the law)
当细胞分裂时,它们复制自己的染色体,然后将其平均分配给后代。根据现代遗传学的基本原理之一孟德尔第三定律(Gregor Mendel’s third law),同一染色体上的基因是一起遗传的,而不同染色体上的基因是相互独立分布的。
霍华德·张说:“生物学中很少有规律,但这是其中之一。”
一开始,研究小组就知道ecDNA的行为不会像染色体那样。这些分子缺少着丝粒(centromeres),而着丝粒是在子细胞中分配染色体的结构。因此,ecDNA的遗传更加混乱也就不足为奇了,甚至包括后代比父母拥有更多致癌基因拷贝的情况。
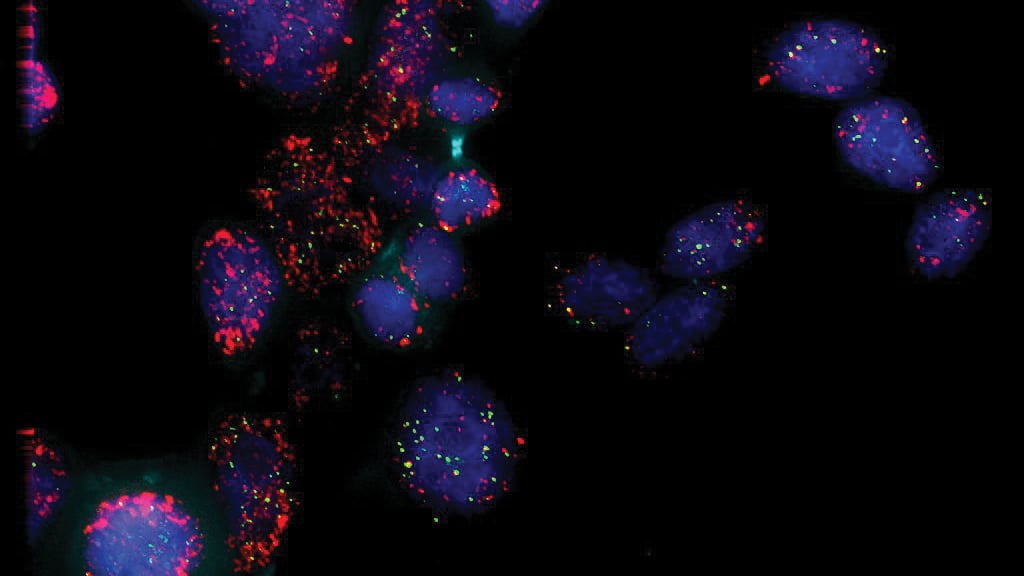
在实验中,霍华德·张和保罗·米歇尔的团队发现了另一种更可预测的动态。通过在癌细胞中标记不同的携带癌基因的ecDNA,然后通过显微镜观察细胞分裂,他们发现后代倾向于同时遗传ecDNA。
霍华德·张说:“当你有两个具有孟德尔遗传类型(Mendelian type of inheritance)的不同DNA分子时,你预计会有很多细胞具有其中一个分子或另一个分子。但我们发现,大多数细胞都有两种ecDNA。所以,如果你有更多的ecDNA味道A(ecDNA flavor A),你也会有更多的味道B(ecDNA flavor B)。”
从某种程度上说,这个结果是有道理的:协同的ecDNA一起帮助癌细胞。通过让它们在一起,下一代就能延续这种益处。问题是这种协调继承违反了孟德尔第三定律。
接下来,霍华德·张与保罗·米歇尔团队开始确定是什么驱动了这种非传统的遗传。从理论上讲,基因A和基因B可以同时出现,因为那些只接受A的基因会面临某种衰弱的劣势,导致它们死亡。然而,计算模型实验支持另一种情况:ecDNA分子以某种方式一起移动。
通过进一步的研究,霍华德·张与保罗·米歇尔团队发现,通过抑制转录,他们可以打破这种动态,使ecDNA分子在子细胞中随机分布。这一发现有直观的意义:作为其增压转录的一部分,ecDNA在增强子和癌基因之间形成物理连接,通过细胞分裂将它们固定在一起。
没有参与ecDNA研究的西班牙纳瓦拉大学应用医学研究中心(Centre for Applied Medical Research at the University of Navarra in Spain)的分子生物学家梅特·瓦尔特(Maite Huarte)说:“癌细胞中的ecDNA分子不是随机遗传的,而是有一种与转录相关的内在特征帮助细胞一起遗传ecDNA,这一想法非常新颖。”
通过打破控制正常细胞和组织的许多规则,肿瘤为自己创造了逃脱免疫系统和逃避治疗的机会。根据梅特·瓦尔特的说法,ecDNA的协调遗传通过增加肿瘤内细胞的多样性来维持这种动态,从而使其在压力下有更多的适应选择。她说:“这是一种加速肿瘤进化的特征,对恶性肿瘤有很大的影响。”
一个棘手的问题(A ‘formidable problem’)
根据2024年11月6日在《自然》(Natrue)杂志网站发表的三篇论文的分析,癌症似乎在远远超过1.4%的肿瘤中利用了这一优势。eDyNAmiC团队成员、伦敦大学学院癌症研究所{University College London (UCL) Cancer Institute}的玛利亚姆·贾马尔-汉佳尼(Mariam Jamal-Hanjani)和弗朗西斯·克里克研究所(Francis Crick Institute)、伦敦大学学院(UCL)的查尔斯·斯旺顿(Charles Swanton)与保罗·米歇尔一起领导了这项工作。
研究小组发现,来自近1.5万名患者的39种肿瘤的全基因组中,ecDNA仅占17%以上。这些圆形分子出现在癌症的所有阶段,从它们出现开始。然而,它们更有可能出现在晚期肿瘤中,包括那些已经转移到体内新部位的肿瘤。同样,研究人员确定,在以前接受过癌症治疗的患者中,以及那些存活时间较短的患者中,这种情况更为普遍。
这项研究还暗示了ecDNA促进癌症的多种方式。除了致癌基因(癌症的面包和黄油),研究人员还在这些分子上发现了其他促进恶性肿瘤的元素。例如,研究小组经常发现ecDNA只携带表达增强元素,而其他的则携带调节免疫系统的基因。
该研究小组写道,ecDNA是一个“可怕的问题”(“formidable problem”),它会导致患者的预后不佳,这与之前的研究(prior research)结果相呼应。
这项研究的合著者保罗·米歇尔说:“显然,癌症的发展有非常不同的途径,这些途径在疾病的生物学方面很重要。当癌症的途径不涉及孟德尔遗传学(Mendelian genetics)时,它改变了游戏规则。”
从有利到不利(From advantage to liability)
了解到目前为止它们的作用后,他和霍华德·张发现了一种方法,可以利用ecDNA的基本优势——增压转录(supercharged transcription)来对抗癌症。他们在第三篇论文中测试了这种方法。
潜在的策略很简单:利用细胞之间的自然冲突来转录和复制它们的DNA。这两个过程的机制都沿着DNA移动;碰撞会导致细胞死亡。
该团队专注于一种名为CHK1的酶,它可以通过控制复制来防止这种致命的冲突。在实验中,他们发现抑制CHK1选择性地破坏了含有ecDNA的癌细胞。然而,当与另一种药物英菲格拉替尼(Infigratinib)联合使用时,CHK1抑制剂是最有效的。这种方法似乎通过抑制肿瘤的生长和防止肿瘤细胞通过其ecDNA获得对药物的耐药性来阻碍肿瘤的发展。
保罗·米歇尔与霍华德·张创办的生物技术公司——无限生物(Boundless Bio),正在开发以ecDNA为靶点的疗法,其中包括一种针对CHK1的疗法。该公司目前正在招募晚期实体瘤患者参加一项临床试验(clinical trial),测试一种不同的CHK1抑制剂与靶向治疗的结合。
未来任重而道远(Much more to do)
eDyNAmiC团队(Team eDyNAmiC)正在进行更多关于ecDNA的研究。另一个更初步的项目正在弗雷德·哈钦森癌症中心(Fred Hutchinson Cancer Center)的团队成员和霍华德·休斯医学研究所(HHMI)研究员哈密特·马利克的实验室(HHMI Investigator Harmit Malik’s lab)进行,博士后格兰特·金(Grant King)正在弗雷德·哈钦森癌症中心研究一种独特的ecDNA,这种ecDNA不是在癌症中发现的,而是在真菌中发现的。
虽然ecDNA不会出现在正常的人类细胞中,但一种叫做两微米质粒(two-micron plasmid)的特殊分子在酵母中很常见。不像含有不同成分的癌症分子,质粒总是编码四种基因,这有助于它的繁殖。至少就科学家所知,它似乎最多只能给酵母提供有限的好处,但不知何故,两者已经建立了长期的关系。
他说:“这种ecDNA已经设法与其宿主共同进化,这样它就能够在数百万年的时间里繁殖自己。”
格兰特·金想要了解酵母细胞是如何与其质粒乘客保持稳定共存的。这项研究可能会揭示出有朝一日可以用来对抗含有ecDNA的癌细胞的脆弱性。
他说,“这种基本的生物学方法有望在酵母之外产生相关的信息。”
美国德克萨斯大学西南医学中心(University of Texas Southwestern Medical Center)的研究员陈志坚{Zhijian (James) Chen音译}和斯坦福大学(Stanford)的研究员米歇尔·蒙耶(Michelle Monje)正在研究这些分子及其在癌症中的作用的相关问题。
作为一名癌症科学家,梅特·瓦尔特对未来充满期待。
她说:“这对我们这些研究人员来说是非常令人兴奋的,因为我们看到我们可以学习的东西还有很多,治疗癌症的新机会也很多。”然而,梅特·瓦尔特指出,最近关于ecDNA的发现也指向了一个令人羞愧的事实。“尽管在过去的几十年里,我们对肿瘤基因组进行了成千上万的研究,但我们仍然有很多不了解之处。”
本研究得到了美国国家癌症研究所(K99 CA286968/CA/NCI NIH HHS/United States;OT2 CA278692/CA/NCI NIH HHS/United States; F99 CA274692/CA/NCI NIH HHS/United States; OT2 CA278644/CA/NCI NIH HHS/United States; U24 CA264379/CA/NCI NIH HHS/United States; OT2 CA278670/CA/NCI NIH HHS/United States; OT2 CA278635/CA/NCI NIH HHS/United States; OT2 CA278688/CA/NCI NIH HHS/United States; R35 CA209919/CA/NCI NIH HHS/United States)、美国国家综合医学研究所(R01 GM114362/GM/NIGMS NIH HHS/United States)以及美国国家心肺血液研究所(T32 HL120824/HL/NHLBI NIH HHS/United States)的资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
Abstract (DOI: 10.1038/s41586-024-07861-8)
The chromosomal theory of inheritance dictates that genes on the same chromosome segregate together while genes on different chromosomes assort independently1. Extrachromosomal DNAs (ecDNAs) are common in cancer and drive oncogene amplification, dysregulated gene expression and intratumoural heterogeneity through random segregation during cell division2,3. Distinct ecDNA sequences, termed ecDNA species, can co-exist to facilitate intermolecular cooperation in cancer cells4. How multiple ecDNA species within a tumour cell are assorted and maintained across somatic cell generations is unclear. Here we show that cooperative ecDNA species are coordinately inherited through mitotic co-segregation. Imaging and single-cell analyses show that multiple ecDNAs encoding distinct oncogenes co-occur and are correlated in copy number in human cancer cells. ecDNA species are coordinately segregated asymmetrically during mitosis, resulting in daughter cells with simultaneous copy-number gains in multiple ecDNA species before any selection. Intermolecular proximity and active transcription at the start of mitosis facilitate the coordinated segregation of ecDNA species, and transcription inhibition reduces co-segregation. Computational modelling reveals the quantitative principles of ecDNA co-segregation and co-selection, predicting their observed distributions in cancer cells. Coordinated inheritance of ecDNAs enables co-amplification of specialized ecDNAs containing only enhancer elements and guides therapeutic strategies to jointly deplete cooperating ecDNA oncogenes. Coordinated inheritance of ecDNAs confers stability to oncogene cooperation and novel gene regulatory circuits, allowing winning combinations of epigenetic states to be transmitted across cell generations.
Abstract(DOI: 10.1038/s41586-024-08107-3)
Extrachromosomal DNA (ecDNA) is a major contributor to treatment resistance and poor outcome for patients with cancer1,2. Here we examine the diversity of ecDNA elements across cancer, revealing the associated tissue, genetic and mutational contexts. By analysing data from 14,778 patients with 39 tumour types from the 100,000 Genomes Project, we demonstrate that 17.1% of tumour samples contain ecDNA. We reveal a pattern highly indicative of tissue-context-based selection for ecDNAs, linking their genomic content to their tissue of origin. We show that not only is ecDNA a mechanism for amplification of driver oncogenes, but it also a mechanism that frequently amplifies immunomodulatory and inflammatory genes, such as those that modulate lymphocyte-mediated immunity and immune effector processes. Moreover, ecDNAs carrying immunomodulatory genes are associated with reduced tumour T cell infiltration. We identify ecDNAs bearing only enhancers, promoters and lncRNA elements, suggesting the combinatorial power of interactions between ecDNAs in trans. We also identify intrinsic and environmental mutational processes linked to ecDNA, including those linked to its formation, such as tobacco exposure, and progression, such as homologous recombination repair deficiency. Clinically, ecDNA detection was associated with tumour stage, more prevalent after targeted therapy and cytotoxic treatments, and associated with metastases and shorter overall survival. These results shed light on why ecDNA is a substantial clinical problem that can cooperatively drive tumour growth signals, alter transcriptional landscapes and suppress the immune system.
Abstract (DOI: 10.1038/s41586-024-07802-5)
Extrachromosomal DNA (ecDNA) presents a major challenge for cancer patients. ecDNA renders tumours treatment resistant by facilitating massive oncogene transcription and rapid genome evolution, contributing to poor patient survival1-7. At present, there are no ecDNA-specific treatments. Here we show that enhancing transcription-replication conflict enables targeted elimination of ecDNA-containing cancers. Stepwise analyses of ecDNA transcription reveal pervasive RNA transcription and associated single-stranded DNA, leading to excessive transcription-replication conflicts and replication stress compared with chromosomal loci. Nucleotide incorporation on ecDNA is markedly slower, and replication stress is significantly higher in ecDNA-containing tumours regardless of cancer type or oncogene cargo. pRPA2-S33, a mediator of DNA damage repair that binds single-stranded DNA, shows elevated localization on ecDNA in a transcription-dependent manner, along with increased DNA double strand breaks, and activation of the S-phase checkpoint kinase, CHK1. Genetic or pharmacological CHK1 inhibition causes extensive and preferential tumour cell death in ecDNA-containing tumours. We advance a highly selective, potent and bioavailable oral CHK1 inhibitor, BBI-2779, that preferentially kills ecDNA-containing tumour cells. In a gastric cancer model containing FGFR2 amplified on ecDNA, BBI-2779 suppresses tumour growth and prevents ecDNA-mediated acquired resistance to the pan-FGFR inhibitor infigratinib, resulting in potent and sustained tumour regression in mice. Transcription-replication conflict emerges as a target for ecDNA-directed therapy, exploiting a synthetic lethality of excess to treat cancer.
转载本文请联系原作者获取授权,同时请注明本文来自诸平科学网博客。
链接地址:https://wap.sciencenet.cn/blog-212210-1460916.html?mobile=1
收藏