
抗生素可有效治疗细菌感染,但其广泛使用引发了抗生素耐药性,抗生素耐药性是个全球性的大问题,这与人类疾病密切相关。这里存在着一个被我们长期忽视的关键因素:肠道耐药组。
当我们在医学上使用抗生素时,肠道里的微生物数量和基因组成可能会发生变化,这样就增加了抗生素耐药性在肠道中积累的风险。
肠道耐药组(gut resistome)是指肠道微生物群中存在的所有抗生素耐药基因(ARG)的集合,可以从自然环境和食物摄入中获得,并且可以随着食物中抗生素和其他抗菌物质诱导的选择压力进一步积累。
这些耐药基因不只是让细菌对抗生素产生抵抗力,更可能通过影响肠道微生物平衡、改变代谢功能、触发炎症反应,与多种慢性疾病建立起令人担忧的联系,包括代谢紊乱、心血管疾病、肝病、神经系统疾病等。
当我们服用口服抗生素时,药物直接穿过消化系统,破坏肠道微生物的平衡,促进抗生素耐药基因的出现和扩散。更令人忧虑的是,这些耐药基因可以通过食物链、水源和环境污染从自然环境进入人体,并在肠道微生物间通过水平基因转移快速传播。
肠道耐药组的富集不仅加剧了抗生素耐药性,还导致了多重耐药性感染的出现。这些感染构成了重大的公共卫生挑战,因为它们更难治疗,通常需要更昂贵的疗法,这些疗法可能具有更大的副作用且效果较差。
肠道耐药组已成为连接抗生素使用、耐药危机和慢性疾病的关键环节。
已知膳食成分会影响肠道微生物组的发生率、活性和多样性,例如,研究表明,地中海饮食(大量摄入完整的、未加工的植物性食物、橄榄油和乳制品;适量的家禽和鱼类;以及最少食用红肉)与粪杆菌属和短链脂肪酸的增加有关,它们具有抗炎作用。相比之下,西方饮食(高热量,富含动物蛋白、饱和脂肪、单糖和超加工食品,而纤维、水果和蔬菜含量低)与 Blautia、拟杆菌属、瘤胃球菌属物种的丰度较高有关,这与代谢紊乱和慢性炎症的风险增加有关。
在此基础上,饮食不仅会影响有益细菌,而且还有可能改变肠道中抗生素耐药细菌的存在。到目前为止,已发现食品中的生物活性常量营养素、植物化学物质和益生菌可以改变肠道中的抗生素耐药细菌,为调节肠道耐药组的功能性食品打开了新的研究窗口。
随着科学进步,肠道菌群检测技术已能够识别耐药基因的存在和丰度,使个体ARG状况的评估成为可能,为个性化的肠道耐药组管理提供客观依据。
本文强调了肠道耐药组与人类疾病(如代谢紊乱、心血管疾病、肝病和神经系统疾病)之间的联系,包括抗生素作用机制和耐药性的发展,还讨论了饮食习惯和饮食成分(包括生物活性宏量营养素、植物化学物质和益生菌)通过增强抗生素疗效和潜在降低耐药性,对肠道抗药组的组成产生影响。
强调了对靶向肠道耐药组的功能性食品的新兴趋势,以及越来越关注具有调节抗生素耐药性潜力的生物活性植物化学物质。
靶向肠道耐药组的功能性食品,正从概念走向临床,未来,通过“膳食-菌群-肠道耐药组”三位一体的精准干预,有望将耐药危机防控窗口前移至日常饮食,从功能性食品的创新到临床营养的精准化应用,为全球公共卫生提供可持续解决方案。
01肠道耐药组对人体健康的影响★
随着抗生素在现代医学和农业中的广泛应用,一个隐形的健康危机正在悄然形成——肠道抗生素耐药基因组(ARG)的扩张。
ARG 可以从亲本细菌(垂直基因转移)遗传,也可以通过水平基因转移从其他微生物获得,水平基因转移是遗传物质在细菌之间移动的过程,甚至跨物种移动。
这些耐药基因不仅可以使细菌对抗生素产生抵抗力,更可能通过影响肠道微生物平衡、改变代谢功能、触发炎症反应,与多种慢性疾病建立起令人担忧的联系。
给药方法会显著影响肠道微生物组和耐药组
静脉注射(注射到血液中)或局部(直接涂抹在皮肤上)的抗生素通常与肠道微生物组的直接接触最少,因此对肠道耐药组的影响较小。
然而,口服抗生素是最常见的治疗形式,它通过消化系统,直接影响肠道微生物群。这种相互作用会破坏肠道微生物的平衡,并促进抗生素耐药基因(ARG)的出现。
Zhang等人强调了这一差异,表明小鼠口服四环素或阿莫西林会迅速增加肠道中ARG的存在,而静脉注射则会延迟或减少这种作用。这种差异与药物的排泄途径有关:氨苄西林主要通过肾脏排泄,限制了静脉注射后的肠道暴露,而四环素通过肾脏和胆汁排出,即使在静脉注射后也会暴露肠道。这些发现强调了口服抗生素在塑造肠道抗药性中的重要作用。
此外,抗生素的广泛使用,无论是直接在人类身上还是间接在动物身上,都会导致抗生素耐药性在自然环境和生物中的积累,从而促进人类肠道耐药性的扩大。
严重的健康问题与肠道耐药组有关,包括代谢紊乱、心血管疾病、肝病、神经系统疾病(下图)。
肠道耐药组对人体健康的影响

doi:10.1111/1541-4337.70143
a) 肠道微生物群在健康和疾病中的机制。短链脂肪酸(SCFA)来源于膳食游离脂肪酸受体(FFAR2/3),通过释放肽YY(PYY)和胰高血糖素样肽1(GLP-1)等肠道激素来促进饱腹感,同时增强胰岛素分泌和敏感性,导致肥胖和2型糖尿病(T2D)。来自革兰氏阴性菌的脂多糖(LPSs)通过激活巨噬细胞和释放促炎细胞因子(TNF-α、IL-1β、IL-6)触发全身炎症,导致肥胖、2型糖尿病、炎症性肠病(IBD)、癌症(CRC)、心血管疾病和肝脏疾病。次生胆汁酸、三甲胺-N-氧化物(TMAO)、硫化氢(H2S)和含氮有机化合物(NOC)会导致胆汁酸信号失调、氧化应激和DNA损伤,从而导致CRC等慢性疾病。此外,肠道和中枢神经系统(通过迷走神经)以及肠道衍生代谢物(如三甲胺(TMA)和TMAO)之间的相互作用会影响神经和心血管健康。
下面我们来看具体与肠道耐药组相关的疾病。
▼代谢紊乱抗生素耐药性通过破坏肠道微生物群及其相关代谢途径,在包括肥胖、2型糖尿病(T2D)、炎症性肠病(IBD)和结直肠癌(CRC) 在内的代谢紊乱中发挥着至关重要的作用。肠道耐药组是肠道微生物组的一部分,也与这些疾病的发展有关。

doi:10.1111/1541-4337.70143
b) 抗生素抗性基因对疾病的影响。特定的抗生素抗性基因(ARG)与代谢紊乱、神经系统疾病和肝病有关。ARGα多样性与心脏代谢风险增加有关。
肥胖
在肥胖人群中,肠道生态失调通过改变短链脂肪酸和脂多糖(LPS)影响能量代谢和慢性炎症(图a)。短链脂肪酸通过刺激GLP-1和PYY等激素的释放来调节饱腹感,这些激素作用于下丘脑。此外,肠道细菌的不平衡,特别是革兰氏阴性菌如变形杆菌的丰度增加,会导致LPS水平升高,并通过增加促炎细胞因子(TNF-α、IL-1β、IL-6)的产生引发全身炎症。
一项研究中,与富营养化参与者相比,肥胖个体中梭杆菌、肠球菌、大肠杆菌的丰度更高,同时ARG水平升高,如tet(M)(四环素类)、blaZ(β-内酰胺类)、ereA和vgb(大环内酯类、林可酰胺类、链菌素组[MLS])。这表明ARG与革兰氏阴性菌之间的关系,是由拟杆菌门和变形杆菌门之间的不平衡所驱动的。

doi: 10.3390/genes10050349
2型糖尿病
在2型糖尿病中,肠道微生物失调,包括抵抗体的变化,导致SCFA产生减少,损害PYY和GLP-1的分泌,这对胰岛素调节和胰高血糖素水平至关重要(图a)。
胆汁酸代谢的改变刺激成纤维细胞生长因子19/15(FGF19/15)的释放,进一步促进胰岛素敏感性和葡萄糖耐量。
ARG丰度的增加,包括Vancomycin_vanX、Multidrug_emrE、MLS_ermX、喹诺酮_norB,与2型糖尿病风险的增加有关,耐药组的变化发生在肠道微生物群变化之前(图b)。
▼炎症性肠病在IBD中,能够产生短链脂肪酸的细菌数量减少,这会削弱短链脂肪酸的抗炎作用。短链脂肪酸通常有助于Treg和效应性T细胞(Teff)的分化。由于这种减少,炎症和肠道上皮细胞损伤会加剧,从而为有害细菌的滋生创造条件,并导致慢性炎症的持续。大肠杆菌中携带的抗生素抗性基因,如mdtO、mdtP、emrK、mdtN、mdtF、mdtD、ompF,变得更加普遍。这些ARGs通过破坏肠道屏障功能,增加肠道的通透性,进而促进炎症反应(如图b所示)。
此外,ARGs和细菌的毒力因子可以通过水平基因转移在微生物群落中传播,进一步加重IBD中的炎症状况。
▼结直肠癌在结直肠癌中,肠道菌群失衡会通过减少粘液层厚度和增加肠道通透性来促进癌症的发生和发展(图a)。
有害细菌过度生长会导致脂多糖(LPS)和其他有毒代谢物的释放,比如次生胆汁酸、三甲胺-N-氧化物(TMAO)、硫化氢(H₂S)和含氮有机化合物,这些物质会引发低度炎症并激活致癌信号。

上述研究发现,结直肠癌患者体内大肠杆菌、柠檬酸杆菌、不动杆菌水平升高,同时存在耐药基因如mdtP、mdtO、GadW、GadX、AcrA(多药耐药)、ErmB(喹诺酮类耐药)和AAC(3)‐IIa(3′-氨基糖苷类耐药)等耐药基因水平升高(图b)。这些抗生素抗性基因通过加剧肠道菌群失衡、炎症反应和肠道屏障功能障碍,进一步推动CRC的发展,突出了肠道耐药组在代谢性疾病发病机制中的作用。
总体而言,新出现的证据表明,肠道耐药组不仅反映了微生物失衡,而且通过抗生素耐药性的传播积极推动代谢紊乱。ARG在肠道微生物群中的存在和传播会破坏关键的生理过程,如能量代谢、免疫调节和肠道屏障的完整性。通过营造一个有利于致病菌及其毒力因子的环境,耐药组会放大炎症,改变代谢信号通路,并促进生态失调。
▼心血管疾病肠道微生物组通过炎症反应和TMAO代谢机制参与心血管疾病的发病机制,包括心力衰竭和冠状动脉疾病(图a)。
心血管疾病患者体内产丁酸菌减少,这会引发局部炎症,加剧肠道菌群失衡,并导致肠道屏障功能受损。这些患者体内TMAO水平的升高,会干扰胆固醇运输、促进泡沫细胞形成和诱导血小板聚集,从而可能导致急性冠状动脉综合征,引发动脉粥样硬化的发展。
此外,较高的肠道抗生素抗性基因α多样性与心脏代谢风险增加有关。
一项研究发现,较高的肠道ARGα多样性指数与甘油三酯和总胆固醇/高密度脂蛋白胆固醇比值(TC/HDL)呈正相关,但与高密度脂蛋白胆固醇(HDL)水平呈负相关。
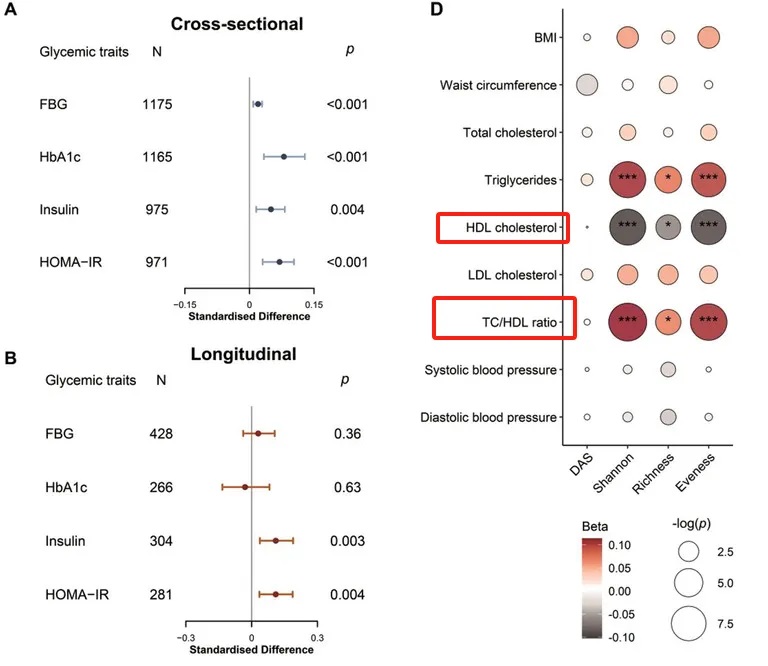
doi: 10.1002/advs.202104965
这表明ARG在扰乱脂质和葡萄糖代谢方面发挥作用,并可能通过血脂异常和胰岛素抵抗增加心血管疾病的风险。
▼肝 病肠道微生物群通过引发炎症反应,显著影响肝脏的正常功能(图a)。
当肠道微生物组因抗生素耐药性发生变化时,肠道的通透性会增加,使细菌及其产物(如脂多糖LPS)能够通过肝肠循环进入肝脏。LPS进入肝脏后,会引发急性炎症反应,导致肝细胞受损,进而可能引发多种肝脏疾病,如非酒精性脂肪肝、脂肪性肝炎、酒精性肝病、肝癌,甚至肝性脑病。
肠道耐药组的变化与肝脏疾病的发生密切相关。研究发现,肝硬化患者的肠道耐药组中,与肠杆菌科、链球菌、肠球菌和不动杆菌属等病原菌相关的耐药基因丰度更高。
此外,这些患者还表现出对β-内酰胺酶、大环内酯类、喹诺酮类、糖肽类、磷霉素、四环素类抗生素的更大耐药性。肝性脑病患者则表现出更高水平的氨基香豆素耐药基因parY和林可酰胺耐药基因(ileS和RpoB)。这些抗性组的变化会破坏肠道与肝脏之间的正常相互作用,以及胃肠道的免疫反应,随着疾病的进展,这种破坏会进一步恶化。
▼神经系统疾病肠道微生物组在通过肠道-大脑轴塑造神经系统的发育和功能方面起着关键作用。迷走神经传递神经元、内分泌和免疫信号,而下丘脑通过释放促肾上腺皮质激素释放激素(CRH)来调节应激反应,导致皮质醇的产生,从而影响肠道的上皮屏障和免疫系统。
肠道耐药组的改变也与神经发育障碍有关。
一项研究发现,患有自闭症的儿童具有更高丰度的屎肠球菌aac(6′)-aph(2′)基因、Megasphaera elsdenii 的cepA‐49和tet(40)基因以及脆弱拟杆菌的cepA-49基因。

研究还发现,健康个体和自闭症患者在对大环内酯类抗生素耐药性的基因方面存在显著差异,包括肠球菌和未培养细菌的氨基糖苷类耐药基因、拟杆菌属和Acidaminococcus的β-内酰胺抗性基因,以及来自Megasphaera和Alistipes的四环素抗性基因。因此,肠道微生物群平衡和抗性基因的破坏可能会降低神经代谢潜力,影响大脑功能所需的神经递质和代谢物的产生。
通常用抗生素治疗的疾病与扩大的肠道耐药性有关,这表明曾经有接触抗生素史对疾病相关菌株的ARG获得产生了相当大的选择压力。
未来的研究需要更好地了解肠道耐药性与疾病之间的相互作用及其机制。将多基因风险评分与肠道宏基因组风险模型相结合可以提高对常见慢性病的预测能力,为疾病预测和预防提供更全面的方法。
通过上述研究,我们看到肠道耐药组对人体健康的多层面影响,是如何超越简单的感染问题而演变成一个系统性的健康风险。然而,要有效应对这一挑战,我们需要深入了解:这些耐药基因是如何产生的?它们又是如何从环境进入人体并在肠道微生物间传播的?...
02抗生素耐药性的发生和传播★
抗生素耐药性并非凭空出现,而是有其明确的生物学机制和传播途径,下面章节我们来详细了解这一过程中的关键环节,包括垂直遗传、水平基因转移等核心机制,以及食物链、水源和环境污染在耐药基因传播中的角色。
在这里重点介绍针对细菌的抗生素,介绍它们的作用机制,并讨论抗生素耐药性如何在肠道中发展和积累。
▼抗生素是如何控制细菌的?将治疗细菌性疾病的抗生素引入临床应用是 20 世纪最大的医学突破。抗生素的抗菌机制可细分为五类:
抑制细菌细胞壁生物合成
干扰代谢途径
破坏核酸合成
抑制蛋白质合成
细胞膜去极化
抗生素作用机制和抗生素耐药性
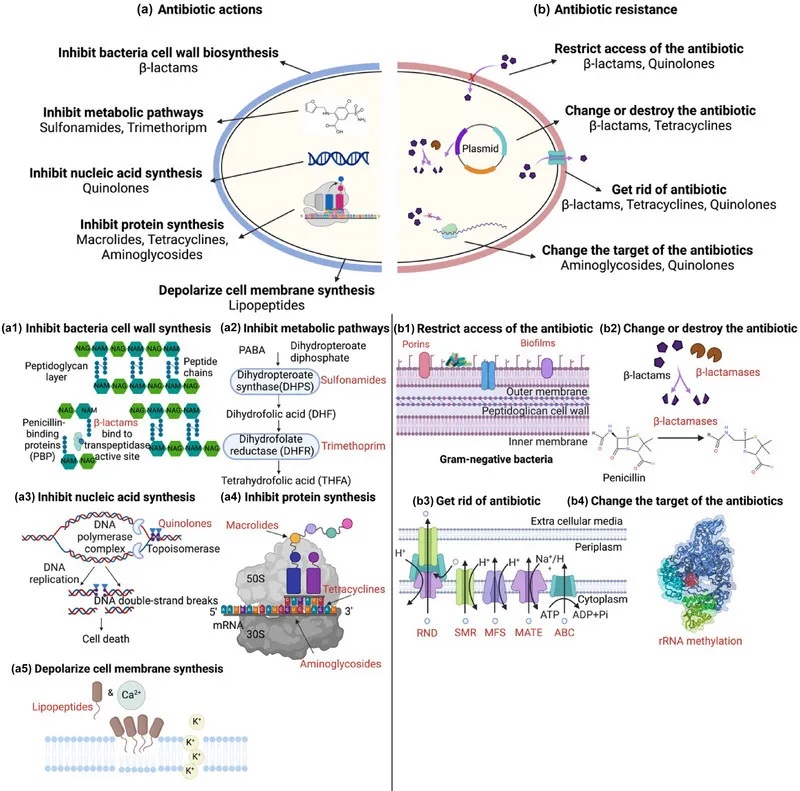
doi:10.1111/1541-4337.70143
a)抗生素作用:抗生素针对关键的细菌过程来抑制生长和存活。
b)抗生素耐药性:细菌通过各种策略产生耐药性。
下面我们先来看一下抗生素的作用。
阻碍细菌细胞壁的合成——结构性破坏
β-内酰胺类抗生素,可以伪装成细菌细胞壁合成所需的关键分子。这类抗生素会:
• 模仿细菌细胞壁合成的天然底物(d-丙氨酸)
• 结构相似性使抗生素能够与DD转肽酶结合(d-丙氨酸是DD转肽酶的底物),防止DD转肽酶与其天然底物进一步结合
• 破坏肽聚糖层的交联,肽聚糖框架减弱
• 最终导致细胞壁结构损坏,细胞死亡
典型的β-内酰胺类抗生素包括:青霉素类、头孢菌素类、碳青霉烯类、单巴坦类。
抑制细菌代谢途径——叶酸合成阻断
磺胺类药物抑制二氢蝶酸酯合酶,这是叶酸生产中必不可少的酶。这种抑制阻断了DNA和RNA生产所必需的核苷酸的合成,阻止了细菌复制并导致细胞死亡。
最常用的磺胺类抗生素:磺胺甲氧基嘧啶、磺胺二甲嘧啶、磺胺甲恶唑、磺胺嘧啶。
协同用药:甲氧苄啶(靶向二氢叶酸还原酶,DHFR)与磺胺类联用,双重阻断叶酸代谢链。
抑制核酸生物合成所需的细菌RNA聚合酶
RNA聚合酶抑制
作用靶点:细菌RNA聚合酶β亚基
机制:阻断转录起始→抑制mRNA合成→细胞分裂停滞
代表药物:利福霉素类(如利福平)
DNA拓扑异构酶抑制
作用靶点:DNA旋转酶(拓扑异构酶II/IV)
机制:
与 DNA 和旋转酶结合→阻止DNA超螺旋/松弛
捕获DNA上的拓扑异构酶→抑制核酸合成→DNA双链断裂→抑制细菌的生长
代表药物:喹诺酮类(诺氟沙星、环丙沙星、氧氟沙星)
阻断蛋白质合成
大环内酯类(红霉素、克拉霉素、阿奇霉素)
与50S核糖体亚基上的23S rRNA产生的结合肽基转移酶中心结合→抑制核糖体沿mRNA的运动→多肽链延伸终止→细菌蛋白质合成的抑制→细菌细胞死亡
四环素类(四环素、土霉素、多西环素)
靶点:与30S核糖体亚基结合
阻断氨酰-tRNA与A位点结合→抑制氨基酸掺入生长的多肽链
氨基糖苷类(卡那霉素、链霉素、庆大霉素)
靶点:30S核糖体16S rRNA上的 A位点
诱导mRNA误读→多肽链提前终止→破坏蛋白质合成完整性→细胞死亡
破坏细胞膜完整性
脂肽类抗生素(达托霉素)
结构特征:含脂尾的肽核
钙离子依赖型寡聚→达托霉素分子嵌入细胞膜形成孔道→膜电位去极化→胞内成分泄漏→细胞裂解
不同种类抗生素作用的方式

Uddin TM, et al., J Infect Public Health. 2021
▼抗生素耐药的机制细菌抗生素耐药性是微生物数千年进化的自然现象。这种固有的抗生素耐药性也被称为固有耐药性。
除了固有耐药性外,过度使用抗生素还会导致抗生素耐药性的积累。细菌采用各种策略来抵抗抗生素,例如减少抗生素的摄取,修饰或灭活抗生素,主动将其从细胞中排出,或改变抗生素的靶标以阻止其作用。

doi.org/10.1016/j.glmedi.2024.100081
细菌耐药核心机制如下:
1. 细菌改变外膜疏水性、孔蛋白突变或形成生物膜,阻止抗生素渗透,导致耐药性
革兰氏阴性菌有一层外膜,可以作为屏障,阻止抗生素(β-内酰胺类、喹诺酮类)进入细胞。大多数抗生素需要穿透外脂膜才能到达目标。疏水性药物如大环内酯类(红霉素)可以通过扩散穿过膜,而亲水性抗生素如β-内酰胺类需要通过孔蛋白(图b1)。
外膜的变化,如疏水性的改变或孔蛋白的突变,可能导致革兰氏阴性菌产生抗生素耐药性。一些细菌可以产生大量的细胞外聚合物,包括胞外多糖、蛋白质、细胞外DNA和脂质。这些物质可以在生物膜内的细菌细胞周围形成物理屏障,防止抗生素直接到达细菌细胞。这减少了抗生素的直接暴露,导致抗生素疗效明显降低。
例如,金黄色葡萄球菌菌株产生的生物膜可以显著降低苯唑西林、万古霉素和头孢噻肟的渗透性。
2. 细菌产生分解抗生素分子的酶,对抗生素修饰或降解,使其无效
β-内酰胺酶
细菌产生β内酰胺酶来降解β内酰胺类,这些酶通过不可逆地打开β-内酰胺环使其失活,从而使其无法与青霉素结合蛋白结合,使其无效。
氨基糖苷修饰酶
如AAC(3)乙酰转移酶修饰庆大霉素,降低其与核糖体结合能力,从而降低其疗效。
3. 细菌外排泵,以能量依赖性方式从细菌细胞中去除抗生素,使细菌在高浓度抗生素中存活
细菌药物外排泵可分为五个家族——ABC、SMR、MATE、MFS、RND。
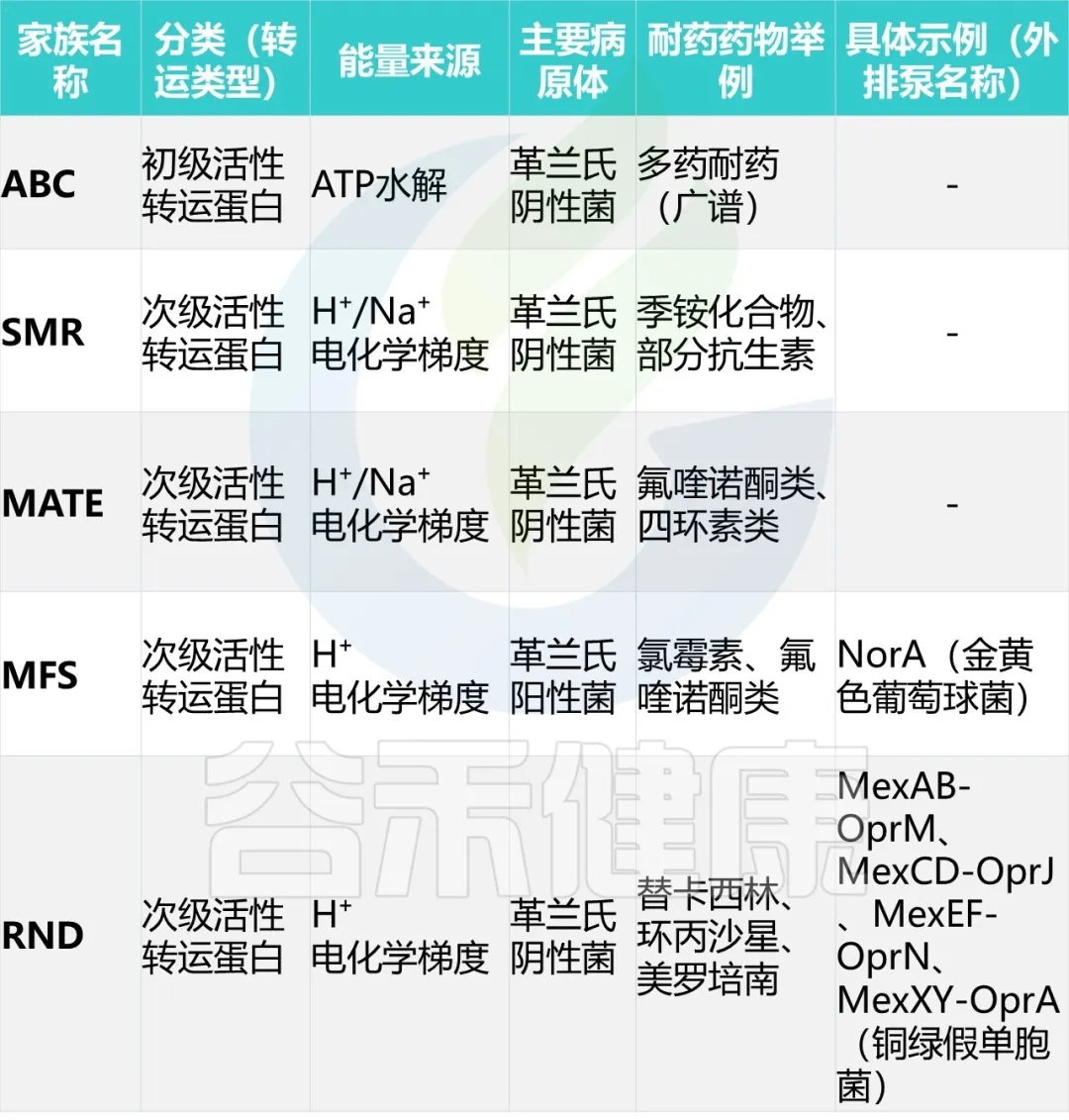
4. 改变抗生素的靶点结合位点,降低结合效率
16S rRNA甲基转移酶改变氨基糖苷类核糖体结合位点的构象,从而降低氨基糖苷类对核糖体的亲和力,使抗生素更难有效结合。
氨基糖苷修饰酶可分为两类,甲基化G1405和A1408。
G1405甲基化:改变了核糖体RNA在这些4,6-二取代2-脱氧链霉素(DOS)氨基糖苷类关键结合位点的结构,如卡那霉素、庆大霉素、妥布霉素、阿米卡星。
A1408甲基化(NpmA酶):可对4,5和4,6二取代的2-DOS氨基糖苷类产生耐药性。
随着分子技术的进步,了解抗生素耐药性背后的机制变得越来越复杂。其中,基因测序已成为一种强大的工具,能够根据遗传数据预测抗性表型。这允许更精确地跟踪耐药性演变,并为有针对性的干预措施提供信息,以防止耐药菌株的传播。
此外,细菌采用多种策略来确保其存活,即使是少量耐药菌株也可能在胃肠道的复杂微生物环境中持续存在,从而导致耐药细菌种群的选择和存活。
了解分子耐药机制对于减轻抗生素耐药性和揭示人体肠道中耐药性积累的动态是必要的。
▼抗生素耐药性在肠道中的传播和积累抗生素耐药性发生在自然环境,如土壤、水生态系统、动物粪便,在社区环境中也有,如医院污水、农业实践中。当人类食用食物中的抗生素耐药细菌时,抗生素耐药性可以通过食物链从自然环境传播给人类,比如,通过受污染的食物和直接的公共接触传播给人类。
环境中抗生素耐药性的累积
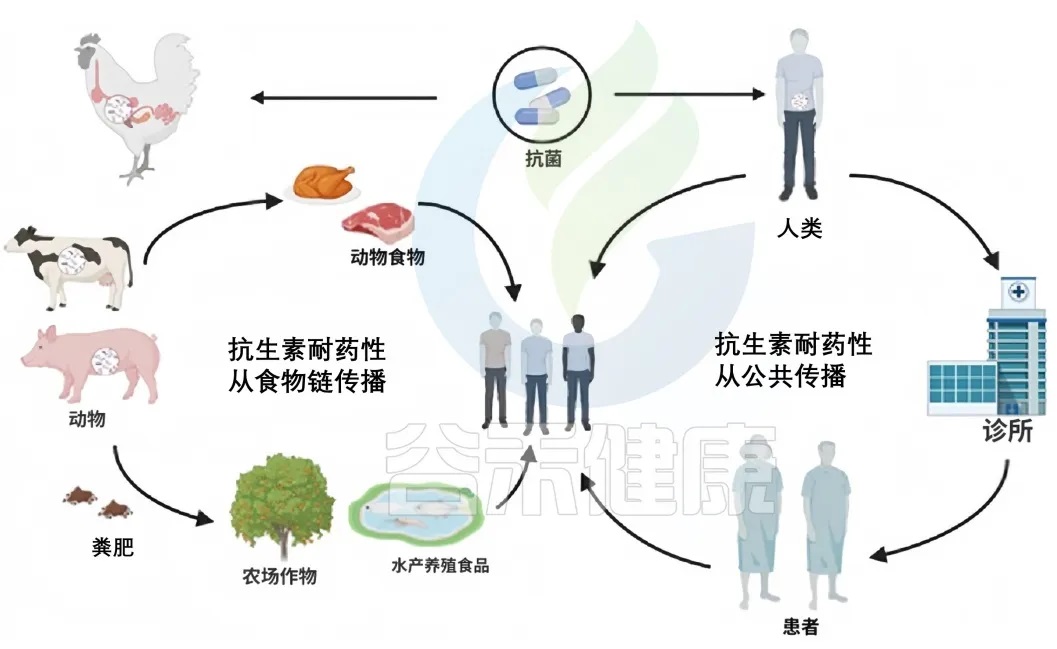
doi:10.1111/1541-4337.70143
在自然环境中,不同的生物和基质(如动物、土壤和水)之间存在联系。这种相互联系促进了抗生素耐药性在各种环境因素中的传播。土壤、水和沙子是抗性细菌和遗传元素可以持续存在并相互作用的水库。
整个自然界就像一张巨大的“互联网络”——动物、土壤、水甚至沙子之间都有看不见的“网线”连接。这些“网线”让抗药细菌和它们的耐药基因能在环境中四处“串门”。
抗生素耐药性从环境传播到植物、动物和昆虫涉及多种机制。农业实践,包括在畜牧业中使用抗生素和将处理过的动物粪便施用到田地里,将抗性基因引入土壤。水源可能通过农田径流,特别是那些用牲畜粪便施肥的农田径流,被抗生素抗性细菌和遗传元素污染。水生生态系统中的昆虫和其他生物可以成为抗性基因的载体,进一步在环境中传播抗生素抗性。
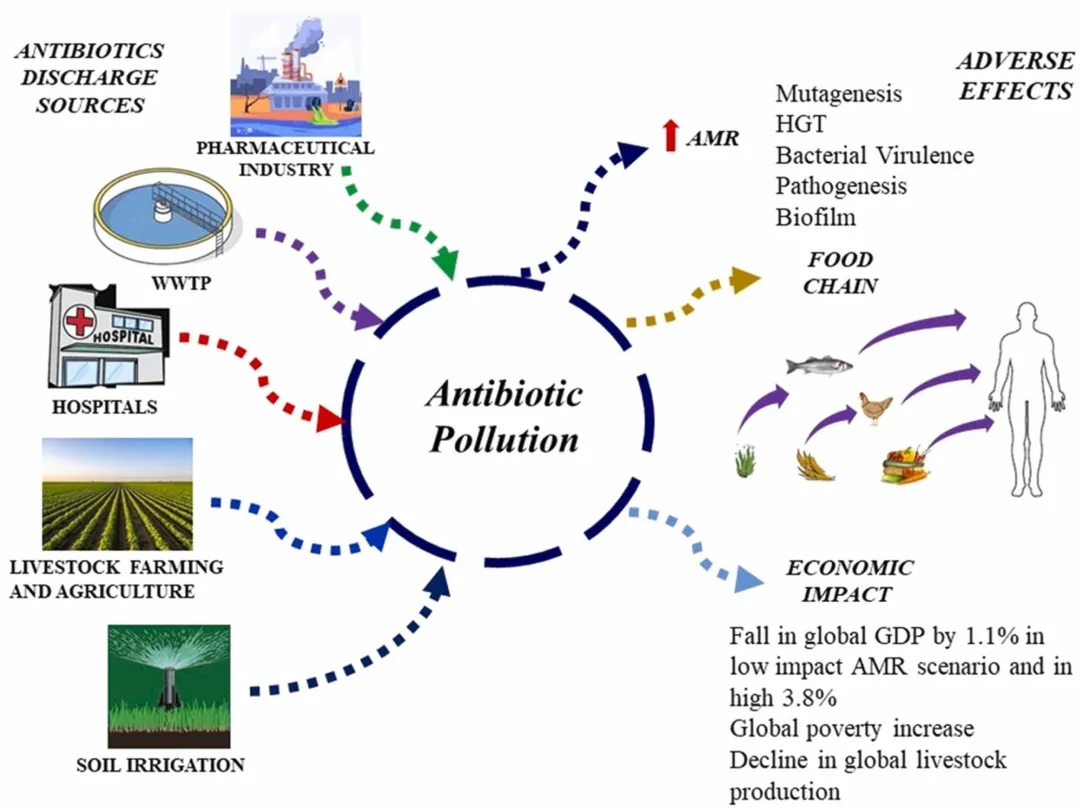
doi.org/10.1016/j.hazl.2024.100105
人类活动对抗生素排放到环境中起着重要作用。这通过多种途径发生,包括城市和医院废物、工业制造、农业径流和垃圾填埋场渗滤液。因此,抗生素耐药性可能通过各种途径进入人体肠道。人类可能通过受污染的食物、水和与环境的直接接触(如家庭、社区或医疗保健互动)接触到抗生素抗性细菌和遗传因素。
宠物狗和猫可携带多种多重耐药细菌,包括耐甲氧西林金黄色葡萄球菌和耐β-内酰胺类抗生素的肠杆菌科细菌。
这些耐抗生素微生物可能通过直接接触、体外寄生虫和气溶胶从宠物传给人类。特别是弱势群体,包括免疫功能低下的老年人和婴儿,可能面临更大的风险。
详见我们之前的文章:宠物猫可能塑造人类肠道中的抗生素耐药性和益生菌
ARG在自然环境、动物和人类中的发生、积累和传播依赖于垂直遗传和水平基因转移(下图)。在细菌的生长和繁殖过程中,基因突变使它们对特定抗生素产生耐药性,它们的后代将继承突变基因(下图a)。携带突变基因的细菌,更有可能存活,并且可以世代垂直传播。随着时间的推移,细菌种群将由具有耐药基因的细菌主导,这种选择性优势使耐药细菌得以增殖,有助于抗生素耐药性的扩大。
ARG具有高流动性,可以通过水平基因转移传播,包括四种机制:基因转化、基因转导、基因接合、膜囊泡融合(下图b)。
通过垂直遗传、水平基因转移以及影响这些机制的因素在肠道中积累抗生素耐药性

doi:10.1111/1541-4337.70143
a) 垂直遗传:抗生素耐药性可以通过基因突变和耐药体扩增进行垂直遗传。
b) 水平基因转移及其影响因素:
水平基因转移发生在四种途径中:
基因转化,供体细菌的游离DNA片段被受体细菌吸收,受孔蛋白翻译、细胞膜损伤、基因表达、DNA损伤和活性氧(ROS)产生等因素的影响;
基因转导,涉及通过温和噬菌体转移DNA,受菌毛形成、噬菌体吸收、膜通透性、基因表达和ROS产生的影响;
基因接合,遗传物质通过连接供体和受体细菌的菌毛转移,受菌毛形成、膜通透性、SOS反应、基因表达和ROS产生的影响;
膜囊泡融合,其中供体细胞的囊泡通过与受体细胞的膜融合将抗生素抗性基因(ARG)运输到受体细胞的细胞质中,这是由膜囊泡分泌、膜通透性、靶蛋白融合和ROS产生驱动的。
抗生素可以影响细菌中的水平基因转移,特别是在ARG的情况下。它们创造了一个有利于携带抗性基因的细菌存活和增殖的选择性环境。除了抗生素选择压力外,各种非抗生素因素,包括抗菌剂和环境条件,都会影响ARG的水平转移。
在大多数细菌中,获取抗性基因的主要和最有效的方法涉及使用可移动的遗传元件,如质粒作为基因交换的载体。在多种细菌中观察到水平基因转移,如大肠杆菌和肺炎克雷伯氏菌,使耐药基因能够在细菌种群中快速有效地传播。一般来说,ARG的水平转移会加剧肠道中抗生素耐药性的传播。
总体而言,垂直遗传和水平基因转移是导致ARG在自然环境、农场动物和最终人类肠道中发生和传播的两条主要途径。值得注意的是,ARGs的水平基因转移是决定其传播的关键因素。
饮食干预在抑制ARGs的水平基因转移中起着重要作用。已经发现,一些膳食植物化学物质,如酚类化合物、硫化物、萜类化合物、生物碱,有可能诱导ROS的产生,导致细菌细胞膜不可逆的损伤,生物膜活性降低,毒力基因表达下调,从而抑制水平基因转移。下面章节将进一步讨论食物成分在控制ARG中的作用。
03通过饮食成分改变肠道耐药组★
通过饮食成分改变肠道耐药性是一个新兴的研究领域,人们越来越关注食物选择如何影响肠道中的抗生素抗性细菌。例如,发酵食品中含有大量微生物,乳酸菌和凝固酶阴性葡萄球菌被确定为四环素、青霉素、氯霉素和大环内酯类ARG的携带者。这表明食用发酵食品可能会直接影响肠道耐药性。
食品中存在的许多天然分子,如酚类、萜类和酚酰胺,具有抗菌能力,能够调节肠道微生物群。然而,关于食物成分对肠道抗生素耐药细菌影响的研究有限,这是一个新兴的研究领域。
这里总结了对大量人群的营养研究,以了解饮食习惯对肠道耐药性的潜在影响,并强调了选定类别的饮食成分对抗生素耐药细菌的调节作用。
▼长期饮食习惯可能会改变肠道耐药组长期的饮食习惯会影响肠道微生物群和肠道抵抗力。
Stege等人(2022)选择了149名荷兰个体,他们的饮食习惯分为四个不同的群体:杂食者、鱼素食者、素食者、纯素食者。研究发现长期的饮食习惯并没有显著影响肠道微生物组的关键组成和多样性。在前10个最丰富的ARG中没有观察到显著差异。然而,两个ARG[lsa(C)和tet(L)]在杂食者和鱼食者之间显示出不同的丰度。
此外,宏基因组分析显示,与鱼素者相比,tet(X)在杂食动物的抗性体中更为丰富。
在来自三种不同饮食习惯(杂食性、蛋乳素食主义、严格素食主义)的58名志愿者的肠道抵抗力中观察到了类似的结果。
在所有习惯组中,最常见的耐药基因是针对四环素类抗生素[tet(A)、tet(B)、tet(M)、tets(O)、tet(Q)]、β-内酰胺类(blaTEM、blaSHV、mef)和MLS耐药基因[erm(B)、erm(C)],其次是磺胺类(sul1、sul2)和氨基糖苷类耐药基因(aacA-aphD)。
blaCTX‐M仅在卵乳素食组的样本中发现,而tet(E) 仅在杂食组的样本中检测到。有趣的是,这些经常检测到的ARG也常见于农场动物粪便中,这表明饮食习惯和环境ARG之间存在潜在联系。
虽然将饮食与肠道抗药性联系起来的确切机制尚不清楚,但饮食干预可能提供一种有前景的方法来减轻抗生素耐药性的负担。
Oliver等人(2022)研究了290名健康成年人,以探索饮食、肠道微生物组和抗生素耐药性之间的关系,并观察到高膳食纤维摄入量的个体ARG水平较低。
低ARG人群在肠道中显示出更多梭菌科的专性厌氧菌,而高ARG人群的链球菌科和肠杆菌科水平更高。此外,低ARG个体摄入的蛋白质较少,尤其是来自牛肉和猪肉的蛋白质。
该研究表明,增加纤维摄入量可能会促进肠道微生物组环境,有利于专性厌氧菌的生长,同时限制兼性厌氧菌,从而可能降低肠道中抗生素耐药性的发生率。
这是因为由专性厌氧菌发酵的膳食纤维会产生短链脂肪酸,降低肠道环境的pH值,使其对专性厌氧杆菌有利,但对兼性厌氧菌不利。
▼膳食成分可以抑制抗生素耐药细菌特定的饮食成分通过各种机制在调节肠道微生物群方面发挥着至关重要的作用。生物活性常量营养素,如凝集素、乳铁蛋白和多不饱和脂肪酸(PUFA),来源于碳水化合物、蛋白质和脂质,主要因其营养作用而被认可,但它们也具有生物活性,通过破坏营养可用性和细菌膜完整性来抑制抗生素细菌。
多酚等植物化学物质通过破坏细胞功能、干扰代谢过程或抑制酶活性表现出抗菌特性。
益生菌,如乳杆菌和双歧杆菌,通过竞争性排斥、分泌抗菌化合物和免疫调节来抑制病原体。
有趣的是,其中一些化合物还具有选择性抑制抗生素耐药细菌的能力,通过靶向其脆弱性,如损害生物膜形成、抑制耐药酶和破坏外排泵。
研究这些化合物如何特异性靶向细菌,包括抗生素耐药菌株,对于制定控制或减少肠道致病菌群的饮食策略至关重要。这有助于提供了一种非抗生素方法来管理肠道健康,并有助于遏制抗生素耐药性的传播。
生物活性常量营养素
常量营养素包括碳水化合物、蛋白质、脂肪,是人类饮食中支持生命和调节各种生理功能的重要组成部分。虽然它们的主要作用是为身体提供能量和构建块,但某些生物活性常量营养素也具有固有的抗菌特性。
这些特性可能有助于控制抗生素耐药细菌的生长,减轻其对肠道微生物组的影响,从而可能提供一种对抗抗生素耐药性的替代策略。
碳水化合物
不仅是能量的来源,而且具有生物活性,可以提高抗生素的有效性。
来自紫色鞘豆(Dioclea violacea)种子的甘露糖结合凝集素已被证明可以提高抗生素的疗效。关于什么是凝集素可以详见我们之前的文章:什么是凝集素,食物中的凝集素如何影响肠漏和自身免疫
Santos等人(2023)证明,从紫色鞘豆中提取的凝集素作为佐剂,通过碳水化合物识别增加细菌膜附近氨基糖苷类的生物利用度,并促进抗生素进入细菌细胞质,从而增强新霉素对多药耐药金黄色葡萄球菌和铜绿假单胞菌的活性。
蛋白质
如母乳和牛乳中的乳铁蛋白,也表现出抗菌和抗菌膜特性。
Avery等人(2021)报告称,人和牛乳铁蛋白都可以显著抑制测试的多重耐药鲍曼不动杆菌菌株中生物膜的形成,而人乳铁蛋白的最低抑菌浓度(MIC)低于牛乳铁蛋白,表明其效力更高。除了乳铁蛋白,来自植物的抗菌肽(AMP)在对抗抗生素耐药细菌方面也显示出了希望。
Heymich等人(2021)从鹰嘴豆中鉴定出21种AMP候选物,其中两种对耐甲氧西林的金黄色葡萄球菌ATCC 3300具有杀菌活性。这些肽与细菌膜相互作用,通过膜破裂导致细胞裂解,这与它们的杀菌作用直接相关。
膳食脂肪
特别是PUDA,也可以提高某些抗生素的有效性。
Zang等人(2021)发现,花生四烯酸(AA)和二十二碳六烯酸(DHA)等PUFA可增强氨基糖苷类药物对多重耐药鲍曼不动杆菌的疗效。
AA和DHA都通过细胞外隔离减轻了粘菌素的抗菌作用,使其难以穿透细菌的亲水性包膜和脂多糖屏障,并上调了外排系统基因表达(adeABC和adeIJK),从而通过将抗生素排出细胞来增加细菌的抗药性。
上述研究强调了生物活性常量营养素在增强抗生素有效性和影响耐药机制方面的作用。
果胶等碳水化合物可以通过与抗生素相互作用来提高抗生素的疗效,而乳铁蛋白等蛋白质则具有强大的抗菌和抗菌膜特性。然而,AA和DHA等膳食脂肪的作用更为微妙,因为它们都可以通过激活外排泵来增强抗生素作用并上调细菌耐药性机制。
总之,生物活性常量营养素不仅可以作为能量来源,还可以在对抗抗生素耐药细菌方面提供巨大的潜力。虽然它们在调节细菌耐药机制方面的作用很复杂,但这些发现强调了进一步研究饮食成分补充或增强传统抗生素治疗潜力的重要性。通过利用这些天然化合物,可能能够开发出新的策略,来缓解抗生素耐药性日益增长的挑战。

doi:10.1111/1541-4337.70143
植物化学物质
植物化学物质来源于植物性食品,主要包括多酚、含硫化合物、萜类、生物碱。这些化合物对抗生素耐药细菌具有抗菌活性,其中一些会破坏细菌膜结构,另一些则通过抑制外排泵来增强抗生素的有效性,从而防止耐药性的发展。
★ ■ 多酚类
柿子单宁——直接抗菌作用
一种经过充分研究的多酚,即来自青涩柿子的柿子单宁,已显示出对耐甲氧西林金黄色葡萄球菌的抑制作用。柿子单宁抑制细胞增殖,降低膜电位和细胞内ATP浓度,破坏全细胞蛋白质完整性,并诱导细胞S期细胞周期阻滞。
EGCG、原花青素——协同作用、增强抗生素疗效
Parvez等人(2019)报道了表没食子儿茶素没食子酸酯(EGCG)与庆大霉素联合使用时具有明显的协同作用,增强了对金黄色葡萄球菌和大肠杆菌多药耐药菌株的抗生素疗效。这是因为EGCG可以破坏细菌细胞膜,阻碍DNA超螺旋,增加细胞通透性,最终导致细菌死亡,并减轻耐药性的发展。
同样,从美国蔓越莓(Vaccinium macrocarpon L.)中提取的原花青素与β-内酰胺类抗生素显示出显著的协同作用。
Gallique等人(2021)报告称,原花青素抑制β-内酰胺酶,并选择性增强苯唑西林和羧苄青霉素对耐甲氧西林葡萄球菌的有效性,可能是通过调节葡萄球菌中变异转肽酶PBP2a的表达。PBP2a的低表达降低了细菌抵抗β-内酰胺类抗生素的能力,使细菌更容易受到抗生素的影响。
扩展阅读:
★ ■ 含硫化合物
大蒜素衍生物——释放硫化物破坏致病生物膜
例如,Xu等人(2018)将从大蒜鳞茎中分离出的大蒜素转化为纳米级硫化铁。这些纳米颗粒可以释放杀菌的有机硫化物(Polysulfanes),有效抑制生物膜形成和耐药的金黄色葡萄球菌。
异硫氰酸盐——抑制生物膜代谢活性
同样,来源于旱金莲和辣根的异硫氰酸酯对铜绿假单胞菌等抗生素耐药细菌具有抗菌潜力,特别是在生物膜抑制方面。当与美罗培南联合使用时,异硫氰酸酯通过抑制铜绿假单胞菌生物膜的代谢活性来增强抗生素疗效。
皂苷——破坏细胞壁结构,改变膜通透性
此外,da Silva等人(2024年)从Sarcomphalus joazeiro中提取了六种皂苷——红枣皂苷B、红枣皂苷III、酸枣仁苷、红枣皂苷IV、红枣皂苷II和红枣皂苷I,以及三种皂苷衍生物。当与庆大霉素和诺氟沙星联合使用时,富含皂苷的组分显示出增强作用,增加了它们对多药耐药铜绿假单胞菌和金黄色葡萄球菌的活性。皂苷与细菌细胞壁相互作用,导致结构损伤,改变膜通透性,并诱导膜破裂。
★ ■ 萜类药物
1,8-桉叶醇——增加膜通透性、诱导氧化应激导致成分泄漏
Moo等人(2021)发现,1,8-桉叶醇对碳青霉烯类抗生素耐药肺炎克雷伯菌具有抗菌作用。它增加了细菌表面电荷,增强了外膜通透性,并诱导了氧化应激,导致膜损伤、细胞内成分(如核酸、蛋白质和脂质)泄漏,最终导致细胞死亡。
芳樟酯——产生ROS、引发脂质过氧化
另一种萜烯,邻氨基苯甲酸芳樟酯(LNA),存在于薰衣草和百里香等植物中,对碳青霉烯类耐药肺炎克雷伯菌具有杀菌活性。
Yang等人(2021)证明,当LNA与美罗培南联合使用时,会降低MIC,使细菌更容易感染。LNA的抗菌作用归因于其通过产生ROS诱导氧化应激的能力,ROS可能进一步引发脂质过氧化并对细菌膜造成损伤。
萜类化合物——细菌外排泵的重要抑制剂
Oluwatuyi等人(2004)在迷迭香中鉴定出几种萜类化合物,如鼠尾草酸、鼠尾草酚和12-甲氧基-反式鼠尾草酸。这些化合物已被证明可以通过抑制NorA外排泵来增强红霉素对多药耐药金黄色葡萄球菌的活性,从而降低细菌排出抗生素的能力并增加其细胞内浓度。
★ ■ 生物碱
原小檗碱类生物碱——抑制H+-ATP酶泵,阻断ATP合成
Guefack等人(2022)从绿花恩南番茄(Enantia chlorantha)中鉴定出的原小蘖碱类生物碱(protoberberine alkaloids)(哥伦比亚胺、假哥伦比亚胺、药根碱、巴马汀、4,13-二羟基-3,9,10-三甲氧基原小檗碱和13-羟基-2,3,9,10-四甲氧基原黄连素)可以有效抑制多药耐药细菌的生长,包括大肠杆菌、产气肠杆菌、肺炎克雷伯菌、普罗维登斯氏菌(Providencia stuartii)、金黄色葡萄球菌,MIC值低于100µg/mL。重要的是,其中一种名为哥伦比亚胺的生物碱抑制了H+-ATP泵,阻碍了细胞ATP的产生。
苦参碱——抑制Mex泵,增强氟喹诺酮敏感性
来自苦豆子种子的苦参碱与环丙沙星对铜绿假单胞菌的抗生素耐药菌株显示出协同作用。总生物碱显示出抑制生物膜形成和降低Mex泵活性的作用,从而增强细菌对氟喹诺酮类药物的敏感性。
研究人员从Erythroxylum revolutum Mart.中分离出生物碱,包括6-(2′-甲基丁酰氧基)-3-羟基托烷和6-丁酰氧基-3-羟基托巴烷,可增强诺氟沙星和红霉素对多药耐药金黄色葡萄球菌的疗效。这种作用可能与托烷生物碱削弱耐多药金黄色葡萄球菌中ABC多药转运蛋白的能力有关。
总之,植物化学物质通过破坏细菌膜、抑制外排泵和阻碍细菌生物膜的形成来发挥抗菌能力。当与抗生素结合时,一些植物化学物质表现出协同作用,可以提高抗生素的有效性并改变抗生素的耐药性,表明有可能管理肠道中的抗生素耐药细菌并影响肠道耐药组。
未来,有必要研究这些植物化学物质在人体肠道中的生物利用度、剂量和长期影响,这可能会导致更有针对性的饮食干预。深化我们对特定植物化学物质如何选择性调节肠道抗药性的理解,对于开发创新方法来减轻抗药性基因的传播和改善人类健康结果至关重要。

doi:10.1111/1541-4337.70143
益生菌
益生菌是具有健康益处的活微生物,通常被掺入酸奶和奶酪等发酵食品中。然而,这些产品通常只有在用未经巴氏消毒的牛奶制成时才含有益生菌,因为巴氏消毒可以显著减少或消除活的益生菌菌株。益生菌可以通过调节肠道微环境、增强免疫功能和抑制过敏反应来影响肠道中的抗生素耐药细菌。
★ ■ 直接抗菌效应
某些益生菌菌株已显示出对耐药病原体的抗菌活性。
乳杆菌类——破坏细胞膜完整性,与抗生素协同抑制有害菌
例如,嗜酸乳杆菌NCFM和鼠李糖乳杆菌GG通过破坏细菌细胞膜的完整性对耐甲氧西林金黄色葡萄球菌表现出抗菌作用。
益生菌胶囊(嗜酸乳杆菌CL1285、干酪乳酸杆菌LBC80R、鼠李糖乳杆菌CLR2)与妥布霉素联合使用时,通过限制病原体定植和阻碍生物膜的形成,对耐甲氧西林的金黄色葡萄球菌和铜绿假单胞菌表现出协同作用。
双歧杆菌——促进四环素进入,破坏蛋白质合成
双歧杆菌会产生生物表面活性剂和乙酸盐,这有助于分离粘附的大肠杆菌并改变细胞内的阴离子组成。这可以增强四环素进入大肠杆菌,破坏蛋白质合成,最终导致协同杀死大肠杆菌。这些研究为益生菌作为功能性食品调节肠道抗菌药物耐药性的潜在应用铺平了道路。
★ ■ 发酵食品中的益生菌活性
除了这些单独的益生菌菌株外,酸奶和泡菜等发酵食品中发现的益生菌已被证明可以抑制抗生素耐药细菌的生长。
酸奶来源菌株抗菌物质:类细菌素肽或蛋白
从商业酸奶中分离出的石蜡乳杆菌对14种多药耐药细菌具有抗菌活性,包括大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌、产气杆菌、奇异变形杆菌、肺炎克雷伯菌。该菌株产生的抗菌物质可能是一种细菌素样肽或蛋白质,对密切相关的细菌菌株具有活性,表明其在抑制致病性多药耐药细菌生长方面具有潜在作用。
泡菜来源菌株——抑制耐药菌、生物膜
Yi和Kim(2023)从泡菜中分离出益生菌乳酸菌(Pediococcus inopinatus K35),该菌能有效抑制多药耐药铜绿假单胞菌的生长和生物膜形成。这些研究共同强调了益生菌的巨大潜力,特别是那些来自发酵食品的益生菌,作为能够对抗抗生素耐药细菌的天然药物。

doi:10.1111/1541-4337.70143
然而,一个值得关注的问题是益生菌菌株可能携带ARG,ARG可以转移到致病菌,从而导致耐药性的传播。
例如,Selvin等人(2020)从膳食补充剂中分离出益生菌菌株,发现粪肠球菌和肠系膜芽孢杆菌对青霉素G有耐药性,嗜酸乳杆菌对氨苄青霉素有耐药性。
Montassier等人(2021)的一项研究表明,摄入市售益生菌补充剂(含有11种常见的益生菌菌株:嗜酸乳杆菌、干酪乳杆菌、副干酪乳酸杆菌、鼠李糖乳杆菌、植物乳杆菌、双歧杆菌、短双歧杆菌、长双歧杆菌亚种、婴儿长双歧杆菌、乳链球菌和嗜热链球菌)导致ARG丰度降低。
然而,益生菌也可以作为肠道耐药组扩展的储库,因为益生菌的摄入可以通过水平基因转移将携带ARG的菌株扩展到病原体,因为移动遗传元件含量(转座酶和整合酶)的检测与ARG丰度相关。
这些发现强调了在将益生菌纳入饮食时需要谨慎,特别是在商业益生菌补充剂的情况下。虽然益生菌可以在减少致病菌定植和增强抗菌活性方面发挥作用,但必须仔细评估它们作为ARG载体的作用。为了降低潜在风险,需要监测补充剂和功能性食品中使用的益生菌菌株中的ARG含量,确保它们不会导致耐药性的进一步传播。
总之,虽然益生菌作为功能性食品具有调节肠道耐药性和对抗抗生素耐药性的潜力,但它们储存和转移ARG的潜力需要更彻底的研究。未来的研究应侧重于鉴定ARG转移风险最小的益生菌菌株,并优化益生菌食品,以提高其治疗效果,同时限制对肠道耐药的不利影响。
以上我们已经了解了抗生素耐药性的发生机制、传播途径、饮食干预的方法和机制。在实施上述饮食干预策略的同时,如何客观评估其对肠道耐药组的影响至关重要。
随着测序技术的快速发展,肠道菌群检测已经能够识别肠道中的抗生素耐药基因,例如,谷禾宏基因组肠道菌群检测报告中,专门设有抗生素耐药基因分析板块,可检测β-内酰胺酶、氨基糖苷类、大环内酯类、喹诺酮类、四环素耐药基因等多种耐药机制的存在和丰度,这为评估饮食干预效果提供了客观依据。

<来源:谷禾宏基因组肠道菌群检测报告>
通过干预前后的对比检测,我们可以了解特定饮食成分对耐药基因表达的影响,从而不断优化干预方案,实现个性化的肠道耐药组管理。
例如,患者A因肺炎需要使用抗生素治疗,在用药前安排了肠道菌群检测。报告显示其肠道中存在高水平的β-内酰胺酶耐药基因,那么根据报告调整相关抗生素方案,避开容易产生耐药的β-内酰胺类抗生素,减少治疗期间耐药基因的扩增风险。
通过识别高丰度ARGs,预测治疗失败风险,避免可能造成更加严重抗生素耐药。
一名反复发生尿路感染的患者B,常规抗生素治疗无效。通过肠道菌群宏基因组检测,发现其肠道中携带高丰度的 blaCTX-M(广谱β-内酰胺酶基因) 和 mecA(甲氧西林耐药基因),提示对β-内酰胺类及甲氧西林类药物耐药。
根据检测结果,避免使用头孢类(靶向β-内酰胺酶敏感菌),改用磷霉素(对blaCTX-M无交叉耐药)或联合多黏菌素(针对mecA阳性菌)。补充蔓越莓原花青素(抑制β-内酰胺酶活性)或大蒜素纳米颗粒(破坏生物膜),增强抗生素渗透性。
识别关键耐药基因,指导临床选择非交叉耐药抗生素并辅以天然抗菌成分,从源头减少抗生素滥用导致的耐药性扩增。
一名2型糖尿病患者宏基因组检测显示,其肠道中 Vancomycin_vanX(万古霉素耐药基因) 和 Multidrug_emrE(多药耐药基因) 丰度升高,且与胰岛素抵抗指数呈正相关。
ARG丰度高的糖尿病患者血糖控制失败率相对较高,因此可以从这方面入手,增加苦参碱摄入(抑制Mex泵活性),联合二甲双胍改善胰岛素敏感性。
通过识别耐药基因丰度,可预测糖尿病血糖控制失败的风险,针对性干预,减少耐药基因对慢性疾病的协同恶化作用。
04结 语
抗生素耐药性已经从单纯的医学挑战演变为一个多维度的健康问题,而肠道耐药组的研究为我们提供了新的思路应对这一挑战。
肠道菌群检测技术已能够识别耐药基因的存在和丰度,使个体ARG状况的评估成为可能,这不仅可以帮助临床医生了解患者的耐药风险,也为饮食干预提供了科学依据。
日常饮食的预防性策略
加富含多酚的食物(如绿茶、浆果、深色蔬菜)、含硫食物(如十字花科蔬菜、大蒜)及发酵食品(如酸奶、泡菜),通过天然成分抑制耐药基因传播。
控制高脂高糖饮食(如红肉、加工食品),避免促进肠杆菌科等耐药菌增殖。地中海饮食模式(富含纤维、橄榄油)可提升短链脂肪酸水平,抑制耐药菌生长。
通过将这些科学发现转化为具体的饮食策略和产品,结合肠道菌群检测技术,我们有望在不依赖新抗生素开发的情况下,通过日常饮食管理减轻抗生素耐药性的负担,为公共健康问题提供可持续的补充解决方案。
功能性食品的开发创新
开发含高浓度EGCG的绿茶提取物饮品,或添加原花青素的蔓越莓咀嚼片,辅助治疗泌尿系统耐药菌等相关感染。
利用大蒜素纳米颗粒或异硫氰酸盐制成肠道缓释胶囊,抑制生物膜形成并减少水平基因转移。
基因编辑乳杆菌(如表达抗菌肽的菌株),靶向清除肠道内携带ARGs的致病菌。
通过微胶囊化或脂质体包裹提高多酚类成分的肠道吸收率;结合AI预测模型,从天然产物库中筛选新型抗菌分子,加速功能性配方的迭代。
建立功能性食品中ARGs迁移风险的动态监测体系,避免益生菌载体成为耐药基因传播媒介。
功能性食品作为“可食用疗法”,通过精准调控肠道耐药组,为临床耐药危机提供了“非抗生素”解决方案。未来需融合合成生物学、纳米技术与营养学,推动第三代功能性食品的落地。
临床营养的精准化应用
本文中列举的一些研究表明,植物多酚(如柿子单宁、表没食子儿茶素没食子酸酯)、含硫化合物(如大蒜素)及萜类(如1,8-桉叶油醇)可通过破坏细菌生物膜、抑制外排泵或增强抗生素渗透性,降低耐药菌存活率。临床可开发含此类成分的功能性营养剂,辅助治疗耐药菌感染(如MRSA、铜绿假单胞菌),或用于术后耐药菌感染预防。
特定益生菌(如乳酸杆菌、双歧杆菌)可通过竞争排斥或分泌抗菌肽抑制耐药菌定植。临床中可针对术后感染或抗生素滥用患者,定制含益生菌的肠内营养配方,重建肠道菌群平衡。
乳铁蛋白、植物抗菌肽等可增强抗生素疗效。例如,乳铁蛋白与氨基糖苷类联用可显著抑制多重耐药鲍曼不动杆菌,适合用于重症患者的营养支持方案。
2型糖尿病患者中,苦参碱与二甲双胍联用可抑制肠道内产气荚膜梭菌的Mex泵活性,改善胰岛素敏感性。
结直肠癌患者化疗期间,添加大蒜素纳米颗粒的营养配方可减少肠道内携带mdtP基因的多重耐药大肠杆菌丰度,缓解化疗相关性腹泻。
然而,也需要建立植物化学物质与抗生素的相互作用数据库,避免协同毒性(如EGCG与环丙沙星联用可能加重肝损伤)。
同时可以开展剂量梯度临床试验,明确如多酚类成分的最佳治疗窗口。
联合微生物学、药理学与食品科学,开发兼具营养支持与耐药调控功能的特医食品。通过跨学科协作,特医食品不仅可成为感染患者的营养支持方案,也能作为耐药危机的一线防控工具。
未来,跨领域合作结合人工智能,有望加速功能性食品的迭代,在降低抗生素依赖的同时,重塑肠道健康生态,为应对耐药危机提供可持续路径,最终实现“以食为药”的精准健康管理。
主要参考文献:
Abbas A, Barkhouse A, Hackenberger D, Wright GD. Antibiotic resistance: A key microbial survival mechanism that threatens public health. Cell Host Microbe. 2024 Jun 12;32(6):837-851.
Liang Z, Liang Z, Hu HW, Howell K, Fang Z, Zhang P. Food substances alter gut resistome: Mechanisms, health impacts, and food components. Compr Rev Food Sci Food Saf. 2025 Mar;24(2):e70143.
Pramod Barathe, Kawaljeet Kaur, Sagar Reddy, Varsha Shriram, Vinay Kumar, Antibiotic pollution and associated antimicrobial resistance in the environment,Journal of Hazardous Materials Letters, Volume 5,2024.
Langford BJ, Soucy JR, Leung V, So M, Kwan ATH, Portnoff JS, Bertagnolio S, Raybardhan S, MacFadden DR, Daneman N. Antibiotic resistance associated with the COVID-19 pandemic: a systematic review and meta-analysis. Clin Microbiol Infect. 2023 Mar;29(3):302-309.
Laxminarayan R. The overlooked pandemic of antimicrobial resistance. Lancet. 2022 Feb 12;399(10325):606-607.
Sarmiento MRA, de Paula TO, Borges FM, Ferreira-Machado AB, Resende JA, Moreira APB, Dutra Luquetti SCP, Cesar DE, da Silva VL, Diniz CG. Obesity, Xenobiotic Intake and Antimicrobial-Resistance Genes in the Human Gastrointestinal Tract: A Comparative Study of Eutrophic, Overweight and Obese Individuals. Genes (Basel). 2019 May 7;10(5):349.
本文转自:谷禾健康
转载本文请联系原作者获取授权,同时请注明本文来自牛耀芳科学网博客。
链接地址:https://wap.sciencenet.cn/blog-2040048-1479037.html?mobile=1
收藏

