博文
阿尔兹海默症脑网络演化建模
||
阿尔兹海默症脑网络演化建模

【摘要】阿尔兹海默症作为一种常见且多发的疾病,严重影响着中老年群体的生活质量与水平,深入理解阿尔兹海默症的发病机制和发展进程对于研发相关预防措施及治疗手段非常重要。现有研究大多基于病变前后大脑静态特性的对照分析,忽略了其病变过程中的动态演化机制。基于功能磁共振成像数据构建大脑功能网络,对其病变过程纵向发展中神经系统动态演化过程进行深入研究,提出了一种基于脑网络水平的阿尔兹海默症病变过程的动态演化模型,以模拟大脑在神经系统病变过程中的动态演变及可塑过程,最后,从多个角度对演化结果进行评估,验证了模型的合理性,为阿尔兹海默症的早期诊断、功能评估及预测提供了新思路。
关键词: 阿尔兹海默症 ; 复杂网络 ; 脑网络 ; 网络建模 ; 动态演化
引用格式 倪冰洁, 李炜, 陈曦.阿尔兹海默症脑网络演化建模. 智能科学与技术学报[J], 2019, 1(4): 369-378 doi:10.11959/j.issn.2096-6652.201941
Brain network evolution modeling based on Alzheimer’s disease
Abstract As a common and frequently-occurring disease,Alzheimer’s disease seriously affects the quality and level of life of the middle-aged and elderly.An in-depth understanding of the pathogenesis and progression of Alzheimer’s disease is important for the development of prevention and treatment options.Most of the existing studies were based on the static property analysis of the brain network before and after the lesion,and dynamic evolutionary mechanism of the lesion process was usually neglected.A dynamic evolution model was proposed based on the level of brain networks of Alzheimer’s disease by analyzing the longitudinal development to simulate plastic changes of the process.Finally,the rationality of the model was verified by evaluating the evolutionary results from multiple perspectives.The study provides a new idea for early diagnosis,functional evaluation and prediction of Alzheimer’s disease.
Keywords: Alzheimer’s disease ; complex network ; brain network ; network modeling ; dynamic evolution
Citation NI Bingjie.Brain network evolution modeling based on Alzheimer’s disease. Chinese Journal of Intelligent Science and Technology[J], 2019, 1(4): 369-378 doi:10.11959/j.issn.2096-6652.201941
1 引言
阿尔兹海默症(Alzheimer’s disease,AD)是一种在临床上表现为失语、失用、记忆障碍、执行功能障碍的神经系统退行性疾病[1,2]。早期AD患者的症状与随年龄增长的伴随症状极为相似,因此极易被忽视,导致AD早期被诊断出的可能性较小。实际数据表明,随着人体各项机能的衰退,年龄越大,患 AD 的概率也越大,并且在 80 岁以上的群体中,AD发病率甚至达到了20%以上。相关研究人员预测,在未来 20 年中,将会有越来越多的中老年人受到阿尔兹海默症的影响[3]。作为一种神经系统退行性疾病,阿尔兹海默症是不可逆的,并且目前仍未发现有效的治疗方式。医学上认为,对于阿尔兹海默症,只有及早发现,通过医疗手段及时控制,才能减缓疾病的发展速度,提高患者的生活质量。因此,对阿尔兹海默症脑网络动态演化的研究有利于探索疾病的发病机制和发展进程,为诊断和控制病情提供一定的帮助和支持。
21世纪以来,随着大脑成像相关技术的问世和发展,全脑影像数据采集方法为人类研究AD提供了更有效的数据支持。在各种成熟的脑成像技术中,由于具有可重复操作性、安全无害性、高空间分辨率、成熟的数据采集功能等优势,磁共振成像(magnetic resonance imaging,MRI)越来越普遍地被应用于临床和活体试验中[6,7]。
在基于Rs-fMRI数据对大脑的研究中,较为常见的方法是将图像型数据抽象为数值型数据并构建大脑网络。人脑中神经元间作用的速度和敏感程度决定了人脑完成任务的迅速性和准确性,成千上万个带有突触的神经元组成了具有层次性、系统性的脑网络,通过脑网络不同层次间的相互作用完成复杂的生理或心理活动[8]。以图论为基础的复杂网络理论将各脑区定义为网络节点、脑区间的相互作用或关联定义为节点间连边,建立大脑网络的抽象模型。同时,通过定义和计算网络拓扑属性可研究大脑网络的各项性能。众多对 AD 患者脑网络拓扑属性的研究表明,同未患有AD者的脑网络相比,AD患者脑网络在特征路径长度、聚类系数、全局效率等属性方面发生了明显变化,病变过程中网络连接强度下降,并且越来越接近随机网络[9,10,11]。另外,在功能连接上,研究数据表明,在病变过程中,大脑中枢节点(即拥有高节点度的节点)的连边更易遭到破坏[12],局部脑区间也会发生一些非正常的连接[13]。利用网络拓扑属性对 AD 患者脑网络的分析可探究大脑网络在病变前后的性能变化。
值得注意的是,现有的研究大多为对静态脑网络的分析,忽略了神经系统在动态演化过程中的可塑机制,因此需要深入了解AD病变过程中脑网络的动态演化机制。网络演化是一种常用的动态网络研究方法,目前已被广泛应用于电网、互联网等复杂网络领域的研究中[14,15],而关于大脑网络演化的建模还处于探索阶段。Vértes等人[16,17]以节点间距离等为演化偏好,分别建立了单参数和多参数演化模型,以最大限度地构建与真实未患病者的脑网络拓扑属性一致的仿真网络。但需要强调的是,Vértes 等人提出的脑网络演化模型都遵循“从无到有”的演化规律,即“创建脑网络”,这与现实神经系统病变过程中脑网络由一个状态到另一个状态的转变过程存在很大差异。笔者认为需要通过建立以未患病者的脑网络为起点的动态演化模型,以实现对 AD 病变过程中脑网络状态转变的模拟,进而探究脑网络的动态演化机制。
本文从分析阿尔兹海默症病变过程中脑网络的拓扑属性变化入手,提出一个能模拟由未患病者的脑网络到AD患者脑网络完整病变过程的动态演化模型,并从多个角度对演化结果进行分析,同时,利用随机演化模式验证模型的合理性和有效性。
2 材料与方法
2.1 被试对象
本实验所有研究数据均来源于阿尔兹海默症神经成像联合数据库ADNI,主要使用ADNI2以及ADNI-GO 数据集。创建 ADNI 的目的在于通过统计分析各种医学影像数据研究AD的发病机制、预防措施与治疗手段。根据AD的病程阶段,在ADNI中抽取4组数据,即健康对照(normal control,NC)组、早期轻度认知障碍(early mild cognitive impairment,EMCI)组、晚期轻度认知障碍(late mild cognitive impairment,LMCI)组以及AD组。参与实验的所有被试者的年龄为 65~90 岁,除去头部转动距离超过2 mm或头部转动角度大于2°等不适合参与实验的对象外,最终选取了NC组36人、EMCI组37人、LMCI组33人、AD组35人,共计141人,其基本统计信息见表1。
表1 被试者基本统计信息
对比项 | NC | EMCI | LMCI | AD |
人数/人 | 36 | 37 | 33 | 35 |
性别(男/女) | 16/20 | 17/20 | 18/15 | 16/19 |
年龄/岁 | 72.92±4.21 | 73.28±4.86 | 74.64±4.10 | 75.10±4.05 |
MMSE评分 | 28.87±1.32 | 28.01±1.53 | 27.62±1.64 | 22.72±2.86 |
2.2 数据采集及预处理
实验采用Philips 3.0T扫描仪收集测试数据。数据参数设置如下:TR/TE =3 000 ms/30 ms(TR为重复时间,指两个连续射频脉冲间的时间间隔;TE 为回波时间,指射频脉冲与相应回波间的时间间隔),80°翻转角,3.3 mm扫描层厚度, 64×64图像比例矩阵,48个扫描层,140个采样时间点。
采用SPM12和DPARSF软件包对fMRI图像数据进行预处理[18]。依次经过校正、标准化、平滑、去除线性漂移等操作,依据 AAL(anatomical automatic labeling)模板将大脑分割为90个脑区[19],提取所有脑区的时间序列。
2.3 脑网络构建
对每一个被试对象提取各脑区随时间变化的响应序列(此实验选取了 140 个时间点),利用皮尔逊(Pearson)相关求出时域相关性系数矩阵,将系数矩阵取绝对值,得到表征相关性强弱的邻接矩阵,将定义的网络密度S划分为二值矩阵,得到脑网络。
网络密度S的确定遵从以下原则:首先,得到的每一个二值脑网络的节点度均不小于其节点对数的两倍;其次,健康对照组的脑网络小世界属性值应大于 1.1[20]。经过一系列验算,最终确定脑网络密度范围为8%~52%。
2.4 随机演化
将随机演化模型作为对照模型,在随机演化过程中,连边的建立和断开是随机发生在网络中任意两节点之间的。同时,在每一个演化步骤中,为维持网络密度不发生改变,连边建立和断开的概率保持一致。
2.5 演化偏好性分析
由于演化模型中涉及连边和断边的偏好,将以中间密度(S=30%)的正常脑网络为起点,采用3种演化模式探究不同演化偏好对脑网络的影响,具体内容如下。
• 攻击高节点模式:在每一个演化步骤中,优先选择包含高节点度节点的连边断开。
• 连接低节点模式:在每一个演化步骤中,优先选择低节点度节点建立连边。
• 随机演化模式:在每一个演化步骤中,以均等概率随机选择连边断开或建立连边。
3 阿尔兹海默症脑网络的动态建模
为模拟由健康对照脑网络经早期轻度认知障碍(NC→EMCI),发展至晚期轻度认知障碍(EMCI→LMCI),最后到阿尔兹海默症(LMCI→AD)的病变全过程,对NC→EMCI、EMCI→LMCI、LMCI→AD 3个发展阶段中脑网络高、低节点度节点占比的变化趋势进行分析,结果见表2。由表2可知,在阿尔兹海默症的发展过程中,低节点度节点占比基本呈现下降趋势,高节点度节点占比总体呈现下降趋势,这一结论与以往研究结果的变化趋势基本一致[21]。深入NC→EMCI→LMCI→AD的过程,低节点度节点占比在各阶段均呈现下降趋势,而高节点度节点占比在NC→EMCI→LMCI过程中呈现下降趋势,在LMCI→AD过程中则有所上升。
基于对阿尔兹海默症各阶段病人脑网络高、低节点度节点占比变化趋势的分析,结合已往对病变过程中功能连接变化的研究[21,22,23],本文提出了阿尔兹海默症纵向病程的相应演化假设,见表3。在NC→EMCI阶段,考虑优先在低节点度节点间建立连接和优先断开拥有高节点度节点的连边;在EMCI→LMCI阶段,随机选择节点建立连边和优先断开拥有高节点度节点的连边;在LMCI→AD阶段,优先在高、低节点度节点间建立连接和随机断开网络连边。
基于演化假设,本文提出了阿尔兹海默症脑网络的动态演化模型。模型演化以NC组脑网络为起点,第一阶段从NC组演化得到早期轻度认知障碍仿真脑网络(EMCIevo),第二阶段从EMCIevo组演化得到晚期轻度认知障碍仿真脑网络(LMCIevo),第三阶段从LMCIevo组演化得到阿尔兹海默症仿真脑网络(ADevo)。在每一个演化步骤中,为保持网络密度相对不变,连边建立和断开的概率一致。
表2 NC→EMCI→LMCI→AD各阶段高、低节点度节点占比的变化趋势
| 对比项 | 演化阶段 | ||
| NC→EMCI | EMCI→LMCI | LMCI→AD | |
| 低节点度节点占比变化趋势 | 从10%到9.02%,呈下降趋势 | 从9.02%到9.07%,基本持平 | 从9.07%到8.5%,呈下降趋势 |
| 高节点度节点占比变化趋势 | 从10%到9.4%,呈下降趋势 | 从9.4%到8.4%,呈下降趋势 | 从8.4%到9.05%,呈上升趋势 |
表3 NC→EMCI→LMCI→AD各阶段演化假设
| 对比项 | 演化阶段 | ||
| NC→EMCI | EMCI→LMCI | LMCI→AD | |
| 连边假设 | 低节点度节点相连 | 随机相连 | 高、低节点度节点相连 |
| 断边假设 | 高节点度节点断开 | 高节点度节点断开 | 随机断开 |
(1)连边规则


4 结果
4.1 真实组全局属性
选取特征路径长度(char)、全局效率(effi)、聚类系数(clu)、传递性(tran)、小世界属性(sw) 5个网络拓扑属性对真实NC、EMCI、LMCI、AD这 4 组脑网络的变化进行衡量。通过计算属性曲线下面积(area under the curve,AUC)消除密度段选取对结果分析的影响,在观察属性 AUC 值变化趋势的同时对组间属性进行差异性分析(t 检验),结果如图1所示。
图1
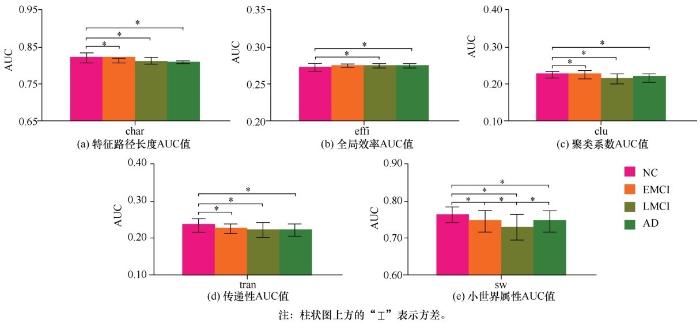
图1 NC、EMCI、LMCI、AD各阶段脑网络属性AUC值
实验结果显示,在特征路径长度、传递性以及聚类系数 3 个拓扑属性上,只有 NC 组和其余 3 组(EMCI、LMCI、AD组)有显著性差异。在全局效率上,只有NC组和后两组(LMCI、AD组)有显著差异,说明该属性在病变后期发生显著变化。而对于小世界属性,几乎任意两组都存在显著性差异,这意味着小世界属性在整个病变过程中都发生了较为明显的变化。另外,在整个病变过程中,特征路径长度、传递性以及聚类系数的AUC值都随着疾病的发展而逐渐降低,而小世界属性的 AUC 值出现了在NC→EMCI→LMCI过程中下降、LMCI→AD过程中上升的U型变化。
4.2 最优模型参数
基于最优模型参数的选取原则,采用差分进化算法,得到NC→EMCIevo→LMCIevo→ADevo过程中各演化阶段的最优模型参数,具体如下。


图2 NC→EMCIevo阶段脑网络演化模型误差轨迹
图3

图3 EMCIevo→LMCIevo阶段脑网络演化模型误差轨迹
(3)LMCIevo→ADevo演化阶段
LMCIevo→ADevo 演化阶段的最优模型参数估计为:α=30,β=65,γ=52。验证方法与NC→EMCIevo阶段相同,误差轨迹如图4所示。图4(a)中,α=30之后的误差趋于水平;图4(b)中,β=65之后的误差趋于水平;图4(c)中,γ=52时出现谷值。
数据分析结果显示,在每一个误差轨迹图中,最优模型参数对应的误差值都是最小的,且同阶段下各误差值最小值保持一致。
4.3 仿真结果与真实数据的对比
首先,对同一阶段的仿真组和真实组的网络拓扑属性AUC值进行对比分析,结果如图5所示。由图5 可知,EMCI 组和 EMCIevo组、LMCI 组和LMCIevo组、AD组和ADevo组在5个属性上均没有显著性差异,并且在属性值上较为接近,表明本文所提的演化模型得到的仿真网络能较好地模拟真实网络各阶段的属性值。
图4

图4 LMCIevo→ADevo阶段脑网络演化模型误差轨迹
其次,对各阶段仿真网络与不同阶段真实脑网络进行显著性差异分析,结果见表4。由表4可知,各阶段演化网络与不同阶段真实脑网络间的显著性差异和各阶段真实网络与不同阶段真实脑网络间的显著性差异基本一致,特别是演化至AD阶段时,二者的显著性差异已经达到完全一致,这表明由演化模型得到的仿真网络能较好地模拟真实网络各阶段属性间的关系。
图5

图5 同一阶段仿真组与真实组脑网络属性比较
表4 仿真组与真实组显著性差异比较
| 对比项 | char | effi | clu | tran | sw |
| EMCI vs.NC | * | * | * | * | |
| EMCI vs.LMCI | * | ||||
| EMCI vs.AD | |||||
| EMCIevovs.NC | * | * | * | ||
| EMCIevovs.LMCI | * | * | |||
| EMCIevovs.AD | |||||
| LMCI vs.NC | * | * | * | * | * |
| LMCI vs.AD | * | ||||
| LMCIevovs.NC | * | * | * | * | |
| LMCIevovs.EMCI | * | * | |||
| LMCIevovs.AD | * | ||||
| AD vs.NC | * | * | * | * | * |
| ADevovs.NC | * | * | * | * | * |
| ADevovs.EMCI | |||||
| ADevovs.LMCI | * |
* 表示两组间属性有显著性差异。
另外,对演化得到的各阶段仿真网络进行网络属性AUC值计算和组间显著性差异分析(t检验),结果如图6所示。由图6可知,在特征路径长度、传递性上,只有NC组和后两组(LMCIevo、ADevo)有显著差异;在全局效率上,只有NC组和最后阶段(ADevo)有显著差异;在聚类系数和小世界属性上,大部分组间均存在显著差异。另外,在整个病变过程中,特征路径长度、传递性以及聚类系数的AUC值都随疾病的发展逐渐降低,而小世界属性有在 NC→EMCI→LMCI 过程中下降、LMCI→AD 过程中上升的 U 型变化。由前文对NC、EMCI、LMCI、AD各阶段脑网络属性AUC值的分析可知,仿真网络与真实网络的属性变化基本一致。此结果表明,由演化模型得到的仿真网络能较好地模拟真实网络中各阶段属性间的关系和属性变化趋势。
图6

图6 NC、EMCIevo、LMCIevo、ADevo各仿真阶段脑网络属性AUC值
通过对上述实验结果的分析发现,基于本文提出的阿尔兹海默症脑网络动态演化模型得到的各阶段仿真网络与真实网络基本一致,同时可以很好地捕捉阿尔兹海默症病变过程中的动态演化特性,从而验证了演化模型的有效性。
4.4 仿真组与随机组对比结果
为验证演化模型存在的合理性,基于随机演化模式,以NC组为起点,随机建立连边和断边,经过与本文提出的仿真模型相同的演化步数后,得到AD 随机演化网络 ADrandom-evo,计算其在全密度段上的网络属性AUC值,与真实NC、AD以及基于本文提出的演化模型仿真得到的ADevo进行对比分析,结果如图7所示。
由图7 可知,ADevo与AD的各个网络属性曲线都较为接近,相比之下,ADrandom-evo与AD的属性曲线存在很大差异,在聚类系数、传递性、小世界属性上表现尤为明显,表明本文提出的演化模型比随机演化模式能更好地模拟真实AD脑网络的属性变化,也说明在阿尔兹海默症病变过程中脑网络的演化并非是完全随机的,验证了演化模型的存在是合理的。
4.5 真实组全局属性
为验证演化模型中偏好的合理性,分别采用攻击高节点、连接低节点以及随机演化3种演化模式,对密度为30%的NC脑网络进行演化,计算网络属性AUC值,结果如图8所示。
由图8可知,在随机演化模式下,特征路径长度、全局效率、聚类系数、传递性都在演化节点数达到 70 个左右之后才出现较大幅度的变化。如果病变过程中脑网络的演化模式是完全随机的,那么在脑网络节点遭到大规模破坏后才会引起网络拓扑属性的显著变化,这与阿尔兹海默症的进阶性和缓慢性是相悖的。相比之下,在攻击高节点和连接低节点演化模式下,5 个属性都表现得极为敏感,演化节点较少时就能产生较大幅度的变化,从另一角度验证了模型中攻击高节点和连接低节点偏好比随机演化更合理。
图7
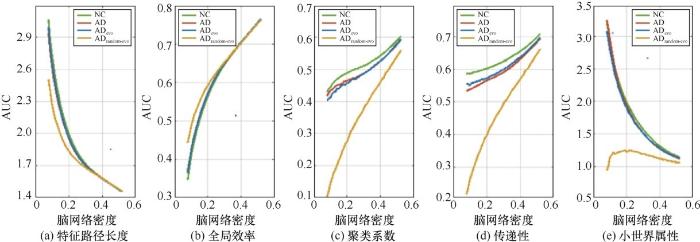
图7 NC、AD、ADevo、ADrandom-evo网络属性AUC值随脑网络密度的变化情况
图8
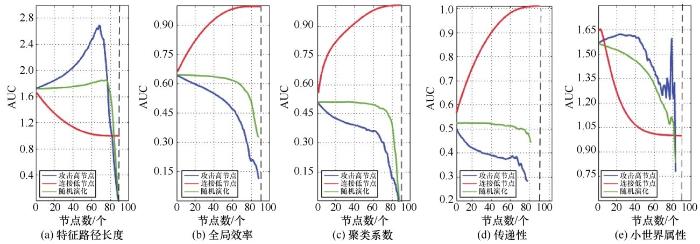
图8 不同演化模式下网络属性AUC值随节点数变化情况
5 结束语
阿尔兹海默症是一种变化缓慢且进阶的神经系统退行性疾病,至今还没有非常有效的治疗手段,对阿尔兹海默症病变过程的模拟演化能为研究该疾病的发展机制提供很大的帮助。本文以功能磁共振影像为数据基础、以复杂网络为理论依据,将大脑看作一个不同脑区间相互耦合的复杂系统,以脑网络动态演化建模为主线展开研究,提出了一种基于脑网络水平的阿尔兹海默症病变过程的动态演化模型,实现了对阿尔兹海默症病变过程中各阶段的仿真模拟。本文所提模型倾向于“低节点度节点间建立连接、拥有高节点度节点的连边断开”的演化假设,并通过对基于演化模型得到的仿真网络与真实网络、随机模式下的演化网络,进行拓扑属性间差异性和属性变化趋势的对比分析,验证了演化模型的有效性和模型假设偏好的合理性。本文提出的阿尔兹海默症脑网络动态演化模型以已有的对病变前后脑网络静态属性分析的相关研究为基础,考虑了脑网络在病变过程中的网络重组,突破了以往对脑网络“从无到有”的构建模式,为研究阿尔兹海默症病变过程中的脑网络动态演化机制提供了新思路。
作者简介


https://wap.sciencenet.cn/blog-951291-1229605.html
上一篇:智车科技第13周自动驾驶周刊丨国外多家自动驾驶企业裁员;一汽集团斥资5000万成立人工智能公司
下一篇:慧拓智能荣登毕马威第三届汽车科技新锐企业榜