博文
350.新型冠状病毒变异生物学:免疫逃逸、传播和适应
||
新型冠状病毒变异生物学:免疫逃逸、传播和适应
Alessandro M. Carabelli
摘要
2020年末,在人群中传播近一年后,严重急性呼吸综合征冠状病毒2(SARS-CoV-2) 在适应人类方面出现了重大的阶跃变化。相对于以前的变种,这些高度变异的新型冠状病毒病毒具有更高的传播率,被称为“令人担忧的变种”(VOCs)。被命名为α、β、γ、δ和ω的 VOCs 彼此独立出现,并依次迅速在区域或全球范围内占据主导地位,超过了以前的变体。每种VOC相对于以前占优势的变异体的成功是由于改变了病毒的内在功能特性,并且在不同程度上改变了病毒的抗原性,赋予了逃避引发的免疫反应的能力。与 VOCs 相关的病毒适应性增加是在由于疫苗接种和先前感染而改变人类免疫力的背景下病毒生物学的复杂相互作用的结果。在这篇综述中,作者总结了关于新型冠状病毒变异体的相对传递性和抗原性、弗林蛋白酶刺突切割位点突变和非刺突蛋白的作用、重组对病毒成功的潜在重要性以及T细胞、先天免疫和群体免疫背景下的新型冠状病毒进化的文献。新型冠状病毒显示了病毒抗原性、传播性和毒力之间的复杂关系,这对新冠肺炎的未来轨迹和疾病负担具有不可预测的影响。
介绍
截至2022年12月,严重急性呼吸综合征冠状病毒2型( (SARS-CoV-2) 已导致超过6.41亿例新冠肺炎病例,超过660万人死亡。新型冠状病毒(连同SARS-CoV,SARS的病因)是严重急性呼吸综合征相关冠状病毒物种的成员,是主要在马蹄形蝙蝠中发现的病毒亚属—— Sarbecovirus的唯一成员。像其他冠状病毒一样,新型冠状病毒拥有一个大的RNA基因组,包含约30,000个核苷酸,其复制由RNA依赖的RNA聚合酶(RdRP)和相关的校对酶外核糖核酸酶(外显子)介导。如前所述,这与冠状病毒转录的不连续性质相结合,导致冠状病毒具有高的重组、插入和缺失以及点突变率(尽管由于校对,这些比率低于其他RNA病毒)3。新的遗传变异的成功产生,尽管倾向于随机抽样过程,将非常依赖于自然选择;特别是,正选择与突变相关,这些突变对它们所在的病毒是有益的。
新型冠状病毒已被证明是一种非常有能力的人类病原体,但在宿主嗜性方面也是多面手,在多种哺乳动物物种中建立感染,包括养殖水貂中的感染白尾鹿的一个稳定的宿和许多其他动物物种的偶然感染。一旦新型冠状病毒出现在人类身上,新型冠状病毒进化的最初几个月的特点是相对于后来的进化,适应能力有限,表型发生变化。第一个值得注意的变化是单个氨基酸替代(D614G ),出现在疫情早期,相对于之前的变异体,其生长优势约为20%。D614G定义的谱系(盘古谱系B.1)很快在欧洲占主导地位,这是新型冠状病毒增加其在人类中传播能力的早期迹象。正如作者之前所描述的,从2020年10月起,新的、变异更严重的新型冠状病毒变种开始出现。这些变体的特点是主要在刺突蛋白中有大量的非同义突变,尤其是Omicron,以及不同的表型特征,包括遗传性和抗原性的改变。迄今为止,世界卫生组织(和国家公共卫生机构)已宣布五种新型冠状病毒变异体为关注变异体(VOCs ),理由是它们表现出显著改变的传播性或免疫逃逸,值得密切监测。每一种 VOCs 都显示出优于先前变体的传播优势,并成为主导,或者在阿尔法(盘古)谱系的情况下是区域性的B.1.1.7、β(b . 1.351)和γ(p . 1)——分别在欧洲、南部非洲和南美洲——或在全球范围内,在Delta (B.1.617.2/AY亚系)和许多Omicron亚系(B.1.1.529/BA亚系,如BA.1、BA.2和BA.5)的情况下。
与病毒溢出后经历快速宿主适应的预期相反,选择分析表明,新型冠状病毒在疫情早期缺乏显著水平的可观察的适应。后来发现新型冠状病毒是一种通用病毒,能够利用多种哺乳动物血管紧张素转换酶2 (ACE2)膜蛋白进入细胞,能够感染多种哺乳动物。沙贝病毒(Sarbecoviruses)经常在不同种类的马蹄铁蝙蝠之间传播和具有ACE2结合能力的非蝙蝠物种(在沙贝病毒(Sarbecoviruses)中推断的祖先特征),恰好包括人类。新型冠状病毒刺突蛋白包含重要的特性,这些特性是有效的人对人传播所必需的,特别是:人ACE2结合和S1-S2连接处的多元弗林蛋白酶切位点(FCS)。目前,新型冠状病毒S1-S2 FCS在沙贝病毒(Sarbecoviruses)(Sarbecoviruses)中是独特的,尽管在其他贝塔冠状病毒中观察到类似的序列。
新型冠状病毒进入气道细胞需要弗林蛋白酶介导的FCS裂解,从而实现膜融合。因此,FCS是新型冠状病毒高传播率的关键决定因素,有助于它在人类中的有效传播。在疫情过程中野生型FCS的进一步优化导致α和δ刺突蛋白的弗林蛋白酶切割增强。与其他突变一致,特别是那些增强ACE2结合的突变,优化弗林蛋白酶切割的突变被认为有助于增强α和VOCs的遗传性,从而增强适应性,与它们取代的变体相比,相对遗传性分别高65%和55%。与α和δ相反,Omicron变体的进化成功与弗林蛋白酶切割的优化无关。相反,Omicron的特征在于改变的进入表型,加上显著的免疫逃逸能够有效感染已接种疫苗或先前已感染的个体。尽管在原始人群中的传播性很大程度上是由内在的病毒特性决定的,但新型冠状病毒病毒现在传播的日益复杂的免疫景观意味着抗体逃逸(与仅通过病毒生物学增强的传播性相反,这种特性可能难以比Omicron实现的更进一步优化)正在成为变异成功的主要驱动力。奥密克戎出现之前(方框1),每一个优势变异体都是从前VOC祖先进化而来,而不是从另一个进化而来。相比之下,连续波现在是由Omicron亚系引起的(例如,BA.5,它的一个亚系BQ.1和BA.2的一个亚系BA.2.75)。值得注意的是,可能存在未检测到的变体,可能是重组体(盒2),可能出现与内在生物学和新抗原特性相关的高传播性。
无论是全新的变异体出现,还是未来的病毒从具有新抗原变化的Omicron亚系进化而来(随着以前的VOC不再传播,这种可能性越来越大),很明显,拥有独特突变组合的新新型冠状病毒变异体将继续出现,相对于以前的变异体,那些具有适合度优势的变异体将占优势。迄今为止,成功的变异体还表现出临床相关特征的变异,包括疾病严重程度、免疫逃避和对治疗剂(特别是单克隆抗体)的敏感性。因此,了解新型冠状病毒健身的驱动因素具有公共卫生和临床重要性。变异适合度——病毒的繁殖成功——取决于多种因素,这些因素决定了病毒在宿主体内感染、复制和传播的能力。在这篇综述中,作者概述了观察到的影响新型冠状病毒传染性和传播性的突变,并讨论了病毒逃避T细胞介导的、先天的或体液免疫的能力。查看作者之前的评论11关于棘波介导的体液免疫的更多细节。
方框1关注的新型冠状病毒变异体和奥密克戎复合体的起源
严重急性呼吸综合征冠状病毒2型( (SARS-CoV-2) 变异体(VOCs)表现出许多不同的特性,其中最有趣的是相对较长的系统发育分支长度,在检测到它们之前通常缺乏遗传中间体。在病毒低传播和史无前例的新型冠状病毒病毒监测时期,甲型流感病毒首次在英国被发现。达美航空于2021年4月在印度首次被发现,然后与英国新的疫情浪潮联系在一起,产生几个亚系,其中一些甚至比亲本Delta更易传播,例如AY.4.2。类似地,变异体的Omicron复合体具有更长的分支长度和甚至比以前的VOCs更多的突变。
中间序列的缺乏导致了VOC来源的几种假说(1)地理取样不足地区的环流;(2)在早期变体的反向人畜共患病之后,动物宿主内的隐蔽循环;(3)在免疫抑制宿主或多种人类宿主的慢性感染中的演变。尽管有证据表明新型冠状病毒建立了稳定的动物宿主,特别是养殖的水貂和白尾鹿。目前,变种出现的“慢性感染假说”是这些假设的最好支持。众所周知,慢性感染会导致与 VOCs 高度相似的突变。也有证据表明,慢性感染的有限向前传播会导致局部爆发。在持续的亚中和抗体压力下的长期进化可以解释VOC抗原距离,特别是对于Omicron。
与其他 VOCs 不同,Omicron在首次被检测到之前已经进化出显著的多样性,目前分为五个主要谱系(BA.1、BA.2、BA.3、BA.4和BA.5,见图),检测到更多的亚系,这些亚系正在累积进一步的抗原变化。BA.1在2021年底引发了全球感染浪潮,但到了2022年初,它已被BA.2取代。2022年4月,更多的BA亚系BA.4和BA.5得到了认可,截至2022年9月,BA.5已在国际上推动了新的一波Omicron浪潮。Omicron谱系显示出相互之间的复杂关联性,这可能包括检测前的多个VOC内重组事件。例如,BA.4和BA.5在M基因之前包含几乎相同的基因组5’末端,但在这一点之后显示出很大的差异,表明最近的重组事件。类似地,BA.3可能是原始BA.1和BA.2病毒的重组子代。图中显示了Omicron复合体的假设系统发育起源,显示了亚系BA.1、BA.2、BA.3、BA.4和BA.5之间的一种潜在重组模式。蛋白质名称表示近似(~)的潜在断裂点。
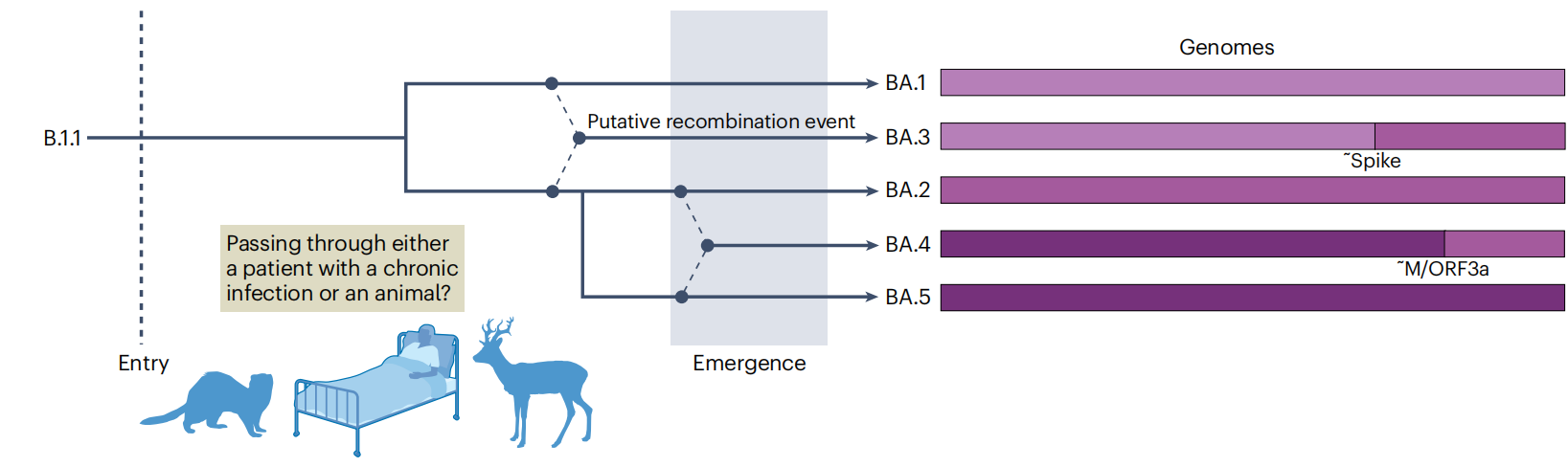
M,膜蛋白。
方框2新型冠状病毒重组体
当两种RNA病毒共同感染同一个体中的同一细胞时,在基因组复制过程中,聚合酶很有可能从一种基因组序列模板转换到异源基因组。这导致重组病毒的部分基因组来自一个“亲本”,剩余的基因组序列来自另一个“亲本”(见图,部分a)。自2020年以来,PANGO分类系统已在不同地点鉴定并指定了几个重组谱系,可通过“X-”世系前缀识别。当遗传上不同的变异体,例如两个相关的变异体,已经瞬时共同循环导致共同感染时,重组体已经被明确地鉴定。例如,第一个指定的重组谱系XA是在Alpha (B.1.1.7)和以前在英国流行的谱系B.1.177之间的重组。XC是在日本发现的阿尔法和德尔塔之间的重组体。
从2022年初开始,鉴定的重组体数量迅速增加,这可能是由于在新冠肺炎限制逐步取消的许多国家,Delta和BA.1或BA.1和BA.2之间的高水平共同循环。另一个解释是对识别重组体更有信心,因为Delta、BA.1和BA.2基因组之间的序列差异更大。一个重组体实例是XD——2022年1月在法国首次发现的Delta × BA.1重组体。XD具有两个基因组断裂点,具有来自Delta的主链和部分刺突蛋白氨基末端结构域,以及来自BA.1的刺突蛋白的剩余部分(参见图,部分b)。在功能上,在角蛋白18启动子控制下表达人血管紧张素转换酶2 (ACE2)的转基因小鼠中,XD已显示具有BA.1和Delta之间的中间致病性表型,导致中度体重减轻,这表明Delta和BA.1的部分不同啮齿动物致病性表型位于刺突蛋白之外。
英国第二个值得注意的重组体是BA.1 × BA.2重组体XE,它于2022年1月19日在英格兰首次被检测到。在被BA.5击败之前,XE包含2500多个基因组,大部分来自英国,初步数据表明,与BA.2相比,XE的增长率略有增加。XE包含来自BA.2的刺突蛋白和结构蛋白以及来自BA.1的部分ORF1ab。
最近一个值得注意的谱系是XAY,它是一种BA.2 × Delta重组体,于2022年5月在南非与一种较小的姐妹重组体XBA一起被首次发现。这些重组体具有比任何先前已知的簇多得多的断点,以及许多在亲代谱系中未发现的独特突变。这些重组体出现的一个可能的解释是BA.2的慢性Delta感染,在多次出现回到普通群体之前的反复重组(伴随着独特突变的逐渐获得)。XBB是最近在两个第二代BA.2谱系(BJ.1(也称为BA.2.10.1.1)和BA.2.75)之间出现并快速增长的重组体,它包含大量抗原受体结合结构域突变,并已被先前的Omicron突破性抗血清显示出很差的中和作用。
正如作者所描述的,变异体特异性的特性可以在刺突蛋白内部和外部进行定位。重组体,如XD,证明重组产生具有来自两个亲本病毒的表型特性的病毒是可能的。在快速增长的XBB之前,重组体对疫情的进程没有大的影响,通常出现在新的变异体取代以前的优势血统的时候。应该注意的是,这种重组在感染马蹄形蝙蝠的沙贝病毒(Sarbecoviruses)中是常见的,例如检测到高水平的重组基因组和刺突蛋白交换的趋势,这表明频繁的抗原转换事件。在患有Omicron和Delta感染的个体中发生的重组过程(参见图,部分a).一些著名的当代重组体(XD、XE、XAY和XBB)的基因组图谱(见图,部分b)。
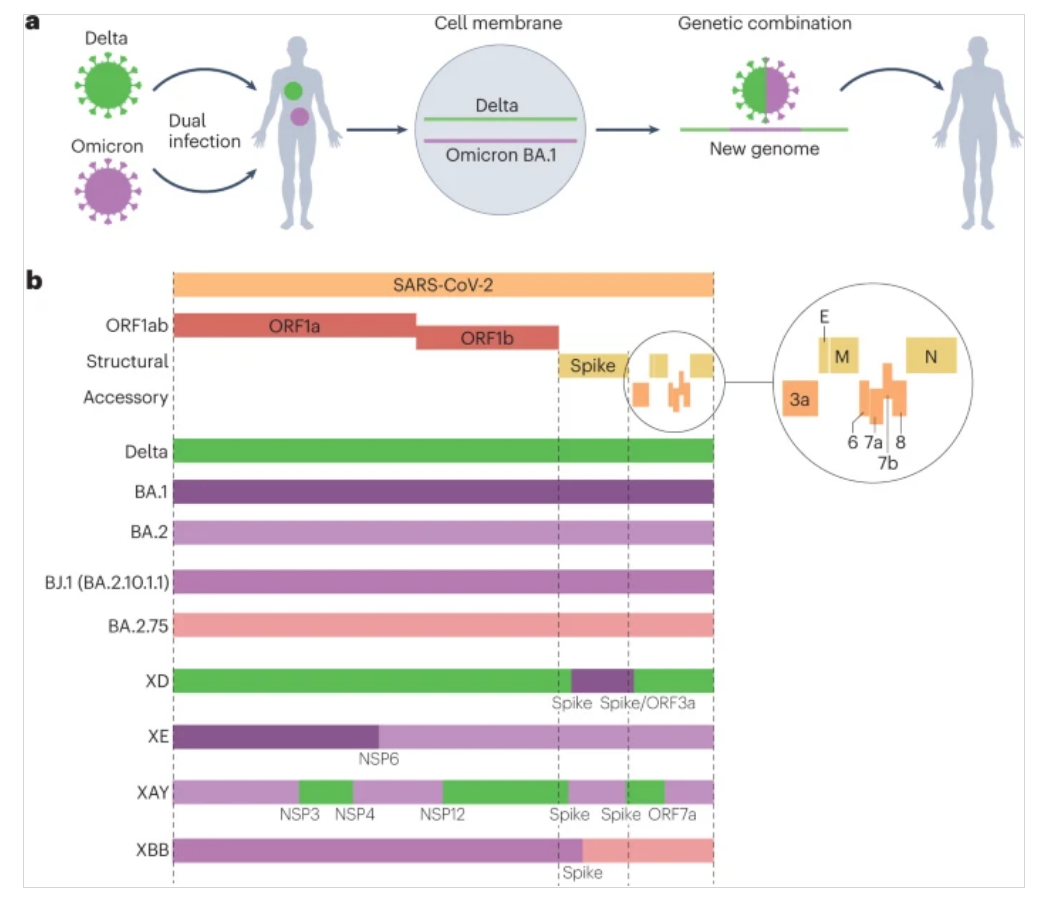
E、包膜蛋白;M,膜蛋白;N,核衣壳蛋白;NSP,非结构蛋白; SARS-CoV-2,严重急性呼吸系统综合症冠状病毒2。
抗原逃逸和新型冠状病毒变异体
早期对新型冠状病毒进化的担忧是潜在出现具有逃避疫苗或感染获得性免疫能力的抗原性独特的变体,例如N439K刺突替代。在2022年底更新之前,所有广泛使用的新冠肺炎疫苗都是基于早期变体的刺突抗原,大多数使用参考序列Wuhan-Hu-1。尽管报道了有限的α抗原变化,在实验室实验中观察到β、γ和δ从疫苗衍生抗体和恢复期血清中中度逃逸。尽管如此,流行病学研究提供的证据表明,针对δ和β的疫苗效力在很大程度上得以保持。因此,尽管设计基于非常早期的S蛋白序列,第一代新型冠状病毒疫苗对严重疾病提供了显著的保护,并让世界大部分地区恢复了表面上的正常。
Omicron“复合体”——包括不同的亚系BA.1、BA.2、BA.3、BA.4和BA.5(方框1)—能够感染已接种疫苗者和既往感染者,这给新型冠状病毒控制策略讨论带来了疫苗序列选择和通用疫苗的挑战。具有超过15个刺突受体结合结构域(RBD)突变和氨基末端结构域(NTD)中的大量抗原缺失和取代,BA.1、BA.2、BA.4和BA.5与第一代疫苗和感染前衍生抗体的中和作用非常差(图.1)。此外,已经证明了从绝大多数目前的治疗性单克隆抗体中逃逸出来;目前,只有bebtolovimab——一种针对刺突蛋白RBD的单克隆抗体——被报道保留了其对所有新型冠状病毒变种的疗效。这种大的抗原“转移”导致一些人提出,与前奥密克戎谱系相比,奥密克戎谱系应该被认为是一个独立的毒株或血清型。重要的是,这种抗原性变化的程度反映在针对感染和有症状疾病的真实世界疫苗有效性的数据中。需要加强剂量来维持任何针对奥密克戎的疫苗效力,奥密克戎随着抗体滴度下降而降低。事实上,在加强剂量后4个月,Omicron针对严重疾病的疫苗效力仍然很高,然后迅速下降,尽管下降速度没有初次接种后那么快。由于目前的疫苗对流感病毒感染的保护性免疫持续时间短,许多疫苗制造商和学者将注意力集中在第二代疫苗上,例如单价或二价流感病毒特异性加强剂(目前正在部署),鼻疫苗递送以刺激更强的粘膜免疫或者通用疫苗方法。与季节性人类冠状病毒一样,由于抗体减弱和病毒抗原漂移(允许免疫逃避的突变的增量获得)的共同作用,长期获得的免疫可以防止新型冠状病毒再次感染的程度是有限的。除了抗原性的逐步变化之外,持续感染期间的病毒进化使得新型冠状病毒在单次或几次长期感染的情况下积累了多种突变,当这些变体继续感染其他人时,促成了抗原性转变事件(方框1)。
图1:所关注的选定新型冠状病毒变体中氨基酸取代或缺失的性质。
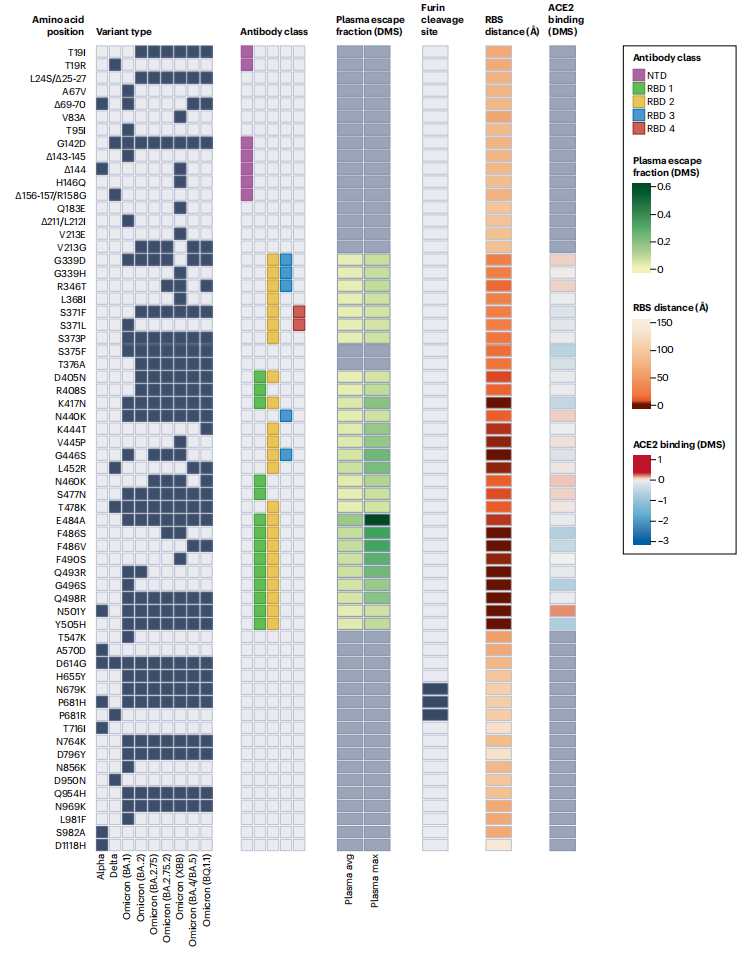
黑框表示相关变体中每个突变的存在。表位残基被着色以指示氨基末端结构域(NTD)超位点或受体结合结构域(RBD)类。对于RBD残基,深度突变扫描(DMS)研究的结果显示了每个突变体平均血浆(“血浆avg”)和最敏感血浆(“血浆max”)的逃逸分数(即,突变降低多克隆抗体结合程度的定量测量),说明突变效果的一致性或差异取决于个体抗体库的差异。弗林蛋白酶切割位点的突变被突出显示。橙色阴影表示与形成受体结合位点(RBS)的血管紧张素转换酶2 (ACE2)接触残基的距离。注意RBS被定义为与ACE2结合的RBD结构中ACE2原子相距< 4原子的残基(RCSB蛋白质数据库ID 6M0J。最后,ace 2-结合分数代表结合常数(log10 KD)相对于来自DMS实验的野生型参照氨基酸以红色或蓝色阴影显示。
新型冠状病毒变种出现中的FCS
与其他已知的sarbecoviruses相比,新型冠状病毒的一个独特特征是其刺突蛋白中存在FCS,该FCS可以被弗林蛋白酶切割。尽管如此,FCS仍然存在于许多其他的包埋冠状病毒亚属和Merbecovirus的β冠状病毒中,例如人冠状病毒OC43、人冠状病毒HKU1和中东呼吸综合征冠状病毒(图2a)。已经证明新型冠状病毒FCS对于人类气道细胞中的最佳病毒复制是至关重要的,遗传性和致病性。弗林蛋白酶是一种宿主蛋白酶,在高尔基体中最丰富,允许在病毒运输到细胞表面的过程中切割。然而,现在很清楚,早期新型冠状病毒变异体的FCS是次优的,不能被弗林蛋白酶有效切割。有趣的是,早期替代突变,刺突D614G的作用之一是适度增强的刺突切割(前面已详细讨论过3)。许多随后的新型冠状病毒变体在FCS附近含有突变,这增加了碱性氨基酸残基的数量——弗林蛋白酶的已知识别位点;例如,α、μ和Omicron含有FCS突变P681H。据预测,这将增加切割活性。此外,在同一位置的不同突变,P681R,增强了VOC的复制和致病性(图2b)。值得注意的是,Omicron包含P681H,以及进一步的突变N679K,这共同导致了优化的FCS。然而,重要的是,弗林蛋白酶位点优化本身并不能增强新型冠状病毒的传播性或复制性,而且可能不利于病毒的有效传播,表明在这些变体中看到的额外突变是优化复制和遗传性所必需的。
图2:弗林蛋白酶切割位点和变体成功。

a,野生型(WT)严重急性呼吸综合征冠状病毒2( (SARS-CoV-2) 和α、δ和ω变异体中的SARS切割位点序列与其他冠状病毒的比较:SARS-CoV、中东呼吸综合征冠状病毒(MERS-CoV)、人冠状病毒OC43 (HCoV-OC43)、HCoV-HKU1、HCoV-NL63和HCoV-229E。斜线表示假定的弗林蛋白酶/丝氨酸蛋白酶切割位点。对一元或多元裂解位点有贡献的氨基酸用阴影表示。b,相关变异体的S1-S2弗林蛋白酶切位点(FCS)的估计相对优化的图示。指出了影响FCS功能的突变。请注意,不一致的结果已经观察到奥密克戎,如所示。未来变型的FCS优化水平不确定。参考文献中关于Alpha的数据。
观察到的FCS突变增强弗林蛋白酶切割的确切机制仍然是一个有争议的话题。尽管有相当强的证据表明P681R直接增强弗林蛋白酶结合和S1-S2位点的切割,P681H的功能性结果不太清楚。从机理上讲,可能与位于残基P681附近的刺突蛋白的T678位置相关,可以用O-连接的糖基化位点进行翻译后修饰。已知下游脯氨酸促进O-连接的糖基化;因此,另一种解释可能是P681的去除,而不是组氨酸本身的添加,导致潜在的弗林蛋白酶阻断糖基化位点的丢失和相关的切割增强。
最近对奥密克戎生物学的深入了解挑战了增强刺突切割对增加病毒传播至关重要的假设。所有Omicron谱系都包含P681H和N679K,它们单独或一起增强野生型刺突蛋白中S1-S2位点的切割。然而,在完整的Omicron刺突蛋白的背景下,这种切割改善的证据不太清楚,一些研究发现,S1-S2连接似乎比以前的VOCs切割得更差,而其他的显示出与Delta相当的切割效率。不管切割表型如何,许多小组已经描述了Omicron如何能够有效地利用替代的细胞进入途径。事实上,以前的VOC如Delta高度依赖于细胞表面跨膜蛋白酶丝氨酸2 (TMPRSS2)的融合引发,Omicron也能够以类似于SARS-CoV的方式被内体蛋白酶如组织蛋白酶有效引发。至少在啮齿动物模型中,这种替代机制被认为是奥密克戎严重性降低的部分原因,由于较低的融合性和潜在的组织嗜性改变,与下呼吸道相比,更倾向于上呼吸道感染。几项研究提出了这种降低融合性和改变进入途径的分子机制,包括奥密克戎的S蛋白RBD突变,H655Y或者S2区域的突变,具体是N969K,尽管这一特征是否在所有的奥密克戎血统中都是保守的还存在争议。尽管如此,奥密克戎血统也继续表现出高遗传性,至少相当于德尔塔,这意味着弗林蛋白酶切割效率和融合性及其对病毒传播的贡献之间潜在的分离。
除了S1-S2位点,β冠状病毒还需要切割第二个蛋白酶切割位点,称为S2’位点。随着S1-S2位点和同源受体结合的切割,S2位点暴露在刺突蛋白的S2结构域中。S2’的切割直接释放融合肽,导致病毒-宿主膜融合。对于进入气道细胞的新型冠状病毒,该位点优先被宿主丝氨酸蛋白酶如TMPRSS2切割,但也可以被溶酶体组织蛋白酶切割。许多最近的文章表明,新型冠状病毒NTD的变异,特别是通过获得缺失或插入而重塑外环,可以变构地影响S1-S2切割和S2切割,从而影响融合。
总的来说,蛋白酶的使用,S1-S2切割效率,新型冠状病毒的嗜性,致病性和遗传性之间的关系非常复杂,有时,研究结果不一致。因此,需要进一步的工作来弥补这些知识上的差距,并充分理解这一系统。
其他结构和非结构蛋白质和传染性
最近的几项研究调查了除刺突蛋白以外的结构蛋白突变的后果,包括膜蛋白(M)、包膜蛋白(E)和核衣壳蛋白(N)。B.1.1谱系是由N蛋白中的一对取代物定义的——R203K和G204R。衍生自B.1.1的变异体(如α、γ和Omicron)继承了相同的突变,而δ和β分别独立进化出R203M和T205I,具有趋同的功能特性。具体来说,这些突变已被证明增加了病毒的传染性,尽管确切的作用机制仍有争议。一方面,来自基于病毒样颗粒的报道基因分析的数据表明这些突变直接增加了病毒颗粒的形成,而另一份报告表明N蛋白磷酸化的作用允许逃脱激酶GSK3的限制。另一种解释是R203K和G204R突变在N基因中间引入了一个新的转录调节位点,允许表达截短形式的N蛋白(称为“N*”或“N.iORF3”),这可能通过增强干扰素拮抗作用来增强病毒的传染性。有趣的是,还有几个新型冠状病毒谱系进化出新的转录调节位点序列的例子,这些序列可以导致截短的蛋白产物在框内或框外表达,最突出的是非结构蛋白16 (NSP16)。
除了N蛋白,M和E蛋白的突变也与调节新型冠状病毒的传染性有关。BA.1 (Omicron)的M和E蛋白中的取代已经显示减少了病毒样颗粒的细胞进入,尽管这些突变通过S和N蛋白中的进一步取代得到补偿。冠状病毒E蛋白具有多种功能,其中之一是作为阳离子通道,潜在地在内质网(ER)和高尔基体区室中调节病毒生命周期的多个阶段。已经证明在Omicron E蛋白中发现的T9I突变在体外减弱了这种离子通道活性,尽管其功能性后果尚不清楚。
虽然ORF1ab占新型冠状病毒基因组的三分之二,但它仍然是变异突变影响了解最少的区域。一个例外是NSP6中106-108位的缺失,这种突变在除δ以外的所有VOCs中是保守的。NSP6是一种多通道跨膜蛋白,与冠状病毒复制细胞器的形成有关,这种细胞器是在感染过程中产生的内质网衍生的膜结构,为病毒RNA复制提供了一个不受先天免疫影响的隔间。最近的一项研究表明,NSP6形成同源二聚体,并介导形成“拉链状内质网”——连接“双膜囊泡”的狭窄和排他性膜通道,双膜囊泡是病毒基因组复制的主要场所。作者发现NSP6中106–108的缺失特别增强了这种拉链状内质网的形成,表明了一种潜在的宿主特异性适应。这种增强的确切机制仍有待阐明,尽管研究作者假设这种缺失去除了一个推定的O-连接糖基化位点。目前还不清楚为什么Delta和其他几个变异体从未被观察到获得这种适应性,尽管这种缺失很容易发生。
除了结构蛋白和ORF1ab蛋白之外,有一些非常有限的证据显示辅助蛋白的适应性变化,这将在本综述的后面部分介绍。不幸的是,新型冠状病毒变异体中非刺突突变和任何相关的人类适应性的实验特征仍然远远落后于刺突蛋白。这是由于许多因素,包括用于研究刺突表型的假病毒技术的普遍存在,与反向遗传学的技术复杂性(通常需要对非刺突突变进行病毒学研究)相比,以及用于研究非刺突蛋白的体外系统的缺乏。目前的工作清楚地表明,非刺突适应在很大程度上有助于病毒的适应性和致病性,继续开发研究这些区域的系统对正在进行的研究至关重要。
T细胞反应和抗原逃逸
T细胞是对新型冠状病毒感染的适应性免疫反应的主要部分,具有丰富的CD4+T细胞和CD8+在大多数感染个体中观察到的T细胞反应。几项研究表明T细胞免疫在保护免受严重新冠肺炎感染中的重要作用,尽管这可能比中和抗体反应的保护免受感染的充分表征的相关性更微妙和复杂。虽然CD4+辅助性T细胞应答可能对抗体生成具有广泛的重要性,在中和抗体应答减弱或尚无法检测的情况下,T细胞在降低疾病严重程度中的重要性可能相对更重要。新型冠状病毒特异性T细胞的早期诱导在轻度感染中比在重度感染中更常见和CD8+T细胞在减少B细胞缺乏患者的严重后果方面可能特别重要。此外,完整功能的CD8+在第一剂mRNA BNT162b2疫苗(Pfizer-BioNTech)后1周,当中和抗体未被完全诱导时,T细胞反应被激活,这增加了早期疫苗诱导的保护可能主要依赖于T细胞的可能性。
鉴于T细胞在新型冠状病毒免疫中的整体作用,选择性压力有可能导致T细胞逃逸,尽管目前对新型冠状病毒突变影响T细胞的程度知之甚少。功能性T细胞应答针对多种病毒蛋白,应答的强度与病毒蛋白表达水平相关。对刺突蛋白、N蛋白和M蛋白的反应占主导地位,对ORF3a和非结构蛋白NSP3和NSP12也有明显的反应。由于T细胞反应靶向新型冠状病毒基因组中的表位,T细胞逃逸的足迹比抗体驱动的变化分布更广,抗体驱动的变化集中在刺突蛋白的优势表位内(图.3)。很少有研究记录了T细胞表位的宿主内进化,这可以作为T细胞逃逸的直接证据。CD8内的突变+在一项研究中,在急性感染过程中,在少数变异体中发现了N蛋白(M322I和L331F)、M蛋白(L90F)和刺突蛋白(L270F)中的表位,导致表位特异性反应的丧失。免疫受损宿主中长时间的新型冠状病毒感染可能为T细胞逃逸提供更大的机会,类似于HIV-1感染中广泛描述的例子。NSP3 T504P突变的出现导致CD8的丢失+据报道,在慢性新型冠状病毒感染背景下,体液免疫缺陷受损但T细胞反应保留的多个个体中存在表位反应。这些发现仅限于少数病例,表明需要更多的前瞻性队列研究来系统地评估某些患者群体中T细胞逃逸的风险。
图3:新型冠状病毒变异体对T细胞反应和先天免疫的潜在影响。
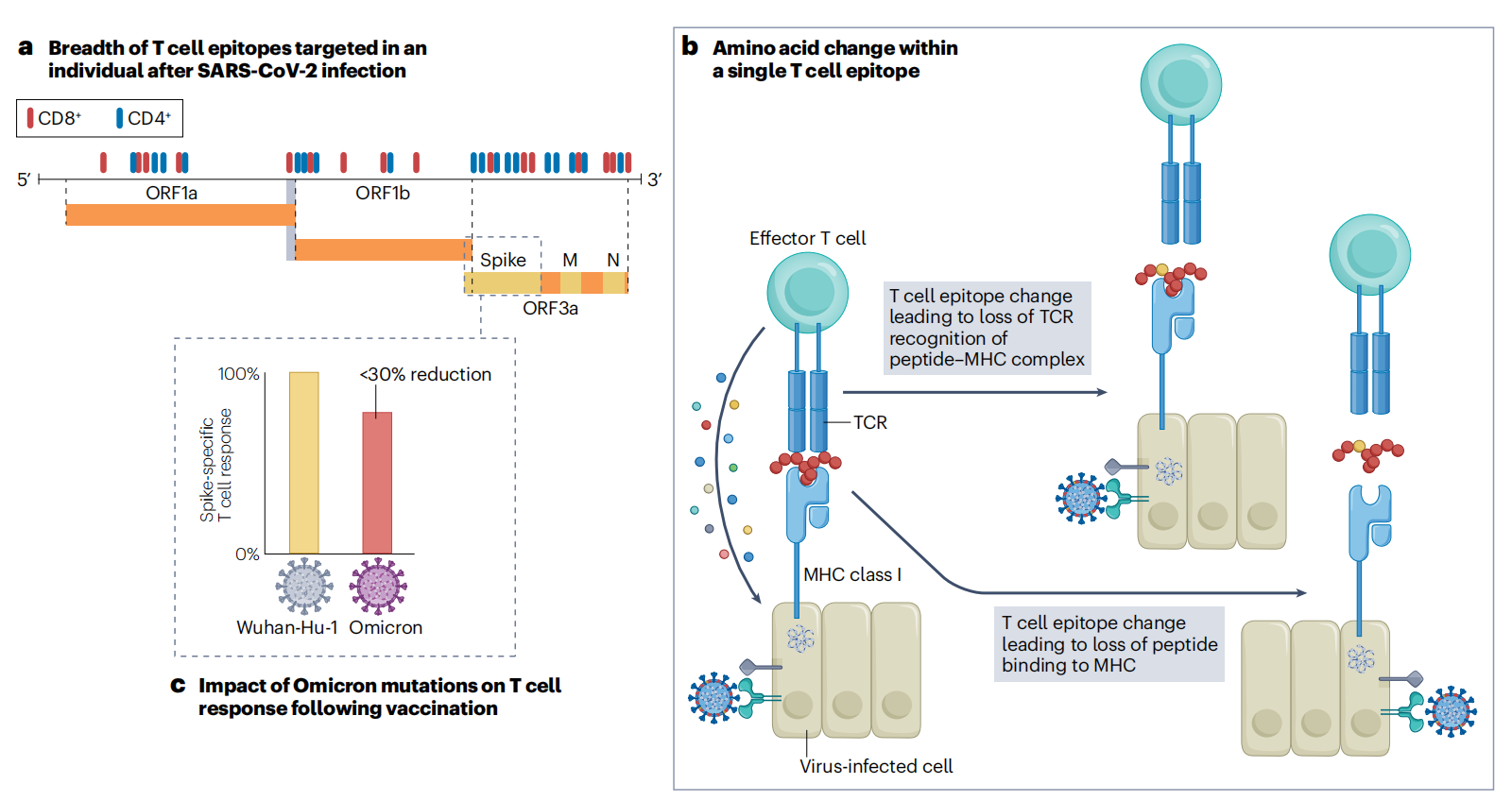
a严重急性呼吸综合征冠状病毒2( (SARS-CoV-2) 感染后,CD4+T细胞和CD8+针对病毒基因组中30-40个表位产生T细胞反应(表位以红色和蓝色显示)。b一个表位内的氨基酸变化如何影响表位特异性细胞毒性T细胞应答,从而抑制病毒感染细胞的清除的例子。T细胞逃避新型冠状病毒已被证明是主要组织相容性复合体(MHC)的肽结合受损或T细胞受体(TCR)与肽-MHC复合体结合不良的结果。c虽然对疫苗接种的T细胞反应仅集中在刺突蛋白上,但即使在关注的Omicron变体中的多个刺突突变也仅降低了不到30%的疫苗诱导的刺突特异性T细胞反应,具有相当大的个体间差异。
免疫显性ORF3a和N蛋白CD8+中的几个突变导致识别完全丧失的T细胞表位在多个新型冠状病毒谱系中独立出现。其中有N蛋白P13L,它存在于B*27:05限制性CD8+分子内表位。假设VOC出现在慢性感染中,很容易推测除了可能由抗体压力驱动的S蛋白突变星座之外,在Omicron VOC中P13L的存在反映了由于慢性感染期间T细胞压力引起的选择。在δ、ε、κ和BA.4/BA.5变体刺突蛋白中发现的L452R导致A*24:02限制性CD8+的丢失反应。S蛋白P272L替换已经在全球多个家系中出现,并导致显性HLA A*02:01限制性CD8+的丢失抗原决定基。除了抗体逃避和增强ACE2结合亲和力之外,T细胞在驱动这种变化中的作用尚不确定。与特定CD4丢失相关的VOCs中的其他S蛋白突变+反应包括β中的L18F、D80A和D215G,以及α中的D1118H。这些观察结果在多大程度上也代表了其他压力驱动的突变对T细胞反应的附带影响,目前尚不清楚。
尽管失去了这些特异性反应,但几项研究表明,由感染和第一代疫苗诱导的总体T细胞反应针对大多数VOC得以保留。即使Omicron刺突蛋白中的广泛突变也仅导致总CD4+的不到30%的适度减少和CD8+反应,有相当大的个体差异。大多数高频率峰值CD4+表位反应集中在NTD的离散区域、羧基末端和融合蛋白区域,在RBD中很少。没有明显的CD8+热点表位。在许多 VOCs 中发现的集中在S蛋白RBD和NTD的突变被认为是由抗体逃避和增加的ACE2结合亲和力驱动的,因此可能对整体T细胞反应的影响有限。因此,大多数T细胞表位在不同的VOC中是保守的,这可能有助于保持疫苗对住院和死亡的有效性,与未接种疫苗相比,在第二剂和第三剂后观察到这种效果。
变异体对T细胞免疫产生适度影响的另一个关键原因是产生了广泛的反应,感染后每个个体对30-40个表位产生反应。在群体水平上,由于人类HLA基因中存在大量多态性,T细胞反应的异质性也远远大于抗体免疫。然而,在个体水平上,锋电位特异性CD8+的显著减少据报道,约15%的恢复期和接种过疫苗的献血者对奥密克戎有反应另一项研究指出CD4+损失超过50%T细胞和CD8+约20%受试者的T细胞反应。尽管这些结果的普遍性受到小样本量和所研究人群的HLA分布的限制,但它强调了 VOCs 对某些仅通过疫苗接种产生S蛋白特异性免疫的个体的T细胞反应的潜在影响。
与T细胞大量逃逸相比,抗体逃逸和传播能力增强似乎仍将是新出现 VOCs 的更大驱动因素。作者是否会看到CD8+缓慢而连续的丢失随着时间的推移,表位很难预测,类似于H3N2流感的长期适应。T细胞逃逸可以通过几种机制发生。表位或侧翼区内的氨基酸变化会破坏抗原加工,锚定残基的变化会干扰主要组织相容性复合体(MHC)与表位的结合。这两种机制都可能导致T细胞对特定表位的不可逆反应性丧失。相反,损害T细胞受体与肽-MHC复合物结合的变化会导致部分或完全逃逸。后一种情况也可以通过使用替代性T细胞受体库的从头T细胞应答来克服,如先前在HIV-1感染中所述。
除了潜在的T细胞逃逸,新型冠状病毒病毒像许多其他病毒一样,直接下调感染细胞上MHC类(MHC-I)的表达,以逃避T细胞的识别,对辅助蛋白ORF8。ORF7a(以及ORF3a和ORF6,也被报道下调MHC-I,尽管还不清楚这是一种特定的效应还是仅仅是非特异性高尔基体断裂的结果。最近的工作表明,在VOCs中常见的取代不会改变ORF8抑制MHC-1表达的能力,除了α中氨基酸27的过早终止密码子,导致ORF8的截短的无功能形式的表达。尽管ORF8被截短,但在感染的情况下,α仍然下调MHC-I的表达,这意味着这种变异体,或更普遍的可能是新型冠状病毒,已经进化出多余的机制来抑制这种途径。
先天免疫和新型冠状病毒变异体
先天免疫是宿主防御病原体的一个组成部分,在早期病毒控制和适应性免疫反应的调节中起着关键作用。先天免疫应答对新型病毒(如人畜共患病原体)尤其重要,因为通常没有预先存在的适应性免疫。令人惊讶的是,尽管最近在具有典型的不同先天免疫系统的远亲宿主物种中成功复制和传播,但新的人畜共患病毒通过有效拮抗先天宿主防御而有效地在人类之间传播。人类先天免疫系统的稳健性的一个结果是,导致大流行的人畜共患病病毒的比例极低,在新型冠状病毒宿主物种中进化的特性,特别是广泛的宿主嗜性(碰巧包括人类),加上在刺突蛋白中获得其FCS,可能在中间宿主物种中,是启动新冠肺炎疫情的关键特征。值得注意的是,相关的SARS病毒SARS-CoV并不在人群中存在,尽管也具有高度传染性,其根除归因于与新型冠状病毒相比更少的无症状传播,使得更容易识别感染。重要的是,随着新型冠状病毒VOC的出现,很明显它们正在获得更有效感染人类的适应性,这部分是通过增强先天免疫逃避。的确,α和最近的 VOCs对干扰素的敏感性降低,这与病毒在人类中传播的关键选择压力相一致。令人惊讶的是,α和β亚系BA.4和BA.5不是适应于特异性拮抗人类蛋白质,而是通过上调先天免疫抑制性病毒蛋白质,特别是ORF6蛋白质的表达而部分实现了这一点。ORF6抑制转录因子的核转运,包括STAT1和IRF3,它控制抗病毒蛋白和可溶性促炎介质的表达。α也增强了ORF9b的表达(其抑制RNA感应下游的信号传导)和N蛋白(其隔离病毒RNA以防止感应机制的激活),以及N*/N.iORF3的重新表达——N蛋白的氨基末端截短形式,表现出一定的干扰素拮抗作用,但表达水平较低。这些蛋白水平的增加可能是调节亚基因组RNA合成和蛋白表达的调控区突变的结果。这突出了刺突蛋白以外的变化在决定VOC性质中的重要性,特别是在调控区域。关键的是,预期影响αN蛋白和重叠蛋白ORF9b表达的N蛋白科萨克序列中的突变也出现在显性VOCs Delta和Omicron中,但它们对这些VOCs中先天免疫拮抗作用的全面影响仍有待确定。新型冠状病毒和先天免疫之间的关系非常复杂。例如,病毒拮抗剂ORF9b似乎通过宿主激酶的磷酸化而受到负调节,这表明它的先天免疫抑制可能在感染期间的某个时间点被关闭,也许是在感染细胞中引发宿主反应之后。这种炎症转换机制本质上调节宿主对感染的反应,可以通过改变细胞活化来驱动症状学和随后的病毒传播。
迄今为止,至少有15种新型冠状病毒蛋白被认为有助于对抗先天反应。这些蛋白质通常通过报道分子筛选进行鉴定,其中感兴趣的新型冠状病毒蛋白在模拟的体外先天免疫反应中表达,并评估其拮抗该反应的能力。这种实验通常不能提供机理上的见解,但在发现新的蛋白质功能方面是有效的。几种VOC在许多涉及先天免疫系统拮抗剂的蛋白质中表现出氨基酸变化,包括NSP1、NSP3、NSP6、ORF3a、ORF6、ORF7b、ORF8和N蛋白。在大多数情况下,这些编码突变是否反映了更好地拮抗人类先天免疫的适应仍有待确定。此外,这些蛋白质对VOC表型的贡献知之甚少,因为这需要使用反向遗传学艰苦地产生同基因突变体,并评估它们对复制、干扰素产生和敏感性的影响。
除了减少干扰素的诱导外,α和VOCs对其抗病毒作用的抑制更有抵抗力。这被最好地描述为与降低对干扰素诱导的跨膜(IFITM)限制因子的敏感性的S蛋白适应有关。IFITM蛋白在新型冠状病毒复制过程中的确切作用是有争议的,一些研究表明,IFITM蛋白以类似于流感的方式抑制新型冠状病毒的细胞进入,而其他人认为,在某些情况下,它们以类似于OC43和HKU1的方式增强感染。IFITM蛋白的确切作用可能是上下文特异性的,例如特定病毒在给定细胞类型或细胞系中使用的特定进入途径、活病毒对假病毒的使用以及IFITM蛋白的表达水平。IFITM家族成员是小的干扰素刺激的跨膜蛋白,与不同的细胞膜相关;人IFITM1通常与细胞表面膜相关,而IFITM2和IFITM3则分别定位于晚期和早期内体。IFITM蛋白影响病毒进入的确切机制还没有完全解决,但认为与抑制病毒糖蛋白与宿主膜的融合有关。几种 VOCs 对IFITM蛋白抑制或增强具有不同程度的敏感性,通常与特定的进入途径或弗林蛋白酶切割表型有关。例如,Omicron在内体进入方面比早期变体和其他VOCs更有效,似乎显示出内体IFITM蛋白更强的抑制作用(或在某些情况下增强),尽管这似乎高度依赖于所用的细胞系统。这可能是由于Omicron由于适应性免疫逃避而不得不妥协先天逃避,特别是在疫苗诱导的刺突抗体的情况下,或者不得不适应使用IFITM蛋白作为进入的辅因子。
目前尚不清楚先天免疫的拮抗作用如何影响病毒传播。作者假设新型冠状病毒病毒有效传播的能力与其在呼吸道中遇到病毒的第一个细胞中逃避和拮抗先天免疫反应的能力密切相关。事实上,感染事件的效率预计会影响病毒通过呼吸道的传播,从而影响播散生产性感染的可能性。I型干扰素应答已被证明在决定其他病毒的感染效率和结果方面是重要的,并且已被很好地表征为猕猴的慢病毒感染。
最后,目前每种 VOCs 都是从疫情早期传播的祖先病毒独立进化而来的,这意味着每种 VOCs 都采取了不同的突变途径来获得对人类的不同适应。因此,VOCs,或者实际上新型冠状病毒的其它变体,可能会潜在地重组,以联合独立编码的适应,从而获得来自不同变体基因组的表型优势(方框2)。
决定传播和适合度的抗原距离
不断变化的群体免疫力为病毒变体创造了一个动态的适应环境,因为它们的适应能力既取决于获得性免疫,也取决于它们的独特突变集。尽管豁免的广度和持续时间等复杂性是重要的考虑因素,通过感染和/或接种疫苗暴露于新型冠状病毒病毒的人的累积数量,导致人群对大多数循环(和过去)变异体的易感性低得多,免疫初始、完全易感宿主的数量不断减少(图.4)。
图4:英国自2020年初以来的主要新型冠状病毒变种、疫苗接种、感染和死亡。
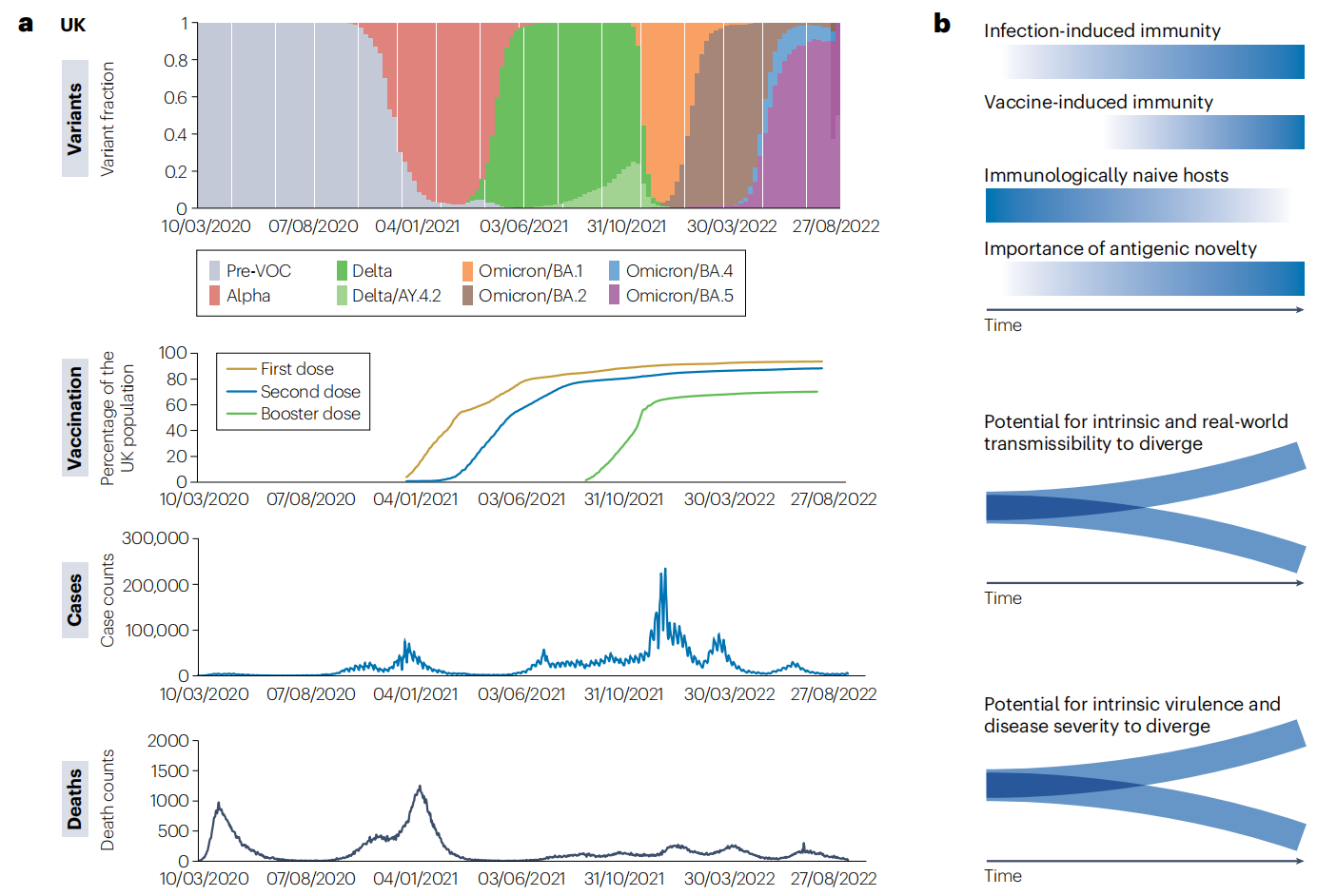
a英国显性变异体的波动(B.1、B.1.1.7/Alpha、B.1.617.2/Delta、AY.4.2/Delta和Omicron亚系BA.1、BA.2、BA.4和BA.5)、接受一剂或两剂加强疫苗接种的英国人口比例、新冠肺炎病例数和报告的新冠肺炎相关死亡数。b变体传递性、抗原性、毒力和适合度之间的动态关系的图解可视化。随着来自感染和疫苗接种的群体免疫力增加,完全免疫的初次宿主的比例下降(梯度蓝线)。因此,抗原的新颖性在决定变异体适合度的重要性增加。与以前流行的变异体的抗原距离成为变异体遗传性的一个越来越重要的决定因素,增加了内在和现实世界遗传性差异的可能性。类似地,抗原距离影响变异体在免疫宿主中感染和致病的可能性,增加变异体内在毒力偏离其真实临床影响的可能性。VOC,受关注的变体。
在新冠肺炎疫情早期,当原始宿主的比例最大时,相对于野生型变异体,抗原新颖性的进化益处很少。取而代之的是,通过适应内在的生物学特征,如D614G引起的刺突蛋白的构象变化,PANGO谱系B.1的决定性突变,或增强的弗林蛋白酶切割表型,再加上α-干扰素诱导蛋白所表现出的增强的ACE2结合,选择偏爱能够最大化繁殖成功的变异体。随着宿主群体免疫力的增加,相对于内在的生物学变化,变异体的抗原新颖性在其繁殖成功中起着越来越重要的作用。随后,Delta VOC在全球范围内占主导地位,取代了以前在疫苗接种覆盖率为中高水平的部分免疫人群中的变异体。病毒中和数据表明VOC对中和抗体的中度免疫逃逸和疫苗有效性数据表明,抗原的新颖性不是增加传染性的主要驱动力,表明Delta的高适合度更多地是内在病毒特性的结果,例如刺突弗林蛋白酶切割的优化。
与以前的变体相比,Omicron表现出前所未有的抗原新颖性,可以说相当于流感样抗原转移事件。这里的“转变”,即导致抗原距离的突变的积累,可能至少部分发生在慢性感染的情况下(方框1)。比较接种疫苗和未接种疫苗家庭内的传播动态表明,免疫逃逸是Omicron (BA.1)相对于Delta在共循环期间传播性增加的关键组成部分。Omicron亚系BA.2已被证明更有能力感染未接种和接种的个体,这可能是由与BA.1相似的免疫逃避特性驱动的,但具有更高的内在传递性。最近,BA.4、BA.5、BA.2.75及其亚系不仅表现出比前Omicron变异体更强的免疫逃避,而且表现出逃避先前Omicron,特别是BA.1感染产生的免疫。这在很大程度上归因于抗原性强的RBD位置的突变,特别是BA.4/BA.5的例子中的L452R和F486V。尽管仍有进一步优化新型冠状病毒在人类中传播的潜力,但现在看来,新出现的变异体的抗原新颖性和免疫逃避性将是变异体适应性和进化成功的主要决定因素。因此,理解变异之间交叉保护的复杂性是一个主要的研究重点。
新型冠状病毒变异的相对严重性
有必要了解新型冠状病毒变异体的毒性可能如何进化以应对不断变化的选择压力。病原体毒力,连同免疫、个体易感性、疾病易感性和其他宿主因素,是疾病严重性的主要因素,并且在进化文献中被定义为由于感染导致的个体发病率和死亡率的增加。在宿主群体中,毒力不一定随时间而降低,相反,模型数据通常显示传播率和毒力之间的权衡。然而,毒力进化的可预测性由于几种机制而变得复杂,包括宿主内的竞争、变化的传播途径和趋向性以及与免疫系统的相互作用。例如,作为抗原性进化病原体的特征的反复流行波,可以选择更高的病原体毒性。尽管有可能比较在给定时期内感染相同人群的变异体的疾病严重程度,但由于整个疫情不断变化的免疫状态和医学干预的发展,通过疾病严重程度评估新型冠状病毒变异体的相对毒力具有挑战性。这种方法表明,连续显性新型冠状病毒变异体之间疾病严重程度的变化方向不一致:当α取代B.1.177,δ取代α时,成功的变异体表现出疾病严重程度增加,与遗传性的相对变化相关。相比之下,Omicron在与Delta共存期间表现出疾病严重性的降低,这种降低似乎反映了一种复杂的因素组合,包括具有一定程度既往感染的人的较高感染率和固有的较低毒力。对Omicron感染的较低疾病严重程度的建议解释包括刺突蛋白的融合性降低,导致较少的组织损伤,以及更多地限制在上呼吸道的改变的趋向性(由于TMPRSS2使用的改变)。这些先前的研究比较了同一人群中存在的变异体的毒力,尽管它们不能确定在具有不同免疫状态的人群中传播的非重叠变异体的“内在”毒力,例如α和ω。鉴于个体的免疫状态除了影响感染的可能性之外,还影响症状的严重程度,既往暴露和变异体之间的抗原“距离”有可能促进受保护个体发病,这代表了造成伤害的内在潜力和受感染者的实际毒力之间的潜在差异。
测量新型冠状病毒变异体严重性的补充方法包括使用动物模型。常见的动物模型包括原始啮齿动物,如在角蛋白18启动子控制下表达人ACE2的转基因小鼠(在上皮细胞中大量表达)或仓鼠,其天然表达的ACE2蛋白被所有当前的新型冠状病毒VOC有效利用。在这些啮齿类动物模型中,致病性通常作为体重减轻百分比的函数来测量,有时还使用存活曲线和肺功能测量。这些啮齿动物模型在很大程度上概括了来自人类流行病学研究的等效严重性数据,例如Delta比早期变体更具致病性,Omicron比Delta更不具致病性。然而,这些模型有一些局限性,例如最近来自香港的流行病学证据表明,Omicron亚系BA.2表现出与第一波变异相似的疾病严重程度,而啮齿动物模型通常显示奥密克戎没有以前的变种严重。这种不一致可以用新型冠状病毒对人类宿主的持续适应来解释,这导致了远离啮齿动物和其他动物模型的伴随适应。
新型冠状病毒感染后的疾病严重程度与几个风险因素相关,包括高龄、男性和临床共病,如肥胖和免疫缺陷,以及几个炎症标记物。正如在其他地方回顾的那样,最近的几项遗传研究集中在一些特征上,这些特征可以解释为什么一些人更容易感染新型冠状病毒病毒,而另一些人则出现更严重的症状。然而,迫切需要将这些发现与可能直接影响观察到的表型的特定变异和干预(即疫苗、药物和单克隆抗体)的数据结合起来。此外,尽管急性感染最常见和最容易测量的结果是住院或死亡,但更难测量的结果在不同变异中也有很大差异,如原发症状学、或急性后新冠肺炎综合征,尽管这些也可能因先前的免疫状态而有很大不同。
结论
新型冠状病毒已经在人群中传播了3年,感染了数亿人。然而,它仍然是一种相对较新的人类病毒,继续进化并适应其新的宿主物种。全球生成的前所未有的新型冠状病毒基因组序列数据集揭示了实时产生的有益突变的证据,并指导了实验室实验,以更好地理解病毒和宿主之间相互作用的内在特性。尽管作者对新型冠状病毒生物学有着非凡的了解,但病毒适应性是高度动态的,新型冠状病毒在人群中感染、复制和传播的能力明显取决于疫情不同时期的特定免疫环境。目前,Omicron在全球范围内占主导地位,感染由紧急BA.2和BA.5亚系驱动。尽管作者对新型冠状病毒的了解正在提高,但病毒进化本质上是不可预测的,未来可能出现一种新的VOC,其抗原性和表型可能与早期的Omicron不同。与此同时,人群对新型冠状病毒的免疫力继续积累,并可能在未来出现更严重的变异时得到很好的补偿,导致较温和的急性疾病。
所有的VOC祖细胞都是从第一波疫情期间出现的前VOC病毒进化而来,采取不同但通常趋同的途径来更有效地在人群中感染和传播,并抵抗抗体、T细胞驱动的免疫和先天免疫。正如作者在这篇综述中所讨论的,所需的适应是通过内在病毒特性和逃避先天或适应性免疫对宿主进行改变的混合物(方框3)。流行的假设是,变异源于免疫受损个体的慢性感染,其中病毒能够因免疫功能受损而建立持续感染。这个假说解释了在新的变异出现之前看似快速进化的阶跃变化。然而,应该注意的是,未来的变体可能直接来源于以前或当代的 VOCs ,最近的例子是大量来源于BA.2的“第二代”六聚体变体,如BA.2.75、BJ.1和BA.2.10.4。虽然线内重组为病毒提供了从远亲循环变异体获得附加适应和表型优势的机会,但在XBB出现之前,重组体目前对疫情的进程仅产生了微小的影响(方框2)。此外,尽管目前在动物宿主物种中建立长期循环和进化的证据非常有限,但随着反向人畜共患病的记录,需要对易感物种进行密集和积极的监测。有许多测序能力较低的国家,或以前监测良好的地方正在减少或完全淘汰测序。这很麻烦,因为缺乏基因组监测将意味着未来的变异将很晚才能被检测到,或者在最终检测到之前可能以低水平传播。因此,需要广泛和公平的监测范围,以在这些个人和社区中快速检测潜在的新 VOCs ,以免它们更广泛地传播。
方框3适合性和抗原性
达尔文适应性通常被称为“适合度”,不同于复制适合度:病毒产生感染性后代的能力,在培养的细胞、组织培养物或个体宿主中进行实验测量。相比之下,健康的广义定义是繁殖成功,因此它高度依赖于环境,经常随时间和地点而变化。给定的严重急性呼吸综合征冠状病毒2型( (SARS-CoV-2) 变异体的适应性将取决于其在其中传播的宿主群体的不断变化的免疫特征,并且个体变异体的成功与病毒群体内竞争变异体的特性和随机取样过程有关。随着宿主群体中免疫力的增加,这些条件可以导致以前高度传播的变异体,如在免疫初始群体中,现在相对于更进化的变异体不太适合(图.4b)。尽管内在传播性因此仅基于病毒的生物学特性,但实际传播性取决于群体免疫中的这些特性,包括宿主对过去接触的免疫、变异抗原性和随机效应的相互作用。此外,尽管变异体的相对抗原性(它们刺激的免疫反应水平)可能不同,但与其他变异体的抗原性相似程度的差异通常具有更大的影响。随着宿主群体中免疫力的增加,变异体与先前传播的变异体的抗原距离可以决定其感染、在宿主内复制和在宿主间传播的能力。因此,抗原新颖性的进化成为变异繁殖成功和适合度的关键决定因素。
Carabelli AM, Peacock TP, Thorne LG, Harvey WT, Hughes J; COVID-19 Genomics UK Consortium; Peacock SJ, Barclay WS, de Silva TI, Towers GJ, Robertson DL. SARS-CoV-2 variant biology: immune escape, transmission and fitness. Nat Rev Microbiol. 2023 Mar;21(3):162-177. doi: 10.1038/s41579-022-00841-7. Epub 2023 Jan 18. PMID: 36653446; PMCID: PMC9847462.
https://wap.sciencenet.cn/blog-55647-1377142.html
上一篇:349.老年人呼吸道合胞病毒融合F蛋白疫苗
下一篇:351.辉瑞和BioNTech启动首个基于mRNA的带状疱疹疫苗项目的1/2期研究