博文
Cell: 糖酵解副产物丙酮醛促进癌症发生的新机制
|
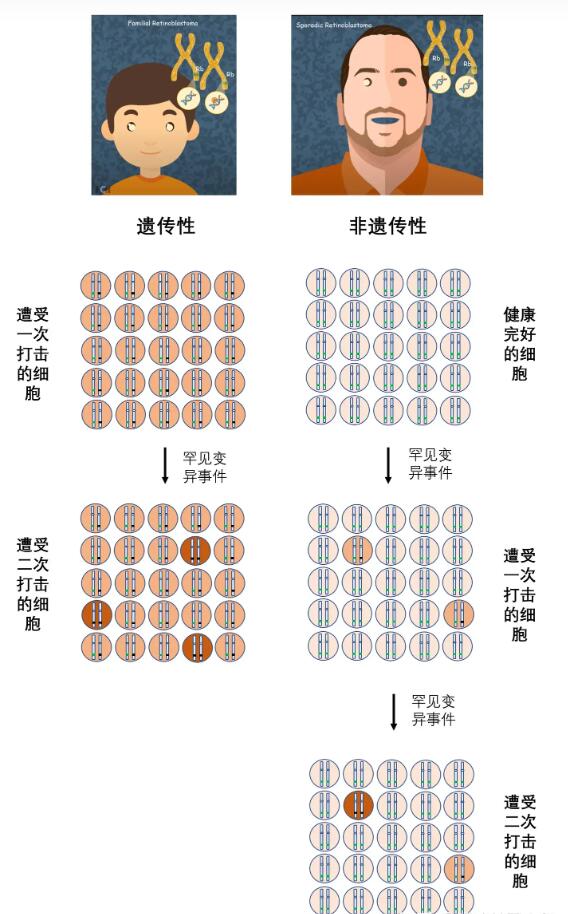
1971年,美国遗传学家Alfred Knudson提出了肿瘤领域著名的“二次打击”假说(two-hit hypothesis, 发表于PNAS;68 (4) 820-823, https://www.pnas.org/doi/abs/10.1073/pnas.68.4.820 ),从遗传上解释了癌症产生的重要机制。简单来说,个体的不同基因会拥有两个拷贝,一条来自父亲、一条来自母亲,对抑癌基因来说也不例外。如果个体从亲代任何一方遗传到了特定抑癌基因的一条突变拷贝,那么它就遭受了“第一次打击”;在往后的日子中,由于环境、饮食或内部自发的影响,抑癌基因的另一条拷贝也发生突变,那么则形成“第二次打击”。 针对抑癌基因的“二次打击”会使得细胞周期紊乱,导致细胞异常增殖。比如BRCA2就是一种经典的抑癌基因,它参与着DNA损伤反应、转录和细胞周期调节,同时它的突变会使个体患乳腺癌、卵巢癌的风险急剧增加。
然而,近日发表于Cell期刊的论文“A glycolytic metabolite bypasses “two-hit” tumor suppression by BRCA2”发现,体内存在的特殊机制可以打破这一经典的肿瘤发生范式。葡萄糖代谢的糖酵解的副产物——丙酮醛(methylglyoxal,MGO)会绕过“二次打击”来促使癌症发生,它能够直接使BRCA2蛋白失活,而不需要BRCA2突变来实现细胞癌变。
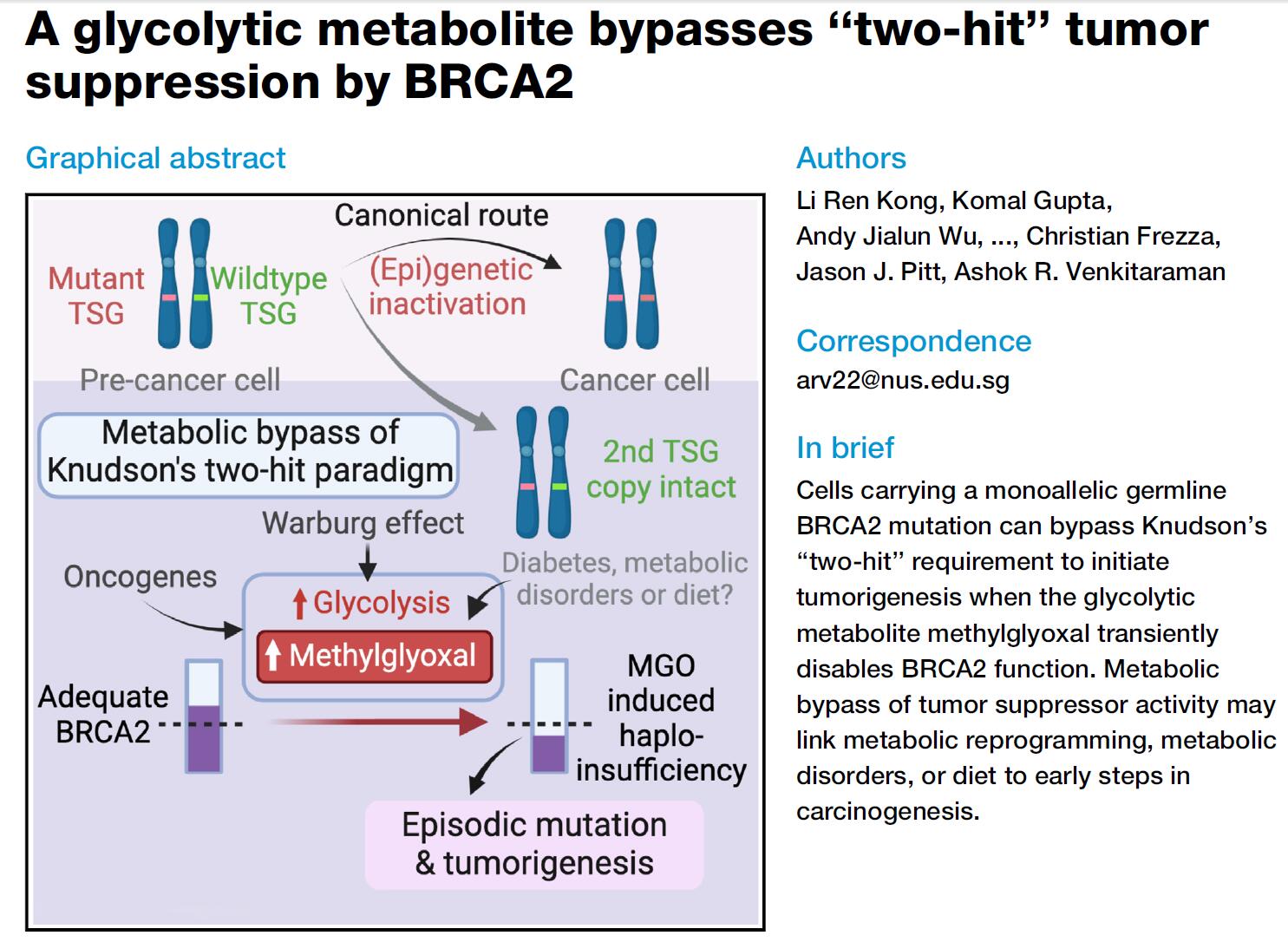
该研究发现,那些已经具备一条BRCA2突变拷贝的个体,他们的细胞会对丙酮醛更加敏感。本文的通讯作者,新加坡国立大学的Ashok Venkitaraman教授指出,丙酮醛水平较高的个体患癌风险要更高。此外,丙酮醛在糖尿病、肥胖以及饮食不健康人群中有着更高水平,高血糖引起的丙酮醛升高还与糖尿病发生有关。
在过往对胰腺癌模型的研究中,作者发现单个BRCA2拷贝缺失的细胞并不会逐渐演变成“二次打击”,并且细胞仍能实现DNA损伤修复,这说明BRCA2功能实际上是被保留了。但奇怪的是,这种BRCA2单拷贝缺失的癌细胞仍然会不断加速发展。基于这些发现,他们推测癌细胞在演化过程中,很可能经历了短暂的BRCA2失活,这赋予了它们进一步发展的能力。
而新研究确认这种能力就来自于葡萄糖代谢,由于癌细胞需要大量能量来供应生长,糖酵解过程非常活跃,而这也伴随着大量中间代谢产物累积。其中丙酮醛的增长量格外引人注目,与健康胰腺相比,胰腺癌细胞的丙酮醛水平增加了6倍,并且DNA损伤明显增加。
这些累积的丙酮醛究竟会产生什么影响呢?作者尝试在癌细胞培养环境中添加了合理水平的丙酮醛,结果一段时间后细胞的BRCA2蛋白水平显著下降,并且丙酮醛浓度越高,DNA损伤就越严重。除了直接添加丙酮醛,作者还尝试敲除了原本可以分解丙酮醛的酶GLO1,这一方式同样会使得BRCA2蛋白减少,同时使丙酮醛水平升高。
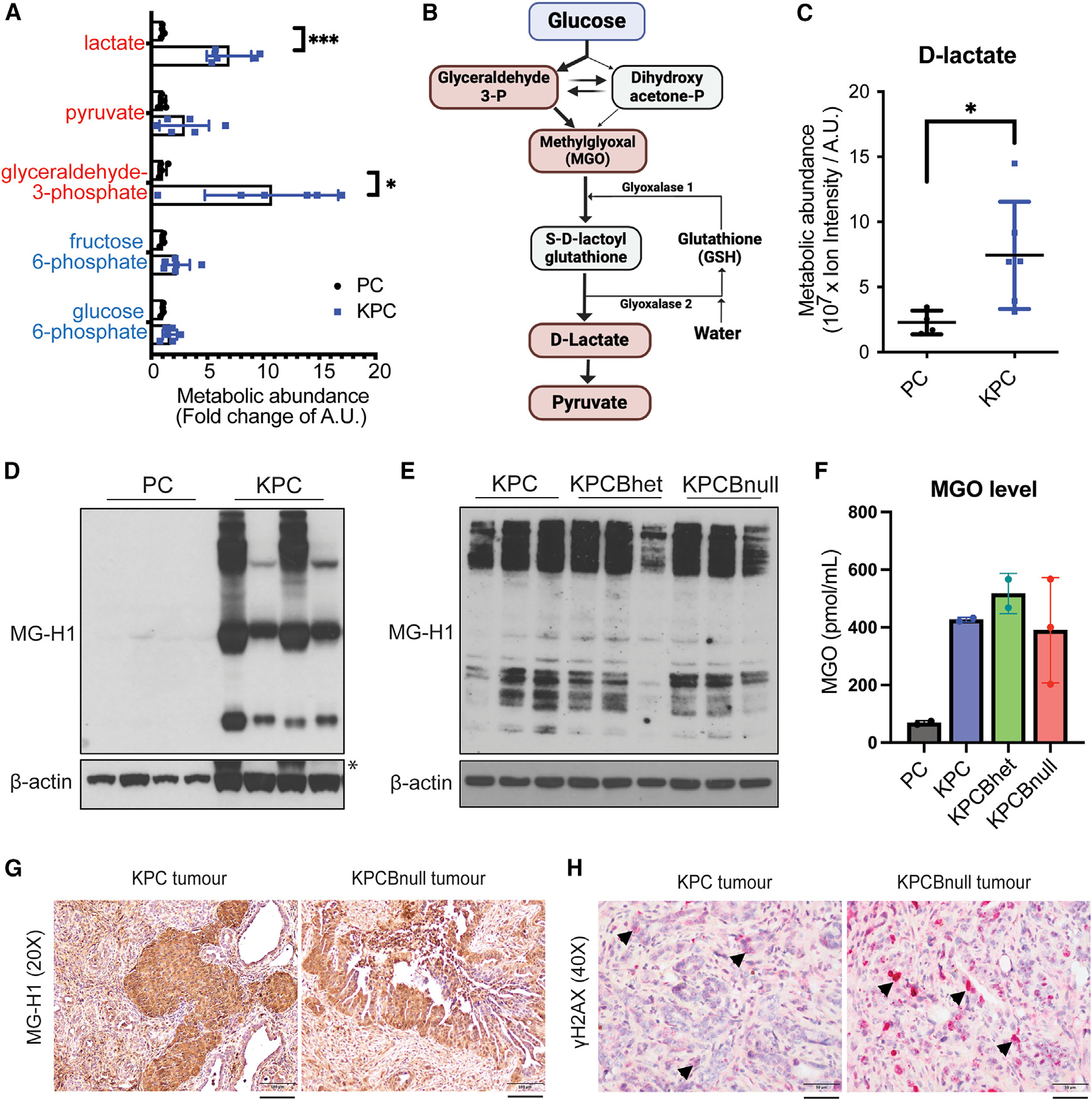
癌症模型中活跃的糖酵解以及过度累积的丙酮醛
研究者指出,对于那些没有遗传到BRCA2突变拷贝的人来说,仍然有可能受到丙酮醛的影响,因为不健康的高糖、高碳水饮食、肥胖或者糖尿病前期都会促使体内累积超过正常水平的丙酮醛,这也能在健康人体内增加癌症风险相关特征。这一发现加深了我们对癌症与代谢之间的理解,丙酮醛不仅有望成为一种检测癌症发展风险的标志物,同时提示我们饮食干预、体重控制也可以成为癌症患者管理的一种辅助手段。
Summary 摘要
Knudson’s “two-hit” paradigm posits that carcinogenesis requires inactivation of both copies of an autosomal tumor suppressor gene. Here, we report that the glycolytic metabolite methylglyoxal (MGO) transiently bypasses Knudson’s paradigm by inactivating the breast cancer suppressor protein BRCA2 to elicit a cancer-associated, mutational single-base substitution (SBS) signature in nonmalignant mammary cells or patient-derived organoids. Germline monoallelic BRCA2 mutations predispose to these changes. An analogous SBS signature, again without biallelic BRCA2 inactivation, accompanies MGO accumulation and DNA damage in Kras-driven, Brca2-mutant murine pancreatic cancers and human breast cancers. MGO triggers BRCA2 proteolysis, temporarily disabling BRCA2’s tumor suppressive functions in DNA repair and replication, causing functional haploinsufficiency. Intermittent MGO exposure incites episodic SBS mutations without permanent BRCA2 inactivation. Thus, a metabolic mechanism wherein MGO-induced BRCA2 haploinsufficiency transiently bypasses Knudson’s two-hit requirement could link glycolysis activation by oncogenes, metabolic disorders, or dietary challenges to mutational signatures implicated in cancer evolution.
Highlights 亮点
•Methylglyoxal (MGO) incites genome-wide SBS mutations in monoallelic BRCA2 mutant cells
• 丙酮醛/甲基乙二醛(MGO)在单倍体BRCA2突变细胞中引发全基因组范围的单碱基替换(SBS)突变。
•MGO transiently inactivates BRCA2 function, bypassing Knudson’s “two-hit” requirement
• MGO暂时性地使BRCA2功能失活,绕过了Knudson提出的“双重打击”要求。
•Oncogenic or metabolic changes that increase MGO via glycolysis provoke similar events
• 致癌因素或代谢重塑通过糖酵解增加MGO会引发类似事件。
•This mechanism links metabolic reprogramming, metabolic disorders, or diet to cancer initiation
• 这一机制将代谢重编程、代谢紊乱或饮食与癌症的发生联系起来。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(24)00255-1
此外,MGO可与多种蛋白质上形成共价修饰,但修饰的组成、位点和功能在很大程度上仍然未知。很多报告表明 MGO 与糖尿病和衰老等疾病的发病机制有关,但其作用靶标尚未确定。2018年的一篇Nature论文报道MGO可以共价修饰KEAP1 蛋白(MGO selectively modifies KEAP1 to form a methylimidazole crosslink between proximal cysteine and arginine residues (MICA). This posttranslational modification results in the dimerization of KEAP1, the accumulation of NRF2 and activation of the NRF2 transcriptional program. 详见:Bollong MJ, et al. A metabolite-derived protein modification integrates glycolysis with KEAP1-NRF2 signalling. Nature. 2018 Oct;562(7728):600-604)。
参考文献:Li Ren Kong et al, A glycolytic metabolite bypasses "two-hit" tumor suppression by BRCA2, Cell (2024). DOI: 10.1016/j.cell.2024.03.006 https://www.sciencedirect.com/science/article/pii/S0092867424002551
https://wap.sciencenet.cn/blog-446272-1430048.html
上一篇:[转载]破译生命的糖质密码重大研究计划2024年度项目指南
下一篇:Nature: 如何在病毒学研究中找到自己的定位 (niche in virology research)