博文
氢气通过抑制细胞膜NR2B磷酸化和氧化应激,降低了难治性癫痫持续状态大鼠的脑电图活性和神经元死亡
||
氢气通过抑制细胞膜NR2B磷酸化和氧化应激,降低了难治性癫痫持续状态大鼠的脑电图活性和神经元死亡
Jia R, Zhu G, Zhao R, Li T, Jiang W, Cui X. Hydrogen treatment reduces electroencephalographic activity and neuronal death in rats with refractory status epilepticus by inhibiting membrane NR2B phosphorylation and oxidative stress. J Int Med Res. 2024 Mar;52(3):3000605241235589.
目的:研究氢气疗法对难治性状态癫痫大鼠癫痫发作的影响及其潜在机制。
方法:使用毛果芸香碱诱导状态癫痫。随后通过Racine评分和脑电图(EEG)监测模型大鼠癫痫严重程度受氢气治疗的影响,并对血浆膜N-甲基-D-天冬氨酸受体亚型2B (NR2B) 及磷酸化NR2B的表达进行蛋白质印迹分析。我们还使用Mg2+自由介质生成了细胞癫痫模型,并利用聚合酶链反应研究氢气的神经保护效果。
结果:氢气组与对照组之间的Racine评分没有显著差异。但氢气治疗组的EEG振幅低于对照组。在癫痫模型大鼠中,海马细胞膜NR2B的表达和磷酸化随时间逐渐增加。尽管两组间海马细胞膜NR2B的表达没有显著差异,但氢气组的NR2B磷酸化水平显著降低。氢气治疗还增加了超氧化物歧化酶,线粒体(SOD2)的表达。
结论:氢气治疗降低了EEG振幅和NR2B磷酸化;它还通过减少氧化应激减少了神经元死亡。因此,氢气可能是通过抑制膜NR2B磷酸化和氧化应激来治疗难治性状态癫痫的潜在疗法。
介绍
大多数癫痫发作持续时间不超过5分钟;然而,当发作持续超过5分钟时,它们很难自行终止,疾病可能进展为状态癫痫(SE)。在重症监护病房的SE患者中,12%到43%的病例会进展为难治性SE (RSE),在这些患者的10%到15%中,疾病进一步进展为超级RSE。持续时间更长的发作对患者更加有害。持续性癫痫样放电会导致炎症、氧化应激以及电解质和酸碱平衡失调,从而导致神经元死亡和患者不同程度的神经功能损害。大约五分之二的RSE患者最终死于RSE相关并发症。即使患者存活下来,也会持续存在严重的神经功能缺陷——如难治性癫痫或认知功能障碍。目前SE治疗的目的是尽快通过症状性和支持性疗法终止癫痫发作。
苯二氮卓类药物因其高度的安全性和易用性,常作为治疗状态癫痫(SE)的一线药物。但若癫痫发作持续,海马神经元突触后膜中的γ-氨基丁酸A型受体(GABAARs)会内化,导致突触膜上功能性活跃的GABAARs数量迅速减少,使得苯二氮卓类和苯巴比妥类药物的效能迅速下降,进而可能发展为难治性状态癫痫(RSE)。相较之下,持续的癫痫发作会导致突触膜上功能性活跃的N-甲基-D-天冬氨酸(NMDA)受体数量逐渐增加,因此作用于NMDA受体的药物可能对治疗RSE有效。临床上,NMDA受体拮抗剂氯胺酮在治疗RSE方面显示出了疗效。这种治疗的使用应基于SE期间神经传递的时间依赖性变化。
氢气可以自由扩散,快速穿过血脑屏障和细胞膜,进入组织和神经细胞,并发挥独特且选择性的抗氧化和抗炎作用;此外,它没有副作用。当动脉和静脉血中的氢气浓度达到大约10至20M时,它具有良好的治疗效果且无任何副作用。此外,停止供应氢气后,血中氢气浓度迅速下降。在动脉血中,氢气浓度在大约6分钟后降至原始浓度的10%;在静脉血中,这一过程略长(大约18分钟)。我们早期的研究揭示,氢气给药能增强患有癫痫的大鼠的认知能力,并表明其底层过程涉及氢气诱导的海马神经元坏死减少。尽管如此,氢气对RSE的潜在治疗影响仍不确定。一些研究报告称,氢气通过调节NMDA受体亚型2B(NR2B)亚基的膜转运,从而调节NMDA受体的功能,减少神经兴奋性。这些结果表明,氢气是RSE潜在的新治疗方法。然而,迄今为止,尚无详细报告使用氢气治疗RSE。
在本研究中,我们旨在探究氢气在难治性状态癫痫(RSE)中的治疗效果及其可能的机制。首先,我们筛选了适合的RSE动物模型;其次,我们观察了氢气是否对RSE中的癫痫发作具有治疗效果,并初步探索其作用机制;最后,我们在细胞癫痫模型中研究了氢气对RSE引起的神经细胞死亡的治疗效果及可能的潜在机制。
材料与方法
活体实验
电极植入
所有电极和固定螺母置于75%乙醇溶液中备用。通过腹腔注射2%戊巴比妥麻醉大鼠。麻醉后,剃去每只大鼠头部的毛发,然后将大鼠转移到立体定位系统上。将一个耳杆插入大鼠的外耳道并固定;然后在另一耳道插入另一耳杆。必须确保双侧耳杆对称,以保证大鼠头部保持在中线位置。然后将耳杆固定并调整高度,使颅骨处于水平位置。接下来,用75%酒精消毒头部皮肤。用镊子提起皮肤,沿中线切开头部的皮肤和肌膜,充分暴露手术部位,并用3%过氧化氢反复擦洗。根据Paxinos和Watson的立体定向图谱确定电极位置。定位后,标记左右定位点(海马记录电极位点:前后-3.20mm,侧向/内侧1.80mm,背/腹3.0mm,双侧对称)。然后用牙科钻小心打开颅骨,用针轻轻撕开硬脑膜。随后,在双目连线与颅骨中线交点处打一个小通道,插入颅骨参考电极。在电极植入点外的裸露颅骨表面放置一个固定螺母,然后放置电极。初步用502胶固定,再用牙科水泥重新固定。为防止损伤大脑,我们确保螺母安装得不过深。然后将每只大鼠放在恒温毯上保暖,并在它们完全苏醒后放回笼中正常饲养。电极放置后,让大鼠恢复1周时间。
在实验期间,大鼠被饲养在一个无菌环境中,随时都能获取食物和水。它们被置于一个温度维持在20°C至22°C的12小时光照/黑暗循环环境中。所有动物实验均按照美国国家卫生研究院(NIH)的实验动物使用指南进行,并获得了第四军医大学西京医院动物实验管理委员会的批准(XJ-20220432)。所有方法均按照动物研究体内实验报告指南(ARRIVE 2.0)进行报告。
脑电图(EEG)记录和行为分析
在电极植入和一周的恢复期后,我们建立了反复自发癫痫(RSE)模型,并记录了脑电图。实验结束后,另一位研究人员根据双盲原则,使用MATLAB(MathWorks,美国马萨诸塞州纳提克市)软件对各组数据进行转换和分析。每只大鼠均接受氯化锂(180毫克/千克)的腹腔注射。在氯化锂注射后的18至20小时,给予大鼠腹腔注射毛果芸香碱(30毫克/千克),并将头部电极连接到记录导线上。随后,开启脑电图和视频监控设备。我们使用Racine量表观察和评估每只大鼠的行为表现。我们密切观察各组大鼠的癫痫发作情况;如果30分钟内未出现癫痫发作,则再次腹腔注射毛果芸香碱(剂量为初次剂量的一半),随后观察30分钟。如果仍未出现癫痫发作,则视为模型建立失败。另外,如果观察到持续10分钟的五级癫痫发作,则给予大鼠腹腔注射地西泮(10毫克/千克),并观察脑电图信号和行为的变化。如果无法终止癫痫发作,则视为RSE模型建立成功。
接下来,为了研究不同剂量的氢气对RSE模型的治疗效果,我们使用了富氢生理盐水(HRS)。在RSE+HRS组中,大鼠接受不同剂量的HRS腹腔注射治疗,而RSE+生理盐水组的大鼠则在接受地西泮(10毫克/千克)腹腔注射后5分钟接受相应剂量的生理盐水治疗。脑电图记录参数如下:纸速30毫米/秒,2毫米等于50微伏。脑电图记录开始于毛果芸香碱腹腔注射前5分钟,并持续观察60分钟。我们使用MATLAB软件对脑电图数据进行处理,并通过两种不同方法进行分析。我们根据以下脑电图数据定义癫痫持续状态(SE):频率≥5赫兹,持续时间>30秒,振幅≥基线振幅的3倍。
Western blot
提取海马组织后,使用Minute Plasma Membrane Protein Isolation and Cell Fractionation Kit(SM-005-4;Invent Biotechnologies, Inc.,Plymouth,MN,USA)分离出质膜蛋白。将等量的蛋白样品通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行分离,随后转移到聚偏二氟乙烯膜上(ISEQ00010;Millipore,Billerica,MA,USA)。将膜在室温下封闭1小时后,于4℃下过夜孵育相应的一抗——NR2B(ab28373,1:500;Abcam,Cambridge,UK)、磷酸化(p)-NR2B(ab81271,1:300;Abcam)和甘油醛-3-磷酸脱氢酶(GAPDH;CW0100 M,1:2000;CoWin Biosciences,台州,中国)。随后在室温下孵育二抗(山羊抗兔IgG,CW0103S;山羊抗小鼠IgG,CW0102S;均为CoWin Biosciences)2小时。使用Immobilon Western Chemiluminescent HRP Substrate(P0018 M;Beyotime Biotechnology,上海,中国)检测结合的抗体。使用ImageJ软件(NIH,Bethesda,MD,USA)量化条带强度。NR2B和p-NR2B条带强度均通过GAPDH条带强度进行标准化,以GAPDH作为上样对照。
体外实验
原代大鼠海马神经元培养
动物从第四军医大学动物中心购买。所有实验均在混合原代海马神经元培养上进行,该培养的制备方法如前所述,但略有修改。首先,从胚胎第18天的Sprague Dawley大鼠大脑中分离出海马神经元。胚胎被转移到并在冰冷的解剖介质中通过斩首法安乐死,该介质由Hank's缓冲盐溶液组成。然后,将细胞种植在Falcon 35-mm细胞培养皿或涂有聚-l-赖氨酸的玻璃盖片上(0.05 mg/mL)。海马细胞在37°C、5% CO2/95%空气的气氛中维持,并在补充有2% B27、0.5 mM l-谷氨酰胺、100单位/mL青霉素和100 g/mL链霉素的神经基础培养基中培养。细胞在进一步分析前维持5天。
无Mg2+条件
对于无Mg2+条件,我们准备了不含MgCl2的生理浴记录溶液(pBRS)(低Mg2+),其组成为(单位为mM):145 NaCl, 2.5 KCl, 10 4-(2-羟乙基)-1-哌啶乙磺酸(HEPES), 2 CaCl2, 0.002甘氨酸, 和10葡萄糖。该溶液的pH值为7.3,渗透压使用蔗糖调整至315至325 mOsm。神经元细胞与该溶液孵育2.5小时以诱导高频癫痫样突发(类似SE的电图活动)。高频癫痫样突发持续到含有1 mM MgCl2的pBRS加入到培养物中为止。不含MgCl2的pBRS用于低Mg2+处理条件,对照组则用含有1 mM MgCl2的pBRS处理。
实时荧光定量聚合酶链反应(PCR)
实时荧光定量PCR被用来测量在用无Mg2+细胞外液处理后3、6和12小时时混合谱系激酶结构域样蛋白(MLKL)、半胱天冬酶-3和凋亡调节蛋白Bcl-2的mRNA表达水平。使用了实时荧光定量试剂盒(Takara Bio, Kusatsu, Japan),按照制造商的说明操作。使用的引物在表1中展示。
表1. 聚合酶链反应实验中使用的引物
Gene | Forward (5′–3′) | Reverse (5′–3′) |
Beta actin (Actb) | CATCCGTAAAGACCTCTATGCCAAC | ATGGAGCCACCGATCCACA |
Apoptosis regulator Bcl-2 (Bcl2) | GCTACCGTCGTGACTTCGC | CCCCACCGAACTCAAAGAAGG |
Caspase-3 (Casp3) | CTGCCGGAGTCTGACTGGAA | ATCAGTCCCACTGTCTGTCTCAATG |
Superoxide dismutase, mitochondrial (Sod2) | CAGACCTGCCTTACGACTATGG | CTCGGTGGCGTTGAGATTGTT |
Mixed lineage kinase domain-like protein (Mlkl) | AATTGTACTCTGGGAAATTGCCA | AAAGACTCCTACCGTCCACAG |
统计分析
数据使用IBM SPSS Statistics for Windows, version 20.0 (IBM Corp., Armonk, NY, USA)进行分析,所有实验结果以均值±标准误差显示。所有实验独立重复Z三次。使用Student’s t-test来确定两组数据之间的差异,而使用单因素方差分析(ANOVA)来比较多组数据。重复测量使用双向ANOVA进行测试。对于所有的测试,P < 0.05被认为表示显著差异。
结果
苯二氮卓类药物抗药性癫痫持续状态模型
在锂-毛果芸香碱癫痫模型中,先前的研究发现当实验动物的癫痫发作严重程度达到或超过V级并且持续10分钟时,动物开始对地西泮产生抗药性并发展成RSE。基于这些发现,在大鼠毛果芸香碱癫痫模型中,我们在癫痫发作严重程度达到V级后给予地西泮,并维持剂量10分钟。为了确定这个模型是否适合RSE的基础研究,我们随后通过行为测试和脑电图(EEG)观察了苯二氮卓类药物的治疗效果。在毛果芸香碱给药后大约18±5.6分钟,大鼠开始出现癫痫持续状态(SE)(n=10)。在地西泮治疗后10分钟,尽管脑电图上的癫痫强度有所下降且行为有所改善,但癫痫发作并未有效终止(见图1)。因此,我们相信这个模型可以用于模拟RSE进行基础研究。
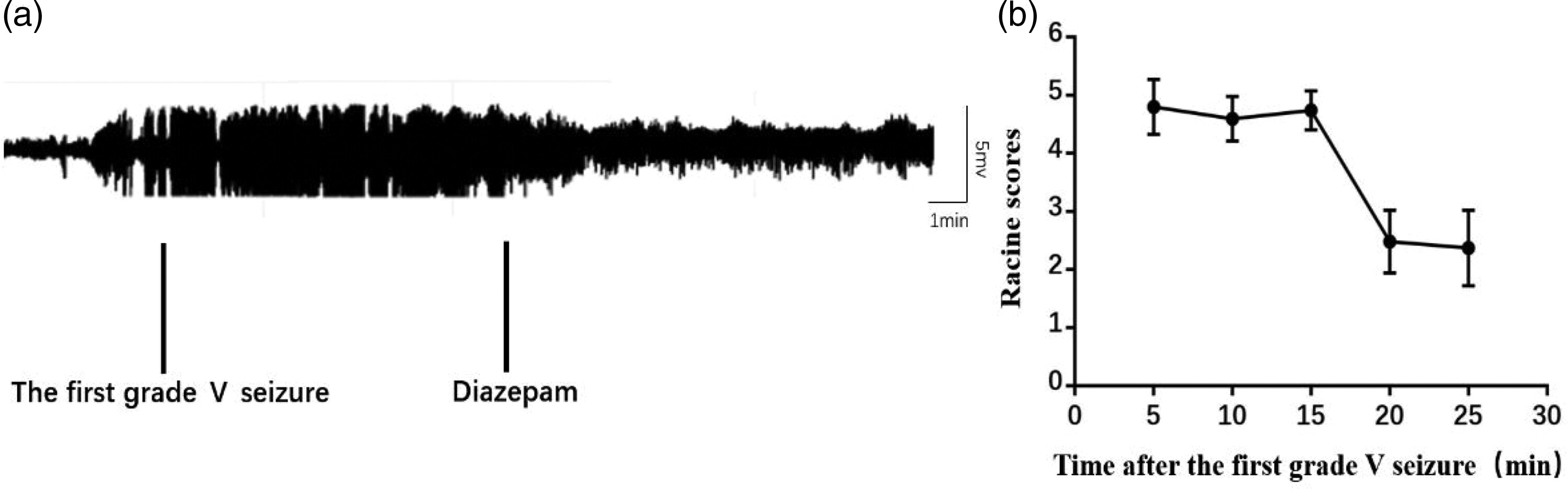
图1. 癫痫发作达到V级,在10分钟后仍对苯二氮卓类药物保持反应。(a) 在行为评分达到或超过V级后10分钟给予地西泮,脑电图信号的振幅降低;然而,发作并未终止(n=10)以及(b) 模型大鼠的行为评分在治疗后有所下降(n=10)。
HRS处理降低了RSE大鼠脑电图攻击的强度
在模型成功建立后,动物随机分为四组(每组n=6)。每组动物接受不同剂量的HRS(5、10、20或30 mL/kg)处理并进行了观察。10 mL/kg及以下剂量的HRS产生了治疗效果,但没有减少大鼠脑电图波形的振幅(图2a, b);然而,20和30 mL/kg剂量的HRS具有相似的治疗效果,并且能够减少脑电图波形的振幅(P < 0.05)(图2c, d)。
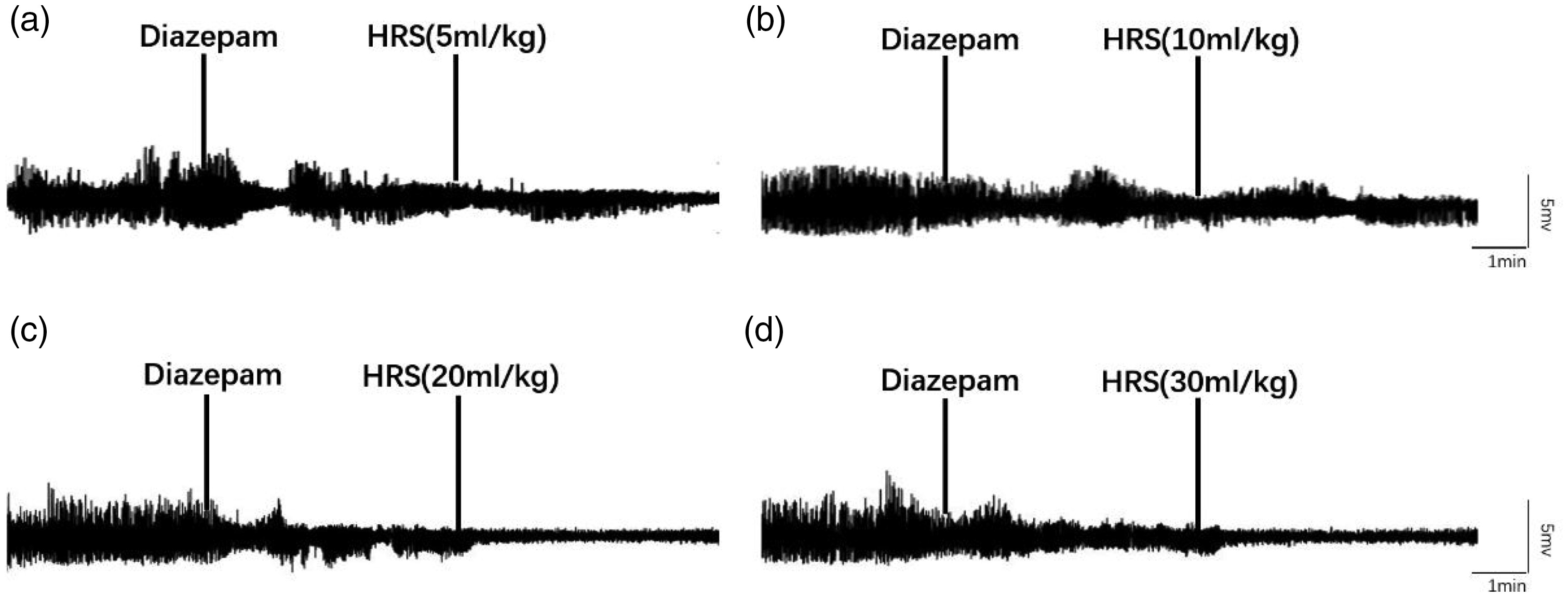
图2. 不同剂量的富氢盐水(HRS)对难治性癫痫持续状态(RSE)模型大鼠脑电图(EEG)攻击强度的影响。(a, b) 在地西泮治疗后,EEG振幅降低,但攻击未终止。用5或10 mL/kg HRS处理对大鼠EEG振幅没有明显影响(n=6)以及(c, d) 用20和30 mL/kg HRS处理进一步降低了地西泮治疗后大鼠的EEG振幅(n=6)。
接下来,我们更详细地研究了HRS的治疗效果。以30 mL/kg的剂量,需要腹腔注射的液体量很高,这可能会影响RSE大鼠的行为。因此,我们选择20 mL/kg作为治疗性HRS剂量。随着时间的推移,大鼠EEG发作的强度开始增加(P < 0.05)(图3)。当癫痫发作达到难治性SE并且大鼠用地西泮(10 mg/kg)治疗10分钟时,EEG振幅和功率都开始下降。在腹腔注射HRS后,EEG振幅和功率进一步降低;随后效力丧失,EEG振幅和功率逐渐增加(所有P < 0.05)。在盐水对照组中,盐水注射后EEG振幅和功率没有显著变化,但随着时间的推移逐渐增加。
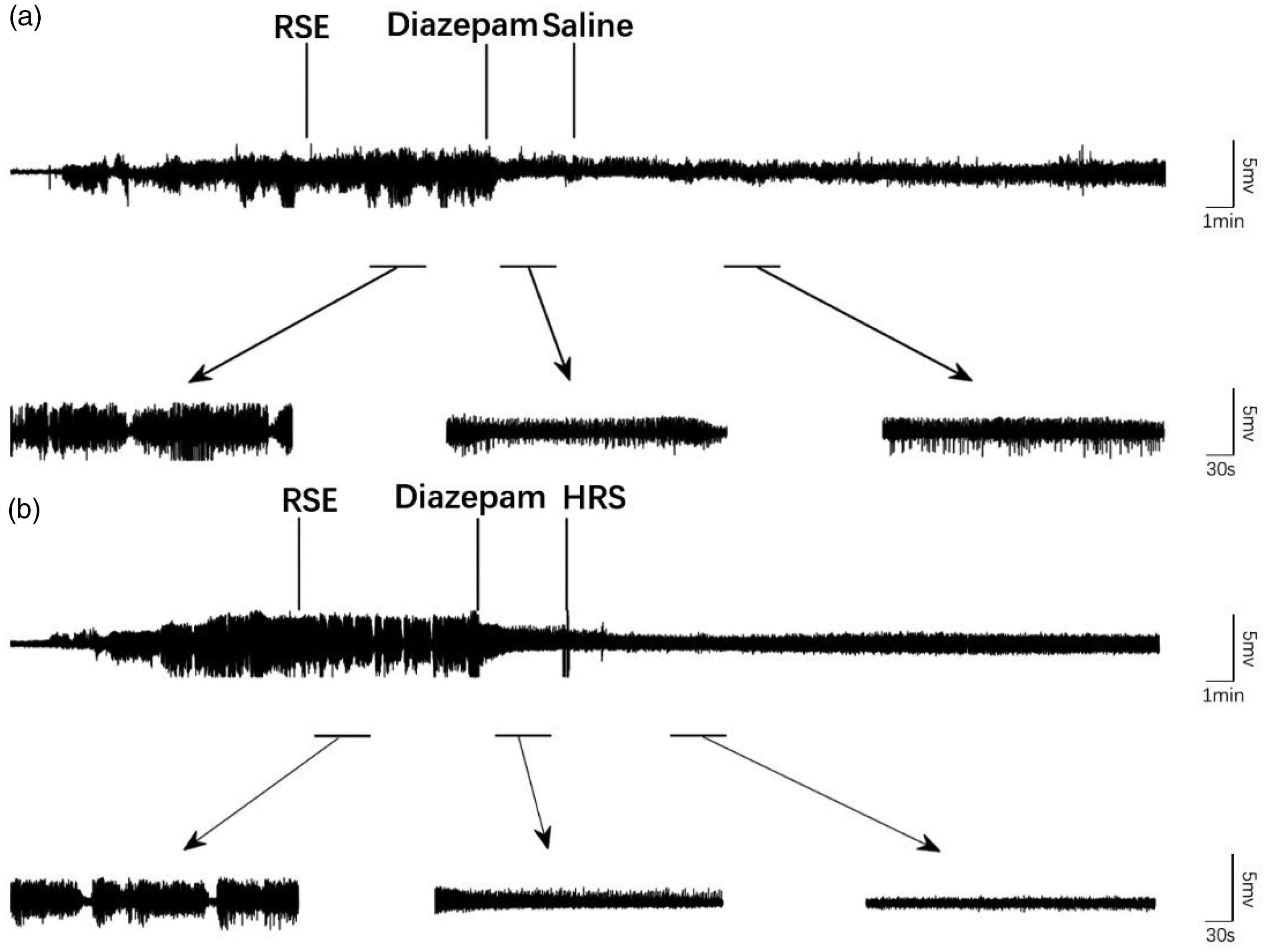
图3. 富氢盐水(HRS)对难治性癫痫持续状态(RSE)模型大鼠脑电图(EEG)振幅的影响。(a) 盐水处理对EEG振幅没有影响,且随着时间的推移,脑电图攻击强度逐渐增加(n=6)以及 (b) 在连续EEG记录中,大鼠用20 mL/kg HRS处理。HRS处理后,脑电图攻击强度降低,然后随时间再次增加(n=6)。
HRS处理并未改善RSE大鼠的行为
我们进一步观察了HRS处理对大鼠行为的影响。通过腹腔注射毛果芸香碱来诱导癫痫发作。当严重程度达到V级并持续10分钟时,通过腹腔注射地西泮进行干预。5分钟后,动物接受相同剂量的HRS或普通盐水处理,并在两组大鼠中使用Racine量表对行为变化进行评分,以评估治疗干预后不同时间点的癫痫严重程度。尽管治疗后癫痫未被终止,但两组大鼠的行为评分均降至大约2分。随后,两组大鼠的行为评分随时间逐渐增加(P < 0.05)。HRS组和盐水组之间的行为评分没有显著差异(图4)。.
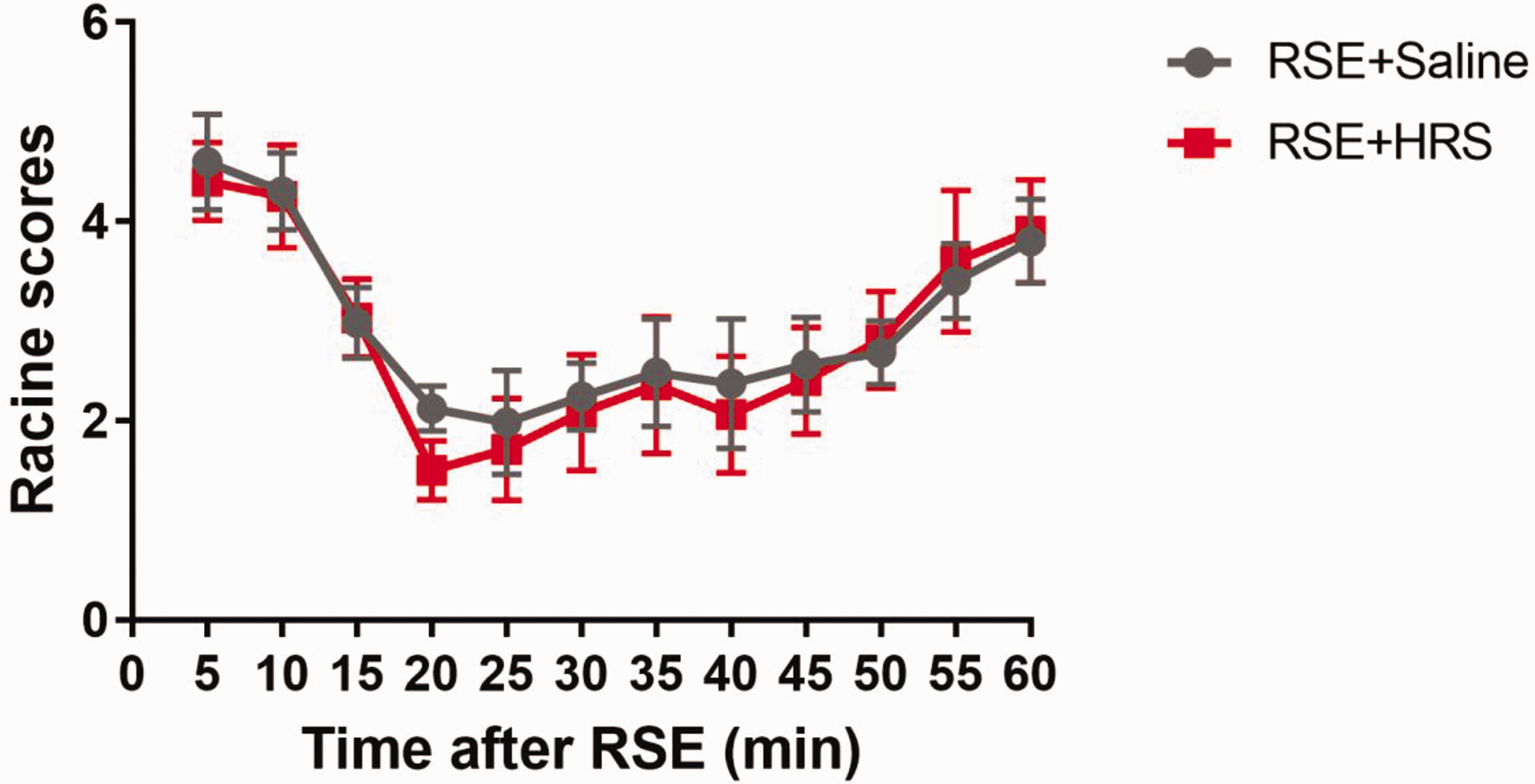
图4. 富氢盐水(HRS)处理对难治性癫痫持续状态(RSE)模型大鼠行为评分的影响。在RSE后10分钟给予地西泮,并在15分钟后给予HRS或普通盐水处理。尽管两组在任何时间点的Racine评分没有差异,但在地西泮治疗后两组的评分都有所下降,然后随时间逐渐增加(n=6)。
HRS处理减少了细胞膜上的NR2B磷酸化
为了评估HRS在RSE大鼠中的治疗效果,我们关注了NMDA受体的功能调节亚基NR2B。NR2B亚基具有多个磷酸化调节位点,可以调节受体通道的功能状态,包括受体运输和表达。当NR2B亚基发生磷酸化时,NMDA受体介导的电流会增强。因此,在本研究中,我们用HRS处理了RSE大鼠,并观察了海马细胞膜上NR2B表达的变化。海马细胞膜上的NR2B表达在RSE后随时间逐渐增加,且在RSE后10、15和30分钟的NR2B表达水平高于对照组(所有P < 0.05)(图5a, b)。在RSE + 盐水组和RSE + HRS组之间,任何时间点的膜NR2B表达均无显著差异(图5c, d)。
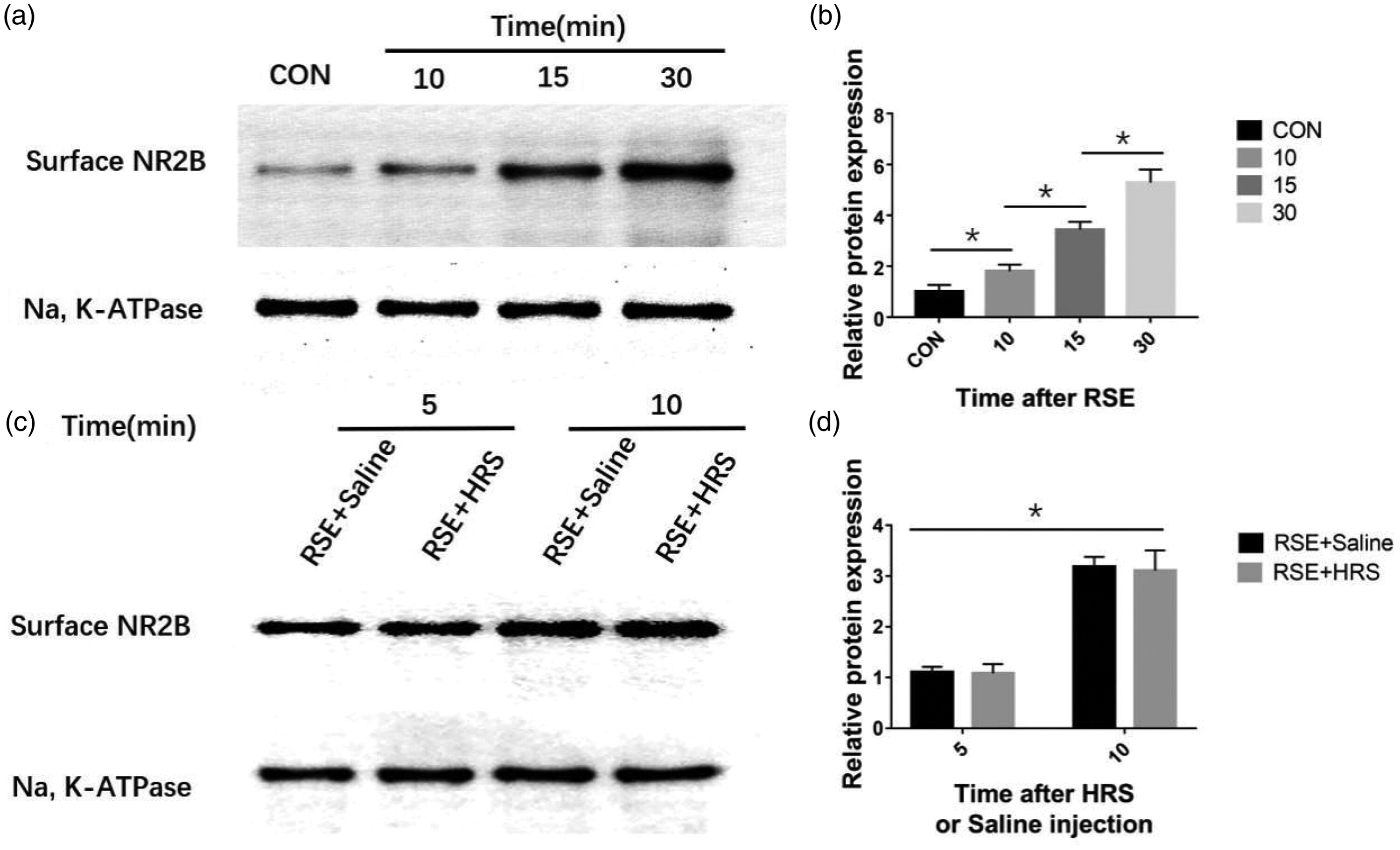
图5. 富氢盐水(HRS)处理对海马细胞膜N-甲基-D-天冬氨酸受体亚型2B(NR2B)表达的影响。(a) 通过西方印迹法在不同时间点测量难治性癫痫持续状态(RSE)诱导后的膜NR2B表达(n=3)。(c) RSE + 盐水组和RSE + HRS组在RSE诱导后不同时间点的膜NR2B表达以及(b, d)每组的相对蛋白水平(n=3)。
我们进一步研究了海马细胞膜上NR2B的磷酸化;p-NR2B的水平也随时间逐渐增加(P < 0.05)。与对照组相比,RSE后10、15和30分钟的p-NR2B水平更高(所有P < 0.05)(图6a, b)。此外,RSE + HRS组的p-NR2B水平显著低于RSE + 盐水组(P < 0.05)(图6c, d)。这些结果表明,HRS可以调节NR2B的磷酸化。有报告称,减少NR2B的磷酸化可以抑制NMDA受体功能并降低神经兴奋性。但是,需要进一步的实验来确定氢是否通过这一途径调节NMDA受体功能,并随后对大鼠的RSE产生治疗效果。
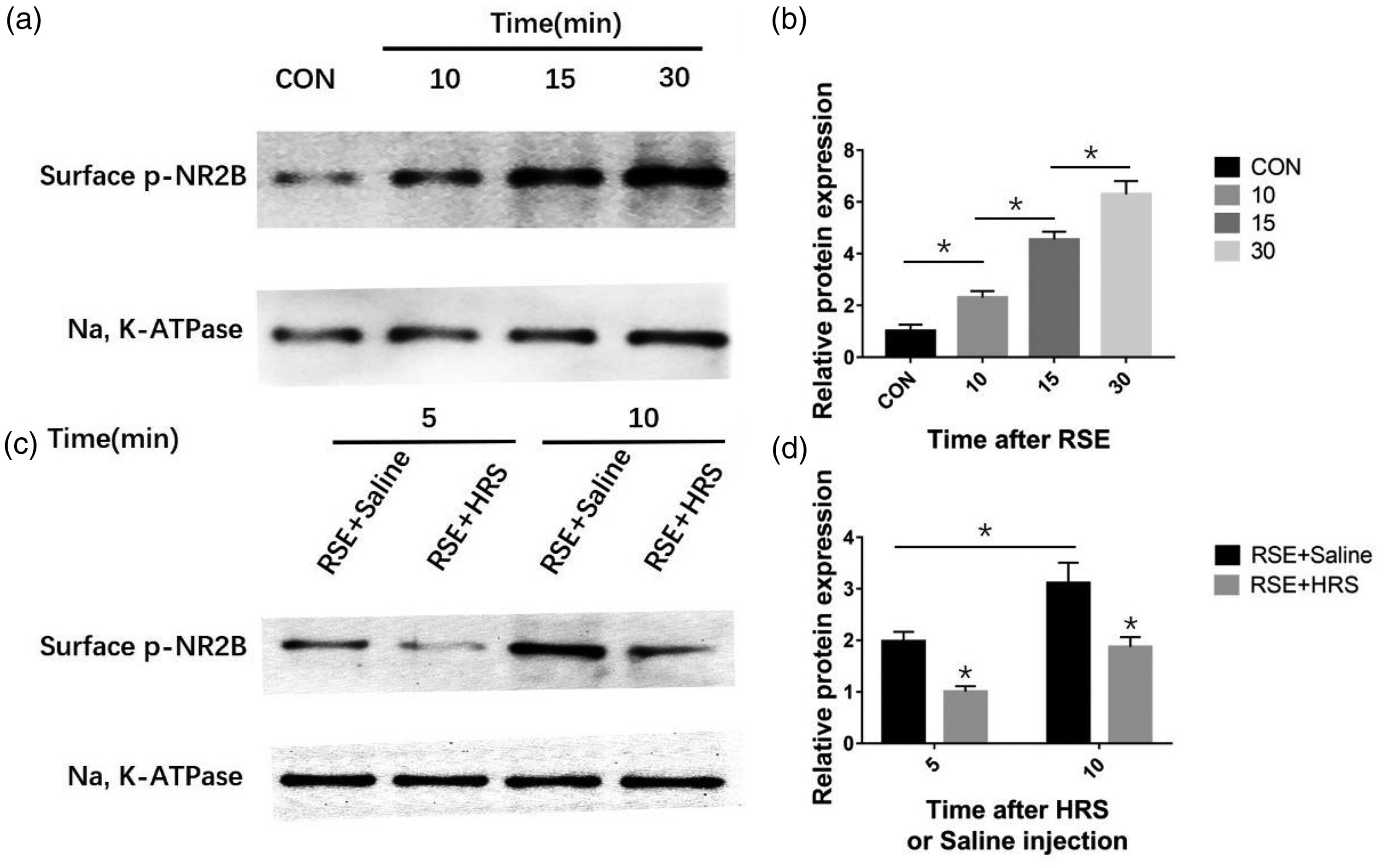
图6. 富氢盐水(HRS)处理对海马细胞膜N-甲基-D-天冬氨酸受体亚型2B(NR2B)磷酸化的影响。(a) 通过西方印迹法在难治性癫痫持续状态(RSE)诱导后的不同时间点测量NR2B的磷酸化(n=3)。(c) RSE + 盐水组和RSE + HRS组在RSE诱导后不同时间点的NR2B磷酸化以及(b, d)每组的相对蛋白水平(n=3)。
HRS处理减少了SE模型中的氧化应激
为了进一步探索HRS对RSE大鼠海马凋亡和坏死性凋亡的保护作用,我们使用原代神经元培养建立了SE模型,并在体外研究了相关机制。首先,我们使用实时荧光定量PCR测量了处理后3、6和12小时的MLKL、caspase-3和Bcl-2的mRNA表达。在神经元用无镁细胞外液处理建立SE模型后的3小时,caspase-3、MLKL和Bcl-2的mRNA表达水平与对照组(用正常细胞外液处理)没有差异(图7)。在SE模型建立后的6小时,caspase-3、MLKL和Bcl-2的mRNA表达水平在细胞中达到峰值(图7b, c, d);这些水平显著高于对照组(所有P < 0.05)。在SE模型建立后的12小时,caspase-3、MLKL和Bcl-2的mRNA表达水平显著低于6小时时的水平,但仍高于正常对照组(所有P < 0.05)。此外,各组在24小时时间点的存活神经元数量支持了PCR结果。SE组存活神经元最少,而HRS处理部分增加了存活神经元的数量(图7a, e)。
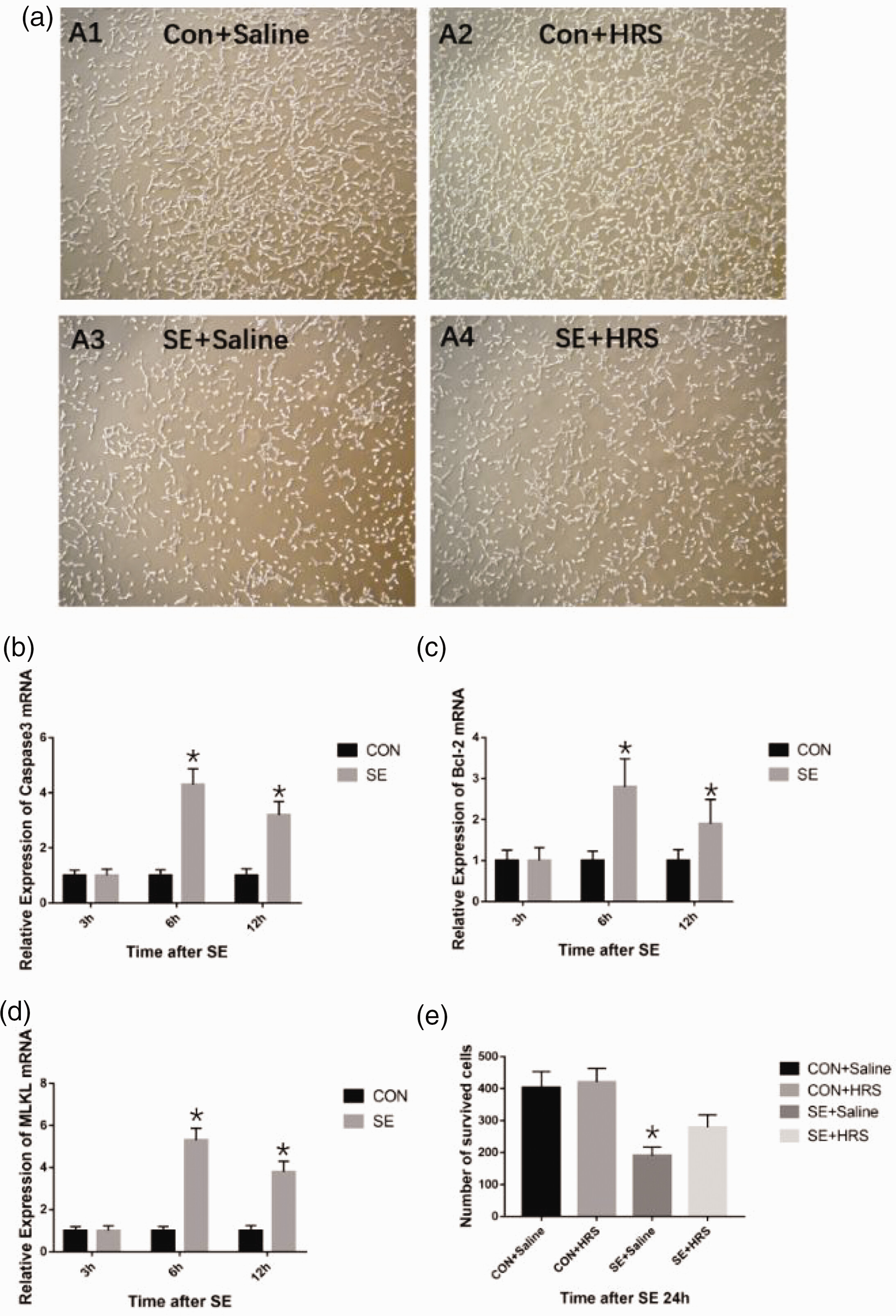
图7. 富氢盐水(HRS)处理对在无镁培养基中培养的原代神经元死亡的影响。(a) 癫痫持续状态(SE)模型诱导后24小时各组神经元的存活情况。(b, c, d) 使用实时荧光定量聚合酶链反应检测caspase-3、混合谱系激酶结构域样蛋白(MLKL)和凋亡调节因子Bcl-2的mRNA表达;在SE模型诱导后6小时达到峰值,并且在6小时和12小时时与对照组相比表达增加 (e) SE模型诱导后24小时各组在一个视野中(200×)存活神经元的数量。
上述结果表明,体外SE模型部分模仿了体内观察到的细胞损伤。因此,我们使用这个模型探索了HRS的治疗机制。基于之前实验的结果,我们选择了SE后6小时进行所有后续研究。使用实时荧光定量PCR检测了响应HRS处理的Bcl-2和线粒体超氧化物歧化酶(SOD2)表达的变化。SE + 盐水组的Bcl-2 mRNA表达高于对照组,而HRS处理显著增加了Bcl-2的表达(所有P < 0.05)(图8a)。然而,作为体内重要的抗氧化应激酶的SOD2的mRNA表达在SE + 盐水组显著低于其他三组,包括SE + HRS组(所有P < 0.05)(图8b);这一发现表明,HRS可能通过增加SOD2表达来减少氧化应激。
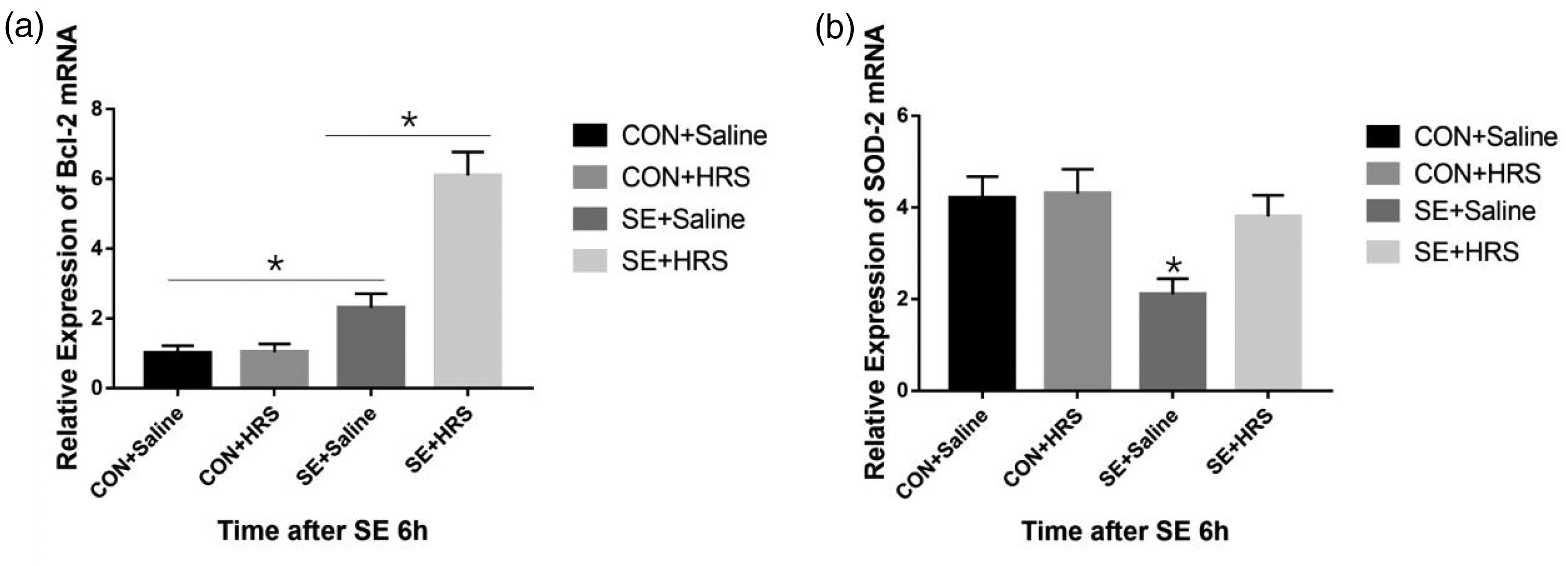
图8展示了富氢盐水(HRS)处理对培养神经元中抗凋亡蛋白Bcl-2和线粒体超氧化物歧化酶(SOD2)表达的影响。(a) 在癫痫持续状态(SE)模型诱导后6小时,测量了各组的Bcl-2 mRNA表达;(b) HRS处理在SE模型诱导后6小时对SOD2 mRNA表达的影响。
讨论
随着癫痫发作的持续,药物(尤其是苯二氮卓类药物)的治疗效果逐渐降低;这突显了谷氨酸受体拮抗剂在治疗难治性癫痫持续状态(RSE)中的潜在价值。特别是针对NMDA受体的治疗可能是改善当前癫痫治疗现状的一个选择。在本研究中,HRS处理并未改善RSE大鼠的行为表现,但确实降低了脑电图(EEG)振幅。此外,HRS处理调节了NMDA受体NR2B亚基的磷酸化,这表明HRS的治疗效果可能通过这一途径介导。
目前,RSE治疗并未有效降低死亡率或改善预后。因此,迫切需要筛选合适的RSE动物模型进行进一步研究。在仔细分析各种现有的癫痫动物模型后,我们注意到锂-毛果芸香碱模型在行为评分维持在V级10分钟后对苯二氮卓类药物产生抵抗;因此,该模型有潜力成为苯二氮卓类抵抗性的RSE动物模型。我们使用行为和EEG数据对该模型进行了详细评估。当癫痫发作严重程度维持在V级10分钟时,我们给大鼠腹腔注射了地西泮(10 mg/kg)。尽管地西泮未能终止发作,但Racine评分和EEG振幅均有所降低。这些发现表明,此时模型大鼠对苯二氮卓类药物产生了抵抗。因此,我们使用该模型观察氢气的治疗效果。
目前毫无疑问,氢气可用于治疗或预防各种疾病。例如,Ohsawa等人首次报告,氢气可显著减少氧化应激,并在吸入诱导的大鼠局部脑缺血再灌注损伤模型中发挥神经保护作用。后来的进一步研究通过多次注射HRS确认了氢气对脑缺血的治疗效果。Ogawa等人和Xu等人报告,足够剂量的HRS可用于治疗由缺血和一氧化碳相关的毒性脑病引起的听力损失。此外,口服含氢水也可能对帕金森病患者或乙型肝炎患者有益。这些结果表明,氢气可以通过不同的剂量、不同的持续时间和不同的途径给药,发挥治疗效果。
我们首先筛选了治疗剂量,并发现20和30 mL/kg的HRS均能降低RSE大鼠的EEG振幅。鉴于30 mL/kg的剂量需要额外注射HRS而没有显著增加疗效,最终选择20 mL/kg作为最佳治疗剂量。随后我们进行了进一步的研究,发现模型大鼠在HRS治疗后EEG振幅降低,然后随时间再次升高。这一发现与Ono等人报告的结果一致。此外,我们的行为观察显示,HRS处理后的RSE大鼠与盐水处理后的对照组大鼠在行为表现上没有显著差异。这一结果表明,HRS的治疗效果可能不足以改善模型大鼠的行为表现。
癫痫从发作状态过渡到发作后状态存在一个重要的转变过程。这一机制的失败导致癫痫持续时间延长,部分原因是由于GABAAR内化导致药物效能降低。在模型大鼠中,GABAAR在突触膜上的内化会导致对苯二氮卓类药物产生耐受性,而NMDA受体在膜上的聚集逐渐增加了NMDA受体拮抗剂和其他针对NMDA受体的药物在SE中的效能。在电休克模型中,发作后15分钟给予GABAAR正向变构剂可以控制66%的大鼠癫痫发作,但在1小时时只能控制25%。相比之下,用MK-801或氯胺酮阻断NMDA受体可以迅速终止癫痫发作。此外,癫痫发作引起的其他受体的急性变化也促进了癫痫发作的持续性;例如,突触前腺苷A1受体表达减少和α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体GluA2亚单位丢失。缺乏GluA2亚单位的AMPA受体表现出钙通透性,可能导致钙超载甚至神经元死亡。这些结果表明,针对NMDA受体的药物可能为RSE的治疗提供新的可能性。
氢具有许多已知的功能,包括抗炎、抗凋亡和抗过敏功能,并能促进能量代谢。然而,仅将氢的治疗效果归因于众所周知的抗氧化功能是不合理的,因为氢的抗氧化效果不到维生素C和E的1/100;更重要的是,氢分子可以直接通过NR2B调节NMDA的功能来发挥治疗作用。因此,我们想知道:HRS是否也能调节NR2B?
为了进一步探索HRS对NR2B的影响,我们观察了癫痫发作后海马细胞膜上NR2B表达和磷酸化水平的变化。海马细胞膜上的NR2B表达在癫痫后逐渐增加,这与之前的研究结果一致。经过HRS处理后,治疗组与对照组大鼠之间的海马细胞膜NR2B表达没有显著差异,这表明HRS处理不能改变SE期间海马细胞膜上NR2B聚集的病理过程。因此,HRS不影响RSE中海马细胞膜上的NR2B表达。此外,我们还观察到海马细胞膜上NR2B磷酸化水平的变化;这些水平在癫痫发作后随时间逐渐增加,但被HRS降低。这些结果表明,HRS可能通过影响NMDA功能来发挥治疗作用,具体是通过减少磷酸化NR2B的水平,然而这一假设需要进一步确认。
现有发现表明,氢可以降低RSE大鼠的EEG强度。此外,氢在抵抗氧化应激和减少炎症方面的作用不容忽视。那么,由HRS处理引起的EEG强度降低以及抗氧化应激和抗炎效应是否能减少RSE引起的神经元死亡程度呢?为了检测HRS对原代培养神经元中抗氧化酶和抗凋亡分子表达的影响,我们使用无镁细胞模型模拟体内的病理变化。HRS增加了SOD2和Bcl-2的表达,这表明HRS可以通过增加抗氧化酶表达来发挥治疗作用,随后减少RSE诱导的氧化应激损伤。
在临床研究中,苯二氮卓类药物是治疗癫痫的一线药物。苯二氮卓类药物在终止早期发作方面非常有效;然而,随着时间的推移,这些药物终止发作的能力逐渐下降。在一些动物模型中,单独使用NMDA受体拮抗剂无法终止耐苯二氮卓类的发作。尽管如此,当这些药物与苯二氮卓类药物联合使用时,可以终止发作。这表明NMDA受体拮抗剂和苯二氮卓类药物具有协同效应。氢可以直接作用于NMDA受体,因此由于其出色的特性,氢在未来的RSE治疗中可能发挥越来越重要的作用。
现有发现表明,氢可能通过作用于NMDA受体来降低RSE模型大鼠的发作强度,并且可能通过抗氧化应激效应和减少炎症等机制发挥神经保护作用。然而,我们的研究存在一些局限性。例如,我们没有分析导致细胞死亡的氧化应激的具体途径,也没有评估NMDA受体如何可能降低发作强度。因此,需要进一步探索潜在的机制。
结论
氢可能通过作用于NMDA受体来降低RSE模型大鼠的发作强度。它也可能通过减少氧化应激和炎症等多种机制发挥神经保护作用。氢的优势在于它是安全的,并且可以轻易地穿过血脑屏障;因此,未来可能与苯二氮卓类药物联合使用来治疗SE,以改善患者的预后。
https://wap.sciencenet.cn/blog-41174-1427521.html
上一篇:氢气对健康人运动氧化应激的改善作用
下一篇:先天免疫力使记忆持续存在