博文
肥胖症的代谢性炎症及疗法
 精选
精选
|
Metaflammation in obesity and its therapeutic targeting | Science Translational Medicine
肥胖 [BMI> 30 kg/m2]在世界范围内非常普遍,超过42%的美国人口被认为是肥胖者,自1980年以来,70多个国家的肥胖率增加了一倍以上。肥胖是心血管疾病、II型糖尿病和癌症等一系列非传染性疾病的主要危险因素。尽管已知肥胖与所有代谢器官的炎症环境加剧有关,但肥胖免疫反应与心脏代谢并发症之间的统一机制联系一直难以描述,从而限制了治疗进展的潜力。然而,证据继续表明,营养过量会引起慢性低度炎症反应,这可能是心脏代谢并发症的基础,这已扩展到“代谢性炎症”的研究。在这里,我们概述了肥胖与炎症之间的联系,讨论了肥胖引发的免疫记忆,并回顾了免疫细胞中营养供应过剩的代谢反应。最后,我们确定了针对肥胖的临床方法及其对炎症的影响。
Michael W. Schleh et al.,Metaflammation in obesity and its therapeutic targeting.Sci. Transl. Med.15,eadf9382(2023).
一、肥胖相关炎症概述
肥胖伴有脂肪组织(AT)、肝脏、骨骼肌、胰岛和大脑等代谢影响组织的慢性低度炎症(图1)。炎性细胞因子信号转导会干扰胰岛素信号通路,导致葡萄糖摄取受损和脂肪分解失控,最终导致异位脂质储存和胰岛素抵抗的恶性循环。虽然本综述将重点关注脂肪组织,但许多优秀的文章总结了对其他器官的免疫贡献。脂肪组织内免疫细胞具有广泛的稳态功能,这些功能在肥胖时会发生变化。除了失去调节功能外,脂肪组织中免疫细胞的炎症表型升高通常还会导致全身并发症,例如胰岛素抵抗、高血糖和血脂异常,从而导致更大的心脏代谢疾病风险。此外,肥胖和代谢综合征中经常出现过量的促炎细胞因子释放到循环中,这表明炎症诱导是代谢疾病风险的临床生物标志物。因此,局部和全身炎症过程为免疫介导的治疗代谢性疾病提供了潜在的靶点。

图 1.肥胖症的器官特异性炎症反应。
(A) 炎症是一种协调的免疫反应,旨在减轻肥胖引起的压力,可发生在肝脏、胰腺、脂肪组织、骨骼肌和大脑等组织中。这些组织中的异位脂质积累可引发单核细胞募集、巨噬细胞极化至促炎状态、CD8 T 细胞积累和促炎介质的过度积累。(B) 对这些组织基质区室内正能量平衡的免疫反应会增加 1 型免疫(浅蓝线),包括 M1 样先天免疫细胞和 CD8 T 细胞。相反,肥胖会减弱 2 型免疫(绿线)表型,导致 M2 样先天免疫细胞和 T++注册和 CD4 适应性免疫细胞。肥胖症中 1 型和 2 型免疫之间的这种相互关系被认为是组织稳态和胰岛素抵抗的基础(深蓝线)。
在小鼠中,大多数研究分析了雄性动物的附睾白脂肪组织。然而,其他内脏脂肪库(肾周脂肪库、肠系膜脂肪库和网膜脂肪库)以及腹股沟皮下白色脂肪组织库和棕色脂肪组织库也可能与脂肪组织炎症相关的全身功能障碍有关。此外,组织特异性脂肪库(如血管周围和心外膜脂肪组织)以及皮肤和淋巴结周围的脂肪对组织稳态很重要,并且在肥胖时可能会改变,尽管对它们的讨论超出了本文的范围。
在人类中,大多数研究都分析了皮下和网膜白色脂肪组织仓库。尽管脂肪组织的炎症反应在小鼠中更为极端,但充足的人类数据表明,人类免疫景观也发生了类似的变化。例如,与瘦个体相比,肥胖者内脏脂肪组织中的巨噬细胞数量升高,与胰岛素抵抗相关,并预测血红蛋白 A1c (HbA1c) 浓度。
二、脂肪组织巨噬细胞
1、巨噬细胞极化
在简化和二分法范式中,巨噬细胞被描述为经典激活的 M1 样,或替代激活的 M2 样。这些极端状态基于细胞因子的体外极化,以产生专门用于响应组织内刺激的环境线索的巨噬细胞群。M1 样巨噬细胞可防御细胞内病原体,其特征在于产生促炎细胞因子 [例如,白细胞介素-6 (IL-6)、IL-1β 和肿瘤坏死因子-α (TNF-α)] 和诱导型一氧化氮合酶 (iNOS) 的表达。M2 样巨噬细胞由 IL-4 和 IL-13 诱导,并呈现以释放抗炎细胞因子 [例如,IL-10、IL-12 和转化生长因子-β (TGF-β)] 为特征的组织修复表型。与巨噬细胞表型的体外刺激相反,体内巨噬细胞沿极化态谱存在,单个细胞可同时表达两种 M1/M2 表型的基因/蛋白。
脂肪组织中的巨噬细胞极化一直是免疫代谢领域感兴趣的领域。在小鼠和人类的脂肪组织中,M1 和 M2 样巨噬细胞表达免疫细胞表面标志物 F4/80、CD11b 和 CD64,但也包含特定于其群体的唯一标识符。M1 样巨噬细胞在小鼠和人类中表达 CD11c ,在小鼠中表达主要组织相容性复合体 II 类 (MHCII),而 M2 样特征包括小鼠中的 CD206、CD163 和 TIM4 以及人类中的 CD206。确定肥胖症中巨噬细胞亚群的研究也揭示了小鼠和人类之间的差异。例如,皮下脂肪组织CD206 CD11c 细胞与人类胰岛素抵抗呈正相关,但这种双阳性群体在小鼠中可能不太普遍 。与其他组织一样,简单的 M1/M2 二分法不足以解释脂肪组织中巨噬细胞表型的全部范围。幸运的是,单细胞 RNA 测序、质谱细胞术和空间转录组学的技术和分析进步正在免疫代谢领域出现,从而可以分析功能多样化的免疫细胞群。
在考虑富含脂质、葡萄糖和胰岛素的局部脂肪组织环境时,可以对脂肪组织巨噬细胞 (ATM) 极化有进一步的了解。因此,肥胖症中的代谢激活 (MMe) 巨噬细胞表型比“M1”命名法更准确地描述了 ATM 极化状态。肥胖类患者 ATM 中 CD36、PLIN2 和 ABCA1 的体内细胞表面丰度是 MMe 细胞脂质处理功能的特征。体外MMe巨噬细胞可以通过代谢刺激(棕榈酸、葡萄糖和胰岛素)产生。下面详细介绍了这些处理脂质的巨噬细胞在脂肪组织中的功能。
2、脂肪组织稳态中特化的驻留巨噬细胞功能
巨噬细胞是脂肪组织中遗传和饮食诱导的肥胖中最丰富的免疫细胞群 。在瘦弱状态下,巨噬细胞约占所有脂肪组织免疫细胞的10%,并且可以扩增到肥胖中所有免疫细胞的40%以上。巨噬细胞具有高度的可塑性,并容易适应环境线索以保持组织稳态。组织内驻留于组织的巨噬细胞群的多样性表明了它们的稳态功能,包括组织修复、细胞碎片清除和代谢调节。特别是在脂肪组织中,它们的功能包括缓冲脂质和其他关键分子,抗原呈递以及协调细胞间和器官间串扰。
(1)脂质摄取和分配
MMe 极化的特征是脂质处理基因和蛋白的表达。CD9(称为 CD9ATM)和 Trem2 [称为脂质相关巨噬细胞 (LAM)] 的表达也发现了类似的脂质处理 ATM 群体 。在人类中也发现了富含脂质的 ATM 与 CD9 和 Trem2 标志物的关联 。脂肪组织中的 MMe、CD9 和 LAM 被提议用于帮助脂质的摄取和储存,以限制异位脂质积累。除了与脂质处理相关的转录谱外,它们还定位于冠状结构,以帮助清除死亡脂肪细胞周围的脂质。其他关于脂质处理 ATM 的研究报告了溶酶体生物发生和溶酶体依赖性脂质代谢的转录特征,表明自噬依赖性机制上调以帮助死亡脂肪细胞降解和脂肪酸再循环。ATM定位到死亡脂肪细胞周围的冠状结构,加上脂质摄取和分解代谢的转录模式,为ATM中的脂质摄取和储存提供了独特的作用。此外,脂肪细胞已被证明会释放充满脂质的外泌体,这些外泌体被免疫细胞感知,并直接促进骨髓来源的单核细胞分化为 MMe 样表型。虽然当脂肪细胞本身可以储存大量甘油三酯时,巨噬细胞需要缓冲脂肪组织中的脂质并不直观,但这里描述的报告支持ATM的这一功能。
(2)铁处理
铁是正常稳态功能所必需的,但过量时是有害的。我们已经描述了富含铁的巨噬细胞的一个子集——创造了MFehi通过铁摄取和储存的内在能力保护脂肪细胞免受铁超载。肥胖导致MFehi细胞减少和MFe中较低的铁含量细胞并发脂肪细胞超负荷,表明 MFehi细胞对脂肪细胞铁稳态很重要。此外,当巨噬细胞被 MMe 极化时,共培养中巨噬细胞和脂肪细胞之间的铁转移加速,脂肪细胞中的铁积累净增加。脂肪细胞铁浓度与全身代谢健康有关,因为通过铁转运蛋白缺乏导致脂肪细胞特异性超负荷导致葡萄糖耐受不良,而通过转铁蛋白受体缺乏降低脂肪细胞铁浓度可防止肥胖相关代谢功能障碍。此外,ATM 线粒体基质内铁定位的增加促进了 ATM 中的炎症表型,并直接提高了脂肪细胞中的线粒体铁含量。相反,低巨噬细胞铁含量与 M2 样表型和改善的葡萄糖耐量有关。因此,已发表的数据强烈支持ATM在脂肪组织铁稳态中的作用,这对于限制肥胖症中常见的氧化应激和胰岛素抵抗可能尤为重要。
(3)儿茶酚胺摄取和分解代谢
去甲肾上腺素信号传导的交感神经支配强烈地促进脂肪分解。脂肪组织中的神经相关巨噬细胞被称为交感神经元相关巨噬细胞 (SAM)。据报道,SAMs随着肥胖而增加,随着年龄的增长而减少。SAM 定位于神经束,其作用是通过调节去甲肾上腺素摄取和分解代谢来协调交感神经张力。在肥胖的背景下,增加 SAM 的激活和募集到脂肪组织旨在防止去甲肾上腺素溢出。消融 SAM 内吞和降解去甲肾上腺素的能力导致白色脂肪褐变和体重减轻。此外,这种细胞群似乎在人类中是保守的,使其成为减肥的潜在靶标。随着年龄的增长,SAM 的减少也部分解释了为什么老年人在白色脂肪组织脂肪分解方面存在缺陷。鉴于儿茶酚胺和脂质代谢之间的联系,SAMs似乎是一种重要的免疫细胞群,有望限制儿茶酚胺对脂肪组织的脂肪分解,并可能在肥胖和衰老中进一步保持葡萄糖耐受不良。
(4)抗原呈递
ATM 的另一个有趣的功能是抗原呈递,鉴于脂肪组织中存在记忆 CD4 和 CD8 T 细胞,这不足为奇(下文进一步描述)。小鼠 ATM 表达 MHCII,人 ATM 表达 HLA-D,表明抗原呈递能力。有趣的是,抗原呈递标志物 CD1A-E 在富含脂质的 CD11c ATM 中升高。在小鼠模型中,证明了 ATM 和 CD4 T 细胞之间的动态相互作用,MHCII 的缺乏导致脂肪组织中的 CD4 T 细胞减少。此外,将活化的抗原呈递细胞转移到瘦小鼠中会导致脂肪组织炎症和全身胰岛素作用受损。抗原呈递也可能与 CD8 T 细胞激活有关,因为在肥胖中,CD8 T 细胞的数量和克隆性增加。
(5)细胞间线粒体转运
最近的研究表明,巨噬细胞能够通过摄取细胞外囊泡或游离线粒体来协调细胞间和器官间线粒体转移。在肥胖的情况下,饱和脂肪酸可以减弱脂肪细胞和 ATM 之间的线粒体转移,导致线粒体以游离线粒体或细胞外囊泡的形式释放到循环中以供外周组织摄取。此外,巨噬细胞对线粒体摄取的遗传破坏会导致全身代谢失调。当考虑ATM的铁处理表型时,脂肪细胞和ATM之间的一些铁转移可能归因于这种线粒体转移。是否所有ATM都可以参与线粒体转移,或者是否有独特的子集负责此功能尚不清楚。
总之,这些数据证明了常驻ATM的多效性稳态功能。因此,需要仔细考虑针对 ATM 的治疗策略,因为相对于其解剖位置和在代谢中的作用,一些人群具有保守和有益的影响。
3.巨噬细胞募集和分化
组织巨噬细胞起源于在组织环境中增殖的常驻卵黄囊祖细胞,或将骨髓来源的单核细胞募集到组织炎症区域。具体而言,表达 Ly6C 的骨髓来源性单核细胞从其外周来源迁移到由趋化因子配体/受体(如 CCL2/CCR2)发出信号的炎症部位。例如,CCR2 Ly6C 单核细胞被认为在募集到脂肪组织后分化为 M1 样巨噬细胞,并且巨噬细胞上 CCR2 的缺失会导致单核细胞流入脂肪组织的减少。
在单核细胞募集到组织炎症部位后,来自组织生态位的环境线索成为巨噬细胞分化和极化的驱动因素。与具有高抗原特异性的适应性免疫细胞不同,先天免疫细胞不表达特异性抗原识别受体。因此,巨噬细胞极化是由细胞表面受体对组织微环境中配体的反应激活的。具体来说,模式识别受体 (PRR) 是宿主免疫系统的关键组成部分,可启动病原体识别和转录激活以响应感兴趣的特定病原体。在 PRR 家族中,Toll 样受体 (TLR) 信号转导已在先天免疫应答的早期激活中得到证实,其中 TLR 被提议通过刺激其配体 [来自饱和脂肪酸和脂多糖 (LPS)] 来“感知”营养过剩,以启动旨在满足细胞细胞和生物能量需求的信号通路。TLR 激活的规范模型对于理解导致肥胖和脂肪组织胰岛素抵抗中促炎环境的信号非常重要 。例如,配体激活 TLR 激活核因子 κB (NF-κB) 信号转导以产生炎性细胞因子以及先天免疫传感器的 Nod 样受体 (NLR) 家族,特别是 NLRP3 炎症小体,进而调节 caspase-1 的激活,以将细胞因子(如 pro-IL-1β)切割成其活性形式。因此,IL-1β 是另一种可能损害胰岛素信号传导并诱导脂肪分解的炎症介质。总之,通过先天免疫反应激活单核细胞旨在缓解肥胖引起的组织应激,但可能会带来代谢后果。
4. 肥胖症中的巨噬细胞生物能量学
(1)巨噬细胞生物能量学和极化
在过去的 15 年中,免疫学家对内在免疫代谢或生物能量通路在免疫细胞功能中的作用有了更深入的认识。优先使用糖酵解或氧化磷酸化 (OX PHOS) 生产 5′-三磷酸腺苷 (ATP) 可产生代谢物,用于细胞功能,例如增殖、氧化还原平衡、炎症信号传导、缺氧诱导因子-1α (HIF1α) 激活和表观遗传修饰。有趣的是,燃料利用和细胞极化之间的关系是相互的,因为激活某些代谢途径会影响细胞分化和极化,而细胞极化会影响生物能量途径的使用(图2)。例如,油酸的脂肪酸氧化可诱导 M2 极化,使用 IL-4 进行 M2 极化可驱动 OX PHOS 。

图 2.脂肪组织巨噬细胞具有不同的代谢表型。
(A) 在瘦脂肪组织中,巨噬细胞的代谢需求较低。T注册使用氧化磷酸化,PPARγ 驱动脂质处理相关基因的基因表达。其他脂肪免疫细胞的代谢尚不清楚。(B)在肥胖的脂肪组织中,巨噬细胞的糖酵解和氧化磷酸化增强,可能是由于炎症性脂质、缺氧、胰岛素和瘦素信号传导的增加所致。其他细胞类型,包括 TH1/17,T 淋巴细胞、中性粒细胞和树突状细胞也被推测会改变它们在肥胖中的代谢表型。
在脂肪组织中,主要在巨噬细胞中研究内在免疫代谢。在静息状态下,瘦ATM具有相对较低的代谢活动。 脂肪膨胀后,ATM 增加 OX PHOS(通常与 M2 极化有关)和糖酵解(通常与 M1 极化相关)。这种独特的生物能量状态支持数据,表明 ATM 不是 M1 或 M2,而是具有独特的“代谢激活”极化。
瘦 ATM 中的细胞因子产生由脂肪酸、葡萄糖和谷氨酰胺利用支持,而肥胖 ATM 中的细胞因子产生由糖酵解支持。糖酵解性巨噬细胞通常表达高水平的葡萄糖转运蛋白 Glut1,因此,假设 Glut1 髓系缺乏可改善 ATM 中的脂肪酸摄取和氧化。然而,与高脂饮食 (HFD) 喂养后的对照组相比,髓系 Glut1 缺乏小鼠的体重、肥胖或空腹血糖没有差异。然而,存在不稳定的动脉粥样硬化性病变和吞噬功能缺陷LDLR(LDLR)−/−缺乏髓系 Glut1 的小鼠,表明 Glut1 在巨噬细胞中的几种代谢功能以维持组织稳态。
总之,目前的文献表明,脂肪组织环境中的信号(脂质、葡萄糖和激素)不仅有助于MMe极化,还有助于肥胖症患者ATM的独特生物能量学。然而,关于我们如何靶向肥胖症的ATM代谢,还有很多需要了解的地方。ATM 的微阵列分析突出了许多代谢途径的基因表达变化,包括单碳代谢、氨基酸代谢、氨基/核苷酸糖代谢、果糖/甘露糖代谢、甘油脂代谢和鞘脂代谢。此外,肥胖的脂肪组织是乳酸和铁浓度升高的环境,它们可能在脂肪免疫细胞中驱动自身的代谢程序。因此,需要更多的研究来了解每种代谢途径对巨噬细胞功能的贡献,并确定是否可以靶向一种或多种代谢途径来改善肥胖症的 ATM 功能。
5、脂肪组织中的其他先天免疫细胞
其他先天免疫细胞群也存在于脂肪组织中。这些包括嗜酸性粒细胞、肥大细胞、中性粒细胞、树突状细胞 (DC) 和先天淋巴细胞 (ILC)。嗜酸性粒细胞和肥大细胞是否有助于脂肪组织稳态或功能障碍仍存在争议(图 3)。因此,我们在这里把注意力集中在发中国家和土著和地方社区上。

图 3.先天性和适应性免疫细胞对体重循环的反应。
瘦脂肪组织通常由 2 型免疫细胞(例如,M2 样巨噬细胞、TH2 个 CD4 T 细胞和 Treg).在肥胖症中,先天性和适应性免疫细胞募集都会导致更大的 1 型免疫细胞群,导致 M1 样巨噬细胞 T H1 CD4 T 细胞和 CD8 T 细胞的涌入。相反,Treg肥胖时人口减少。在体重减轻的情况下,炎性巨噬细胞和记忆 T 细胞保持完整,而 Treg人口不会恢复到原来的瘦弱比例。因此,在体重反弹的情况下(如在体重循环中),效应 T 细胞群与从上一个肥胖周期中积累的抗原呈递细胞相互作用,导致更大的适应性免疫细胞群(包括 CD8 T 细胞、CD4 T 细胞和 B 细胞)。图上的深蓝色曲线表示每次体重增加、减少和恢复的先天性和适应性免疫细胞群。++
(1)树突状细胞
脂肪组织中的 DC 一直被归类在巨噬细胞簇中,因为尽管 CD11c 表达重叠,但它们的功能多样性。具体而言,DC 在人类中被鉴定为 CD11c CD1c,在小鼠中被鉴定为 CD11c CD64+− 或 CD11c高F4/80型低 (此外,DC亚群可分为常规DC(cDC)亚群,包括cDC1和cDC2。先前的报告表明,DC 募集到脂肪组织中是由 CCR2 和 CCR7 介导的,并且在 HFD 喂养的小鼠中增加,并且与人类的 BMI 呈正相关 。DC 的具体功能仍不完全清楚,但有人提议将它们用作抗原呈递细胞来发出 CD4 T 细胞活化的信号。此外,DC 诱导辅助性 T17 (TH17+)小鼠分化并与T相关H人类 17 个 T 细胞。
(2)先天性淋巴细胞
ILCs被提议作为肥胖炎症反应的调节者和反应者。ILC 可根据细胞表面标志物和细胞因子释放按第 1 组 (ILC1)、第 2 组 (ILC2) 和第 3 组 (ILC3) 进行聚类。与先天细胞一致,ILC 对局部巨噬细胞和 DC 产生的细胞因子有反应,并且不存在抗原受体。ILC1 激活由 IL-12 细胞因子诱导,IL-12R/STAT4 信号转导介导 ILC1 激活并刺激干扰素γ (IFN-γ) 释放。在小鼠中,ILC1 主要驻留于组织,而自然杀伤 (NK) 细胞从骨髓前体募集并存在于循环中。局部细胞因子激活ILC1和NK细胞可作为前馈反应,以增加诱导肥胖免疫反应所必需的促炎环境。ILC2 是与 2 型免疫相关的先天免疫细胞群,由 IL-33 维持 。ILC2 在 HFD 喂养的小鼠和肥胖类患者中减弱 。有趣的是,ILC-2 促进小鼠脂肪细胞前体向 beiging 表型分化,表明 2 型 ILC 通过 IL-33 触发的环境线索调节组织稳态的潜在作用。
6.先天性脂肪组织免疫的未来发展方向
现在,大量的文献表明,巨噬细胞和其他先天免疫细胞在肥胖和炎症的发病机制中起着关键作用。触发先天免疫细胞募集和分化的环境线索因肥胖而加剧,巨噬细胞极化为不同的表型有助于改变脂肪组织功能。了解肥胖如何改变巨噬细胞亚群的分子和功能特征对于开发针对炎症的治疗策略仍然至关重要。
三、肥胖症中的适应性免疫细胞群
1、T淋巴细胞
T 细胞在脂肪组织的适应性免疫细胞中占最大比例,其中 CD4 和 CD8 T 细胞占主导地位。它们各自在瘦身条件下的脂肪组织稳态和肥胖的脂肪组织炎症中发挥着独特的作用。++
2、CD4 T细胞
CD4 T细胞可分为两大类:促炎性(T+H1 和 TH17) 和抗炎 [TH2 和 T注册(调节性T细胞)]。在瘦脂肪组织中,CD4 与 CD8 的比例为 3:1;然而,肥胖会增加 CD8 T 细胞群 。这反过来又增加了炎症性 T 的比例+++H1 至抗炎 TH2 个 CD4 T 细胞。此外,T+注册在HFD喂养的小鼠中,种群对维持脂肪组织内的稳态很重要,可减少多达70%。强制减少 T注册群体显著增加脂肪组织内的巨噬细胞和效应 T 细胞群 。这种向更促炎人群的转变在内脏脂肪组织中最为普遍,并导致肥胖相关的脂肪组织炎症。在饮食诱导的肥胖模型中,T注册减少并集中在脂肪细胞周围的冠状结构中,表明它们在维持全身代谢中的作用 。T注册富含瘦脂肪组织和表达参与脂质代谢的基因(CD36、DGAT1 和 LDLR),这些基因由过氧化物酶体增殖物激活受体 γ (PPARγ) 驱动 。在 T 中特异性缺失 PPARγ注册增加HFD喂养后促炎巨噬细胞和单核细胞的浸润,并消除吡格列酮的胰岛素增敏作用,吡格列酮是美国食品和药物管理局(FDA)批准的用于治疗2型糖尿病的药物。
3、CD8 T细胞
饮食诱导的肥胖引起 CD8 效应 T 细胞的早期增加,随后巨噬细胞浸润到小鼠的内脏脂肪组织库和人类的皮下脂肪组织。CD8 T 细胞与局部巨噬细胞相互作用,引发巨噬细胞分化、活化和迁移,引发炎症,导致胰岛素抵抗。CD8 T 细胞浸润先于 Treg。CD8 耗竭研究导致炎症性巨噬细胞浸润和肥胖脂肪组织中通常观察到的下游炎症级联反应受到抑制。一个不断扩大的研究领域与观察到 T 细胞耗竭(最常与肿瘤微环境和病毒感染相关)在小鼠和人类的肥胖脂肪组织中也增加有关。具体来说,这些耗竭的 CD8 T 细胞是效应记忆 T 细胞,它们在表面蛋白水平表达 PD1 和 TIGIT,在基因水平表达 Pdcd1、Tox、Entpd1、Tigit 和 Lag3。T 细胞耗竭与肥胖症脂肪组织炎症和功能的相关性尚不完全清楚。
4、γ-δ (γδ) T 细胞
γδ T 细胞是存在于小鼠和人类中的一类驻留于组织的淋巴细胞,主要作用是防御皮肤、肠道和肺等上皮组织中的病原体。γδ T 细胞也存在于脂肪组织中,占小鼠 CD3 T 细胞的 ~4% 至 11% 。γδ T 细胞的独特之处在于它们对抗原呈递的反应类似于传统 T 细胞,但也对细胞因子做出反应,弥合了先天免疫和适应性免疫之间的差距。在小鼠中,脂肪组织中的 γδ T 细胞已被证明会增加肥胖,并且会分泌细胞因子 IL-17 和 TNF-α 。γδ T 细胞释放的 IL-17 可能会限制脂肪生成,增加 M1 样 (CD11c CD206-) 巨噬细胞,并限制葡萄糖耐量 。在人类中,循环 γδ T 细胞随着肥胖而减少,但网膜脂肪组织γδ T 细胞增加。未来分析肥胖症中γδ T细胞的研究应确定负责γδ T细胞活化和γδ T细胞下游T细胞活化的先天信号。
5、肥胖症中的T细胞克隆性
适应性免疫的一个标志是暴露于特定抗原后特异性 T 细胞群和 B 细胞群的克隆扩增。值得注意的是,在小鼠从脂肪组织中分离的 CD4 和 CD8 T 细胞上发现了限制性 T 细胞受体 (TCR) 序列。更有趣的是,对于肥胖症,Treg克隆扩增减少,而 CD8 克隆扩增增加。Treg从瘦内脏脂肪组织中分离出的 TCR 序列受限,表明它们对选定的局部抗原群体有反应。关于肥胖脂肪组织中的CD8 T细胞,对潜在的抗原知之甚少。在我们的研究中,与克隆 TCR 的互补决定区 3 相对应的氨基酸序列被表征为带正电荷和非极性。异乙蒲甘素带负电荷,并在 ATM 中大量检测到,这表明它们可能是能够刺激 CD8 T 细胞增殖的脂肪组织微环境的一个组分。然而,仍然需要鉴定驱动CD8 T细胞克隆扩增的特定抗原。此外,调节人类肥胖症CD8 T细胞扩增的机制仍不清楚。
6、B淋巴细胞
与调节性 B-1 细胞相比,脂肪组织中的 B-2 细胞会产生发炎环境,分泌更多的促炎细胞因子,如 IL-6 和 IFN-γ,而牺牲了抗炎细胞因子,特别是 IL-10 。过度肥胖导致 B-2 细胞在内脏脂肪组织中积聚,加重组织的炎症。在泛 B 细胞无效小鼠中,脂肪细胞肥大得到缓解,巨噬细胞浸润显著减少,葡萄糖耐量得到改善 。在 B 细胞无效动物中观察到的肥厚性肥胖和葡萄糖耐量恶化受 B 细胞调节脂肪组织中 T 细胞的能力的影响。在T细胞活化研究中,来自B细胞缺陷小鼠的细胞减少了促炎细胞因子的产生。当RAG1−/−在HFD喂养的小鼠中,从16周开始用B细胞重建小鼠。尽管重建,但空腹血糖、胰岛素和葡萄糖耐量并未恶化,这表明 B 细胞需要 T 细胞的存在才能影响代谢功能。
7、自适应脂肪组织抗扰度的总结和未来发展方向
适应性免疫细胞对脂肪组织稳态和功能障碍的贡献仍然是一个有趣的研究领域。悬而未决的问题包括:为什么 T 细胞的克隆程度会随着肥胖而改变(随着 T 降低注册以及 CD4 和 CD8 细胞增加)?是否有特定的抗原可以靶向减少脂肪组织炎症?T细胞耗竭和B细胞抗体产生与脂肪组织功能有何关系?此外,虽然 T 细胞在癌症背景下的生物能量学已得到充分证明,但脂肪组织环境是否会改变内在 T 细胞代谢尚不清楚。例如,虽然 T++注册已做好充分准备代谢脂质,以实现其在体内平衡中的调节功能,关于瘦和肥胖脂肪组织中其他脂肪免疫细胞类型(T 细胞和 B 细胞及其亚群)的代谢,还有很多需要了解的地方。
四、对体重减轻和恢复的免疫反应
体重循环被松散地定义为体重的反复增加和减少。大多数关于体重循环的文献都是几十年前发表的,旨在确定体重波动是否对食品效率和能量需求产生负面影响。最近的研究揭示了体重循环与胰岛素抵抗和心血管疾病风险增加之间的关联。 解决这一问题的首批研究之一报告说,与保持体重稳定的男性相比,体重循环的男性的25年冠状动脉死亡风险增加了10%。此外,最近的多篇出版物表明,体重大幅减轻后体重恢复对人类代谢健康有负面影响。 新兴研究提供的证据显示,脂肪组织免疫记忆可能与体重循环的代谢后果有关。
1、对代谢信号的适应性免疫记忆
为了研究体重循环的细胞类型和分子贡献者,研究人员转向了小鼠模型,这些模型可以概括体重循环的许多不良代谢后遗症。在小鼠中,既往肥胖导致体重以更快的速度恢复、更大的脂肪堆积和以 I 型免疫细胞为特征的适应性免疫应答 。CD4 T 细胞已在体重循环小鼠模型中进行了深入研究。抹布1+−/−(缺乏 T 细胞和 B 细胞)、TCRβ−/−(缺乏 CD4 和 CD8 T 细胞)和 H2A−/−(缺乏 CD4 T 细胞)小鼠受到保护,不会加速体重反弹。有趣的是,当用来自有肥胖史的野生型小鼠的CD4 T细胞重建时,Rag1+−/−和 TCRβ−/−小鼠体重增加得比从瘦对照组接受CD4 T细胞的小鼠更快。我们实验室的研究表明,体重循环小鼠的脂肪组织中 CD8 效应记忆 T 细胞增加。关于体重减轻和恢复的极端程度,体重周期的数量是否重要,T细胞克隆性在体重循环中是否与维持肥胖不同,以及人类脂肪组织的免疫景观在多大程度上受到体重循环的影响,仍然存在悬而未决的问题。这些发现表明,脂肪组织中的适应性免疫细胞群具有高度可塑性,应该进行进一步的工作,以更好地表征脂肪组织中和体重循环每个阶段代谢活性组织中的这些细胞群。
体重循环引起的免疫变化的原因可以通过评估减肥后的脂肪组织免疫景观来获得。令人惊讶的是,体重减轻的动物的脂肪组织并没有完全恢复到瘦的抗炎表型(图3)。 此外,最近的研究表明,最高比例的 T 细胞和 B 细胞发生在体重循环的减重阶段。这些数据表明,尽管体重减轻改善了全身代谢过程,但脂肪组织免疫系统可能会“记住”以前的肥胖,并在体重恢复时过度激活。
2、对代谢信号的先天免疫记忆
尽管免疫记忆历来被认为是仅适应性免疫细胞的特征,但最近的研究表明,先天免疫细胞也可以发展出非特异性记忆。β-葡聚糖、结核分枝杆菌疫苗 (BCG) 甚至氧化的低密度脂蛋白 (LDL) 激活 PRR 可以驱动代谢激活和持续的表观遗传重塑,以引发细胞在第二次刺激后产生更强烈的反应。具体而言,先天刺激可以驱动糖酵解 ATP 的产生,因此乙酰辅酶 A 等代谢中间体可以帮助乙酰化组蛋白。这些组蛋白修饰可以在糖酵解和炎症基因上保持染色质的开放区域,以便在随后激活时更快地转录。
尽管这种反应在对感染的反应中可能在进化上具有保护作用,但在慢性疾病中似乎是有害的。我们最近表明,骨髓来源的巨噬细胞在用脂肪组织条件培养基或棕榈酸酯引发后可以产生增强的二次激活,这依赖于 TLR4 并被二甲双胍或泛甲基转移酶抑制抑制。此外,来自先前肥胖小鼠的 ATM 在用 LPS 离体激活后分泌更多的炎性细胞因子,并且在体重恢复后更具炎症性。同样,其他人已经表明,生酮饮食和棕榈酸注射剂通过神经酰胺产生和硬脂酸(通过TLR4)加重全身LPS诱导的炎症,并且先前的肥胖诱导ATM中的染色质重塑,这使小鼠容易恶化黄斑变性。其他先天免疫刺激已显示出甲羟戊酸以及与脂肪酸代谢和OX PHOS相关的基因变化中发挥作用。因此,ATM似乎具有独特的位置,可以响应脂质的激活和摄取而发展先天免疫记忆,未来的研究应旨在了解ATM记忆如何影响代谢和免疫疾病。
总之,这些数据表明,免疫系统的多个分支会记住以前的肥胖症,临床减肥方法应努力实现长期疗效。此外,进一步了解驱动和维持肥胖免疫记忆的信号可能会提供额外的治疗靶点,以减轻与体重反弹相关的疾病。
五、针对人类肥胖和转移性炎症的临床方法
1、抗炎疗法试验
尽管慢性炎症与动脉粥样硬化性心血管疾病和2型糖尿病等代谢性疾病密切相关,但与降脂降糖药物相比,抗炎疗法在临床应用方面尚处于起步阶段。最早的研究之一集中在2型糖尿病患者的丹柳酸盐和血糖控制上。在三种不同剂量下,丹柳酸盐治疗导致 HbA1c 浓度和其他血糖控制标志物显着降低。最近,CANTOS(Canakinumab 抗炎血栓形成结果研究)试验(有 ~10,000 名患者)提供了概念证明,即靶向炎性细胞因子(在本例中为 IL-1β)可以降低心肌梗死、卒中和心血管死亡的复合主要终点的发生率。有趣的是,canakinumab治疗组的癌症死亡率也有所降低。然而,每 750 名患者中就有 1 名发生严重感染。这并没有减少对使用抗炎剂治疗心脏代谢疾病的想法的热情;然而,其他方法,例如改进促消退过程以限制急性炎症反应,现在被认为是更好的方法。
2、生活方式干预
通过改变生活方式、药物治疗或手术来减轻体重是肥胖及其相关心脏代谢并发症的主要推荐干预措施。适量的体重减轻(~5%体重)可改善人类的代谢结果。临床试验发现,尽管胰岛素敏感性有所提高,但适度体重减轻不会影响肥胖成人的脂肪组织炎症。相反,更渐进的体重减轻(~11%至16%)足以减少全身和脂肪组织炎症。因此,我们推测人类对体重减轻的免疫反应是双相反应,其中巨噬细胞亚群在脂肪组织中增加以经历组织重塑和由脂肪分解衍生的缓冲脂质积累 ,但可能会随着持续的体重减轻而减少。然而,鉴于强有力的数据显示,体重减轻的小鼠的脂肪组织中持续的炎症免疫细胞,需要对人类进行更广泛的研究。在这里,我们重点介绍了减肥的药物和手术方法,并讨论了它们对脂肪组织和全身炎症的影响。
3、饮食调整
负能量平衡对促炎标志物的影响已在肥胖个体中进行了临床研究。在临床体重管理中,建议患者专注于未加工的食物,重点是全谷物、瘦肉蛋白、新鲜水果和蔬菜,以及有限的精制糖和面粉。一项研究表明,当脂肪量下降后实现能量稳态时,高敏 C 反应蛋白 (CRP) 和 IL-6 会降低 。然而,含有类胡萝卜素,混合生育酚,维生素C或硒的富含抗氧化剂的食物并未被一致证明可以减少炎症标志物。通常,患者选择无乳制品饮食作为诱导体重减轻的方法,尽管缺乏证据表明体重,脂肪,内脏脂肪组织和皮下ATM数量,皮下脂肪组织炎症基因表达和乳制品循环细胞因子增加。另一方面,地中海饮食的特点是大量食用豆类,坚果,种子和橄榄油,并适量摄入蛋白质,已被证明可以减少炎症。
4、体力活动
美国心脏协会建议每周至少锻炼 150 分钟,以促进和保持健康。在临床体重管理环境中,根据标准护理指南,为患者提供结构化和非结构化的身体活动建议。在一项研究中,6 个月和 12 个月的常规运动导致瘦素、脂联素、抵抗素、同型半胱氨酸和 IL-6 水平降低,尤其是在超重(BMI、≥25 和 <30 kg/m)的患者中2)。以结构和一致性为重点的强化运动对于产生低炎症状态可能是必要的,尤其是在肥胖症患者中。
5、药物干预
直接旨在减少炎性细胞因子的药物干预已证明成功,通过减少循环中的 CRP 和 IL-6 以及由此减少心血管事件来衡量 ,但目前尚无标准治疗肥胖症。旨在减轻肥胖(特别是 2 型糖尿病)代谢影响的药物干预侧重于参与胰岛素作用的途径。偶然的是,这些有时会导致减肥的额外好处。这些途径包括肠促胰岛素和钠-葡萄糖协同转运蛋白 2 (SGLT2) 抑制剂,我们将在下面重点介绍。
6、胰高血糖素样肽1受体激动剂
肠促胰岛素效应描述了口服葡萄糖比静脉注射葡萄糖更大程度地增加胰腺胰岛素分泌的现象。这是由于肠促胰岛素激素葡萄糖依赖性促胰岛素多肽 (GIP) 和胰高血糖素样肽 1 (GLP-1) 的分泌。GIP 和 GLP-1 直接作用于β细胞以促进胰岛素分泌。GLP-1在肥胖个体中较低,并且在减肥手术后增加。GLP-1受体激动剂(GLP-1RAs)可降低血糖,导致体重减轻,并减少糖尿病患者心血管原因,非致死性卒中和心肌梗死导致的复合死亡。
在动物模型中,GLP-1RAs已被证明可以减少炎症。在肥胖动物中,用GLP-1RAs治疗可降低脂肪组织炎性细胞因子,并导致从促炎性巨噬细胞表型转变为抗炎性巨噬细胞表型。 GLP-1RA治疗非肥胖糖尿病小鼠新发糖尿病增加T注册 (此外,GLP-1RA 治疗通过抑制脉管系统中的炎症通路来减少 ApoE 和 LDLr 敲除动物的动脉粥样硬化。尽管GLP-1RAs具有改善动物炎症和限制人类心血管结局的治疗潜力,但它们对人类脂肪组织免疫谱的影响仍未得到证实。
人体研究提供了相互矛盾的结果。在两项针对成人肥胖和 2 型糖尿病的研究中,GLP-1RA 增加了循环脂联素浓度,降低了促炎细胞因子 TNF-α、IL-1β 和 IL-6 的循环浓度;可溶性CD163;和类似 M1 的 ATM。 然而,另一组发现 GLP-1RA 增加循环 MCP-1、TNF-α、MCP-1 的表达和脂肪组织细胞外基质沉积的标志物。尽管GLP-1RAs在改善心脏代谢结局和葡萄糖耐量方面有希望,但这些临床试验的持续时间从8周到1年不等,通常发生在2型糖尿病患者中(表1)。因此,GLP-1RAs对肥胖的影响与代谢性疾病发作无关尚不清楚。此外,有必要进行更多研究,严格分析GLP1-RAs对脂肪组织免疫细胞表型的影响。最后,对照试验比较GLP-1RAs独立于减肥或与生活方式干预相结合的效果,可以确定额外的治疗潜力。
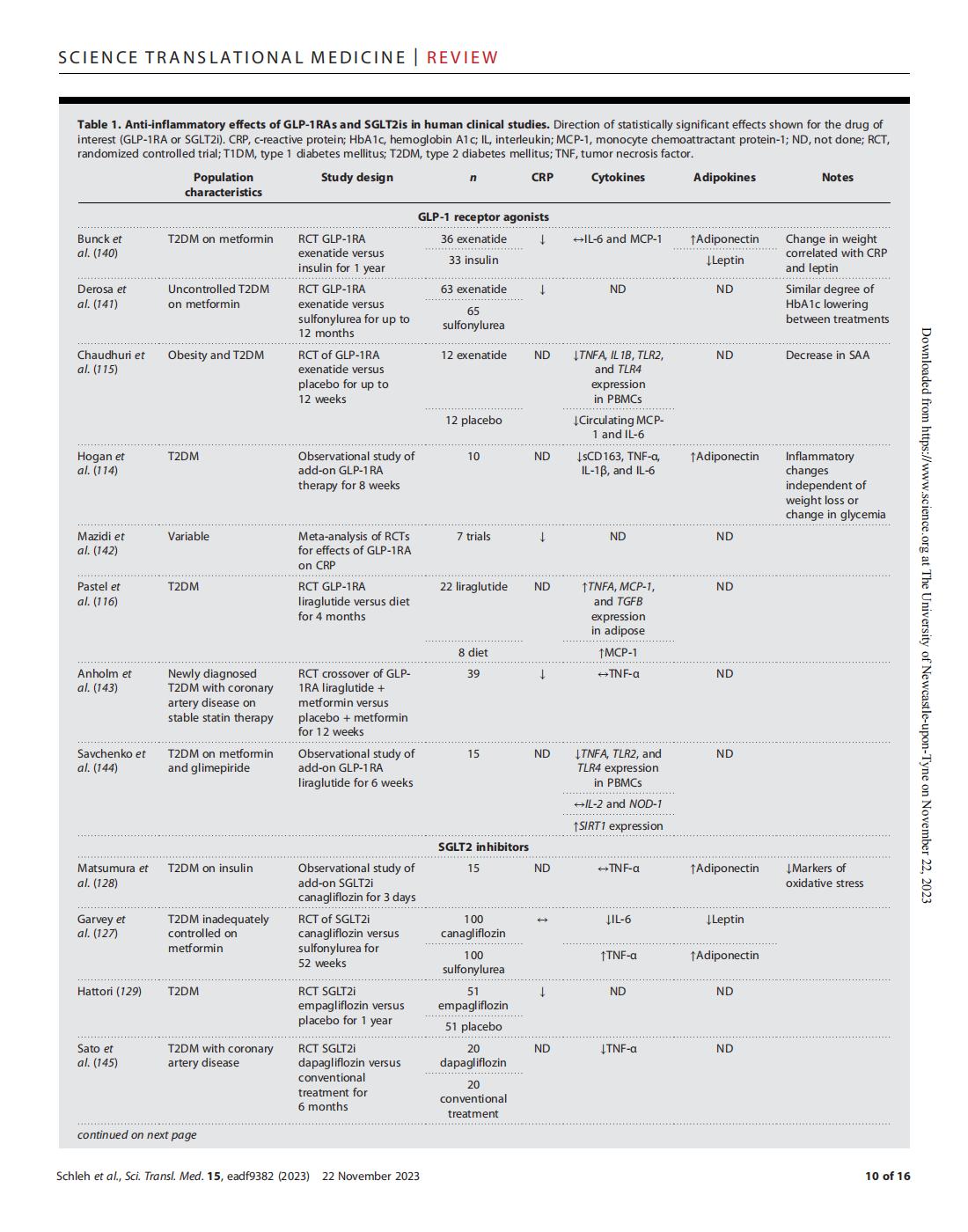
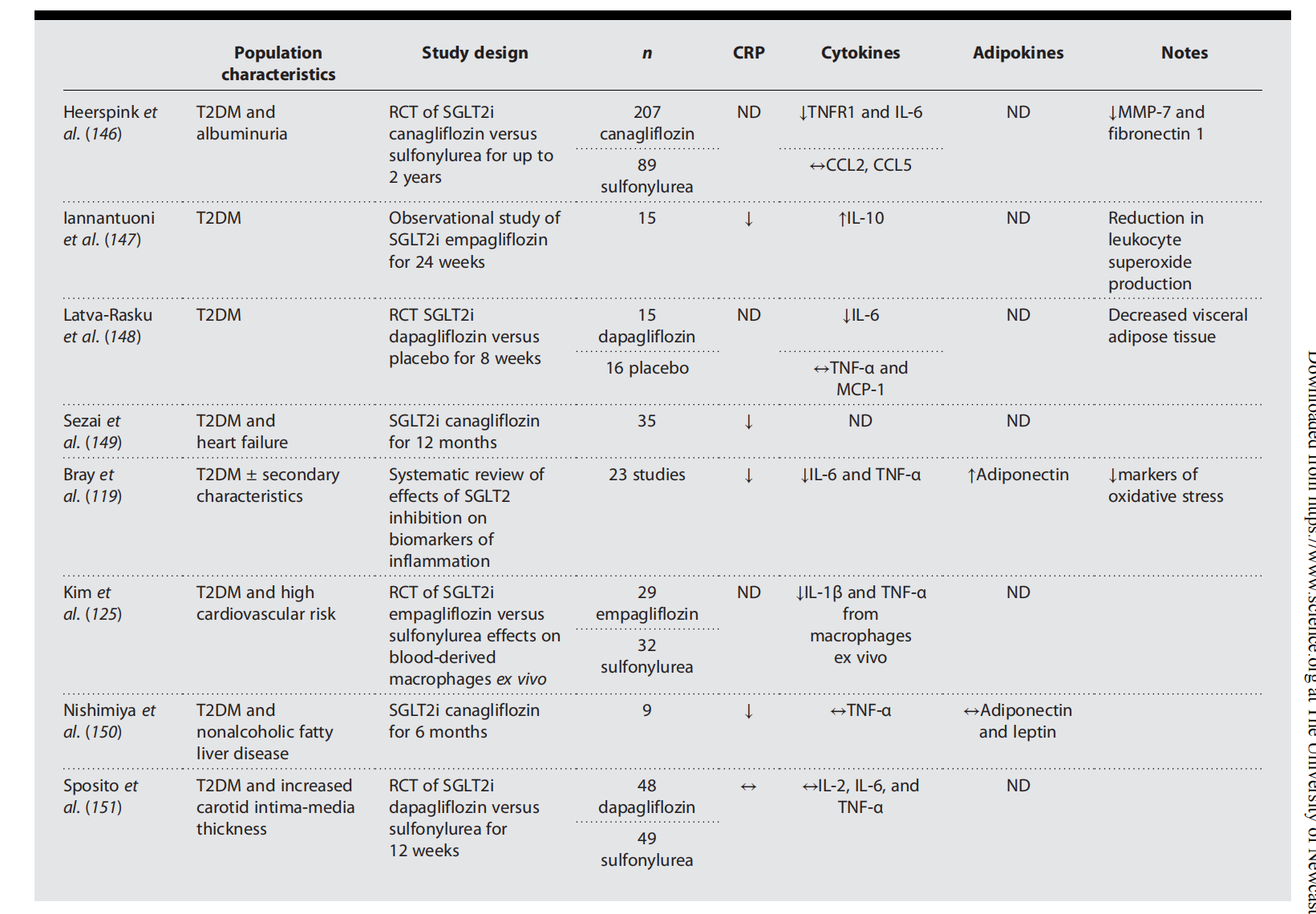
表 1.GLP-1RAs和SGLT2is在人体临床研究中的抗炎作用。
7、Sodium-glucose cotransporter 2 抑制剂
钠-葡萄糖协同转运蛋白 2 (SGLT2) 负责肾脏中 90% 至 97% 的过滤葡萄糖的重吸收。SGLT2 抑制剂可引起糖尿,降低 HbA1c,并诱导体重减轻 2-3 kg 。大型心血管结局试验还表明,SGLT2抑制剂可显著减少2型糖尿病和已确诊心血管疾病患者的主要不良心血管事件,并且对心力衰竭和慢性肾脏病的一级和二级预防有效。
与GLP-1RAs类似,SGLT2抑制剂也可减少动物的炎症,并可能减少人类的炎症,正如最近所报道的那样。SGLT2 抑制剂在体外小鼠和人细胞系以及 LPS 刺激后体内减少促炎细胞因子(IL-6 和 TNF-α)的产生 。在糖尿病、易发生动脉粥样硬化的 ApoE 敲除小鼠中,SGLT2 抑制剂可独立于体重减轻而降低主动脉促炎基因表达并降低 NLRP3 炎症小体激活。最后,SGLT2 抑制剂在饮食诱导的肥胖小鼠模型中将 ATM 从促炎表型偏向抗炎表型。在人类中,SGLT2 抑制剂在体内处理 30 天后减少血源性巨噬细胞中 NLRP3 炎症小体的激活 和体外 IL-17A 刺激后的人主动脉平滑肌细胞中的 NLRP3 炎症小体激活 。此外,SGLT2抑制剂在多项研究中增加循环脂联素。2 型糖尿病患者的附加 SGLT2 抑制剂可降低 CRP,这与胰岛素抵抗的改善相关。尚缺乏确定SGLT2抑制剂对组织特异性免疫细胞群(如脂肪组织中的免疫细胞群)影响的对照临床研究,以及与减肥联合或独立于减肥的治疗效果。尽管SGLT2抑制剂在糖尿病人群中具有可喜的影响,但对非临床肥胖人群的影响尚不清楚。
8、减肥手术
脂肪细胞来源的炎症因子在肥胖个体中升高,并导致肥胖症中常见的代谢和血管紊乱。鉴于肥胖和促炎状态之间公认的联系,减肥手术后明显的体重减轻可能会减少炎症。令人惊讶的是,研究表明术后炎症标志物的变化各不相同。
Roux-en-Y 胃旁路术 (RYGB) 后 2 年,超过 75% 的患者出现糖尿病缓解,并且通常在术后立即看到血糖控制的改善,然后发生显着的体重减轻。关于这种现象背后的确切机制存在争议。我们知道血糖改善部分归因于肠促胰岛素分泌增加,但另一种理论是手术后炎性细胞因子显着减少。这也可以解释减肥手术后肥胖心血管并发症的减少。
尽管炎症可能难以量化,但已经在 RYGB 后人群中研究了关键的炎症标志物,其中引用最多的是 IL-6、TNF-α、CRP 和血清淀粉样蛋白 A (SAA)。IL-6 是一种细胞因子,与肥胖相关的代谢下降有关。大多数 RYGB 研究一致认为,这种细胞因子在术后急性期可以增加,但在术后 1 年内显示出长期下降趋势。一项研究显示了白细胞介素反应的不同三相模式:3 个月时急剧下降,然后在 6 个月时稳步上升到术前值,12 个月时呈下降趋势,具体取决于 BMI 和代谢状态变化。关于 RYGB 后 TNF-α 变化的小型研究并未显示出一致的趋势,其中 TNF-α 已被证明在手术后 3 个月增加并恢复到术前基线。然而,最近对 116 项评估术后 12 个月 TNF-α反应的研究进行的荟萃分析显示,与基线相比显着下降。CRP 是一种急性期肝蛋白,与炎症状态和心血管疾病密切相关。研究表明,经过各种类型的减肥外科手术后,CRP 持续降低,包括 RYGB、垂直袖状胃切除术和腹腔镜可调节胃束带术。在一项针对 66 名接受 RYGB 的肥胖参与者的研究中,术后 1 年的 CRP 降低了 82%,并且没有胰岛素抵抗的患者的降低更高。此外,使用高灵敏度 CRP 测试的纵向分析显示,在 RYGB 后 3、6 和 12 个月时,该标志物逐渐下降,这与 BMI、胰岛素和 HOMA-IR 相关。SAA是肝脏中因炎症而产生的另一种急性期反应物,与动脉粥样硬化呈正相关。上述研究表明,在各种减肥外科手术中,SAA的降低也持续降低,尽管SAA的降低不如CRP的降低那么明显。
总之,证据证实减肥手术后急性期反应物 CRP 和 SAA 减少,但炎性细胞因子的变化不一致。这可能部分是由于术后卡路里摄入量的剧烈变化,也可能是宏量营养素组成的剧烈变化。需要更多的研究来评估减肥手术对炎症标志物的长期影响。
9、新兴疗法
虽然老一代抗肥胖药物疗法可以实现比基线减轻约 3% 至 7% 的体重,但最近的治疗方法显示体重减轻超过 15%。这些药物包括肠促胰岛素疗法,如索马鲁肽和替西帕肽,这两种疗法均已证明安全性和耐受性。索马鲁肽(2.4mg)现已获得FDA批准用于慢性体重管理,鉴于最近的SURMOUNT-1研究显示体重减轻22.5%,tirzepatide预计将被FDA批准用于肥胖症。虽然 3% 至 5% 的体重减轻意味着具有临床意义的体重减轻,但 >10% 至 15% 的体重减轻可以恢复或改善更严重的炎症性疾病,例如非酒精性脂肪肝和心血管疾病。此外,索马鲁肽在2型糖尿病患者的心血管风险概况已被证明不劣于安慰剂。
在临床上,对于代谢紊乱和炎症过程恶化的患者,这些较新的疗法比老一代化合物更受欢迎。目前,研究正在进行中,SELECT(索马鲁肽对超重或肥胖人群心血管结局的影响)是第一个心血管临床试验,用于衡量抗肥胖药物索马鲁肽在减少主要不良心血管事件方面的优越性。随着越来越多的新型肥胖药物获得FDA的批准,深入了解其作用机制和对炎症的影响可以增强我们对这些药物的临床应用,不仅针对严重肥胖,还针对与体重相关的并发症。
六、结论
了解肥胖诱导的变性炎症的直接和间接影响对于进一步了解肥胖如何加速心脏代谢疾病非常重要。尽管为确定导致肥胖代谢功能障碍的细胞介质做出了巨大努力,但由于肥胖中先天性和适应性免疫细胞的多样性,针对单一机制的药理学方法仍然很困难。技术进步和多组学平台的可用性将继续提高我们对与代谢功能障碍相关或直接导致代谢功能障碍的免疫群体的理解,并提出新的治疗靶点。研究人员应继续研究肥胖诱导的免疫细胞群的修饰是否是导致代谢健康结果不佳的原因。同样,肥胖药理学研究的一个重要问题是确定直接针对减肥的疗法是否能额外减轻肥胖引起的炎症,或者肥胖的减肥作用是否独立于药物干预而驱动减弱的炎症表型。
https://wap.sciencenet.cn/blog-41174-1410844.html
上一篇:大脑如何知道吃饱?
下一篇:肥胖和寿命的关系