博文
代谢学人--Nature:糖原代谢—“甜甜”的脂肪会产热
||
代谢学人
Nature:糖原代谢—“甜甜”的脂肪会产热

撰文 | 生茂正 郭文秀 张喆 于剑
编辑 | 孟美瑶
校对 | 于剑
小编有话说
糖原通常被认为是细胞中能量储存和利用的首选。胰岛素和肾上腺素对糖原合成和降解的调节作用在肌肉和肝脏中已有广泛的报道,但在脂肪细胞中研究得较少。本研究发现受儿茶酚胺调节的糖原代谢对UCP1表达起重要作用。慢性β-肾上腺素能激活导致表达UCP1的脂肪细胞中糖原积累增加。PTG(小编注:Protein targeting to glycogen,蛋白靶向糖原,由PPP1R(Protein Phosphatase 1 Regulatory Subunit , 蛋白磷酸酶 1 调节亚基)编码。PTG在对胰岛素敏感的组织中高表达。通常情况下,PTG是以蛋白的形式发挥功能,当解释其由PPP1R3C编码时,会将其作为亚基进行描述。)缺失使米色脂肪细胞中的糖原水平和UCP1的表达降低并减弱了寒冷或β-肾上腺素能受体刺激导致肥胖小鼠体重下降的程度。机制上,糖原转换(turnover)能够产生活性氧,激活p38 MAPK驱动UCP1的表达。因此,糖原在脂肪细胞中将糖代谢与产热联系起来,从而发挥关键的调节作用。
拓展阅读
蛋白靶向糖原
PTG在控制糖原合成方面起重要作用。在体内,PTG可以调节肝脏,肌肉和脂肪等多种组织中的糖原水平,以诱导糖原合成。1997年研究人员首次在3T3-L1细胞中发现PTG,它与磷酸化酶激酶、磷酸化酶 a和糖原合酶形成复合物,参与糖原代谢。
在哺乳动物细胞中,糖原是葡萄糖的主要储存形式。控制糖原合成和降解的限速酶分别是GS(Glycogen synthase, 糖原合酶)与GP (Glycogen phosphorylase, 糖原磷酸化酶)。PTG可以直接与PP1、GS、GP和磷酸化酶激酶结合,表明其可作为糖原合成的分子支架。在糖原颗粒中,PTG与PP1底物酶形成复合物,组装参与糖原代谢的蛋白质,并通过PP1对GS与GP进行去磷酸化。GS在去磷酸化后被激活,GP则失活。通过这种调控,PTG可以促进糖原合成并抑制糖原分解。因此,先前的研究发现在肝脏或脂肪细胞中,过表达PTG可以显著增加细胞中的糖原水平。另外,在骨骼肌中,PTG也具有不可忽视的作用。骨骼肌中的IRF4可以通过PTG调控肌糖原含量、调节肌肉的适应性代谢反应,进而影响运动能力。
参考文献:
[1]Zhu X et al.Adv Sci (Weinh). 2020 Aug1;7(19):2001502.
[2]Yang R et al.BiosciRep. 2015 May 1;35(3):e00207.
[3]Printen JA, Brady MJ, Saltiel AR.Science. 1997 Mar 7;275(5305):1475-8.
[4]Brady MJ et al.JBiol Chem. 1997 Aug 8;272(32):20198-204.
[5]Brady MJ, et al. Trends Endocrinol Metab.1999;10(10):408-413.
背景介绍
增强脂肪细胞产热被广泛认为是一种增加能量消耗、减轻体重、改善胰岛素抵抗的治疗方法。WAT(White adiposetissue,白色脂肪组织)棕色化(White fat browning,也称为“米色化”,beiging)有助于调节代谢稳态。WAT的棕色化特征是出现“米色”脂肪细胞,发生线粒体富集,并产生多房脂滴和UCP1 (Uncouple protein 1,解偶联蛋白1)的高表达。虽然存在UCP1非依赖的产热途径,但UCP1产热途径仍然是棕色和米色脂肪细胞产热的主要机制。Ucp1的转录受多种因素调控,其中包括通过β-肾上腺素能受体的交感神经激活。延长冷刺激或多次注射β-肾上腺素能激动剂均可上调Ucp1的mRNA和蛋白表达,并诱导iWAT棕色化。
而糖原作为能量储存和利用的主要成分,在能量代谢的过程中同样不可忽视。已有研究报道,GS(Glycogen synthase,糖原合成酶)作为糖原合成中的限速酶,可以被蛋白激酶磷酸化失活,也可以由PP1 (Protein phosphatase 1,蛋白磷酸酶1)去磷酸化激活。而GP(Glycogen phosphatase,糖原磷酸化酶)是糖原分解的限速酶,它催化糖原的磷酸解作用,使糖原分子从非还原端逐个断开α-1,4-糖苷键移去葡萄糖基,从糖原中释放出1-磷酸葡萄糖。GP和 GS 活性的相互变化部分是由蛋白磷酸酶-1的糖原靶向蛋白(例如本文研究的PTG)介导的,这些蛋白正向调节 GS 的活性并具有抑制激活的GP的功能。为了确保磷酸化/去磷酸化反应的特异性,GS和GP都可以结合到能够被磷酸酶和激酶识别的糖原靶向蛋白上。这些糖原靶向蛋白具有不同的组织分布和对GP、GS和PP1的不同亲和力。例如,本文研究的由Ppp1R3c基因编码的PTG在脂肪细胞等对胰岛素敏感的细胞中表达。与肝脏或肌肉细胞相比,脂肪细胞中糖原水平维持在较低水平,并表现出独特的调控。例如,之前在大鼠肝脏中的研究结果显示,禁食24小时后大鼠肝脏葡萄糖-6-磷酸水平下降了5-6倍,而当给糖尿病大鼠注射胰岛素时,肝糖原沉积显著增加。而脂肪中的糖原含量在48小时的禁食后受到了显著的抑制,而在恢复饮食后则显著的急性上调。对棕色脂肪组织中糖原的研究指出,在禁食后的再喂养(re-fed)期间,BAT糖原在脂质补充之前发生过度积累,并在脂质恢复后糖原水平恢复到基线水平,该过程受到肾上腺素能激素的严格控制。此外,有研究指出,脂肪细胞和巨噬细胞表现出葡萄糖倾向性糖原合成。iWAT细胞中糖原的大量积累可以通过mTORC1抑制引起自噬,释放瘦素,吸引M0期的巨噬细胞激活转向M1期,分泌促炎性细胞因子引起炎症。这也反过来又直接影响脂肪细胞的分泌功能,造成胰岛素抵抗。以上结果提示脂肪中的糖原水平变化存在与能量状态相关的急性调节作用。
但是,直到现在脂肪中糖原能够起到什么样的作用仍然是个谜。近期发表在Nature杂志上的一篇题为“Glycogen metabolism links glucosehomeostasis to thermogenesis in adipocytes”的文章以新颖的角度解答了这个谜题,详细介绍了脂肪细胞中糖原代谢和产热之间的关系。
本研究发现,糖原在调节iWAT(Inguinal white adipose tissue,腹股沟白色脂肪,富含米色脂肪细胞)棕色化中起到了关键作用。糖原的积累和降解,可以调节脂肪细胞的能量消耗和热量产生。通过激活交感神经刺激脂肪细胞产热,导致脂肪细胞中糖原的动态积累和转换。这一发现将糖代谢与脂肪产热联系起来,有利于促进代谢健康的改善,或许会是未来治疗肥胖和其他代谢性疾病的新思路。
敲黑板啦!
1、糖原在米色脂肪中富集,其代谢可以调控UCP1的表达。
2、β-肾上腺素上调脂肪细胞中糖原的合成和转换,用以调节产热。
3、脂肪细胞细胞质是糖原动态调节ROS产生及诱导p38激活的场所。
4、PTG-KO小鼠在长期冷暴露后,O2消耗、CO2产量和体温均降低。
研究结果
1、糖原在米色脂肪细胞中被诱导
有研究指出,脂肪组织中糖原水平在禁食、进食和昼夜循环时会发生相应的变化,这表明它可能受到β-肾上腺素能信号的调节。作者检测了选择性β3肾上腺素能激动剂CL-316,243处理的小鼠iWAT中糖原代谢基因的表达。结果发现,CL-316,243处理小鼠iWAT 7天后,Ucp1和Dio2的表达显著增加(图S1a),这表明iWAT发生了棕色化,米色脂肪细胞积累;同时,糖原代谢基因如分别编码mGS (Muscle glycogen synthase,肌糖原合成酶)和PTG的Gys1和Ppp1r3c的表达也升高了。出乎意料的是,编码hGS(Liver glycogen synthase,肝糖原合成酶)和磷酸化酶的Gys2和Pygl的表达也显著增加 (图S1b)(小编注:肝糖原合成酶hGS主要在肝脏中表达,在其他组织表达程度低。且其他组织主要通过肌糖原合成酶表达。作者认为肝脏亚型的表达可能仅限于米色和棕色脂肪细胞。作者推测这种特异性上调可能与米色和棕色脂肪细胞的葡萄糖摄取增强、糖原抑制降低与产热有关。)。此外,作者发现forskolin(腺苷酸环化酶激活剂)上调了人源脂肪细胞中Gys1、Pygl和Ppp1r3c的表达水平(图S2a)。与WAT相比,BAT中Ucp1、Dio2和促进糖原代谢基因的基础表达水平更高,因此Cl-316,243处理的效果并不显著(图S2b)。
拓展阅读
糖原代谢酶
在糖原合成的过程中,GS (Glycogen synthase, 糖原合成酶)作为调控合成的关键酶起到了重要的作用。在哺乳动物体内,GS由Gys1和Gys2这两个基因编码,Gys1主要在肌肉和其他组织中表达 (MGS, Muscle glycogensynthase, 肌糖原合酶),而Gys2则主要在肝脏中特异性表达(H/LGS, Hepatic/Liver glycogen synthetase, 肝糖原合酶)。这两种同工酶之间具有70%的序列相似度,但它们的亚细胞定位却有很大的差别。当细胞内葡萄糖缺乏时,H/LGS主要集中在细胞质中而MGS定位于细胞核。当葡萄糖供应充足后,H/LGS受到响应移动到糖含量高的细胞膜附近,MGS则从核中易位进入细胞质催化糖原合成。
在糖原分解的过程中,GP (Glycogen phosphorylase, 糖原磷酸化酶)和GDE (Glycogen debranching enzyme, 糖原脱支酶)是主要的关键酶。GP在骨骼肌、肝脏和脑的同工酶分别称为GPM、GPL和GPB,编码基因分别是Pygm、Pygl和Pygb。其中,Pygl所编码的肝糖原磷酸化酶主要负责满足全身对血糖的需求,而其余两者则仅在组织内特异性表达以满足需要。当糖原分解开始时,GP催化糖原的磷酸化作用,使糖原分子从非还原端逐个断开α-1,4糖苷键移去葡萄糖基,释放1-磷酸葡萄糖,直至临近糖原分子α-1,6-糖苷键分支点前4个葡萄糖基处。之后由GPB继续断开α-1,4-糖苷键,将该分支剩余的前3个葡萄糖基移至另一个另一分支末端,将其以α-1,4-糖苷键连接。然后糖原脱支酶使残留的α-1,6-糖苷键连接的葡萄糖水解,从而消除该分支,释放一分子葡萄糖。
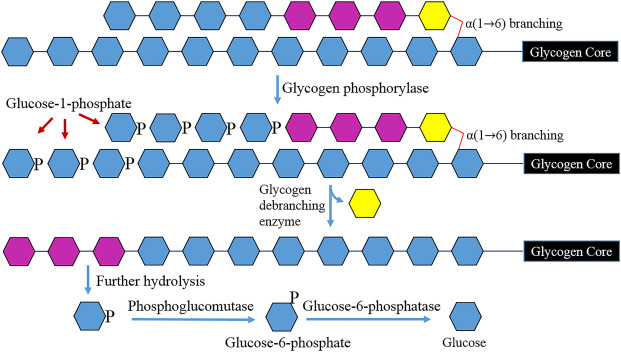

参考文献:
[1] Ferrer JC et al. FEBS Lett. 1997Oct 6;415(3):249-52.
[2] Villarroel-Espíndola F et al. JCell Biochem. 2013 Jul;114(7):1653-64.
拓展阅读
β-肾上腺素能与糖原
肾上腺素能受体是一类介导儿茶酚胺调控作用的受体,根据其对去甲肾上腺素的不同反应情况,分为肾上腺素能α受体和β受体。
在糖原的合成与分解代谢中,β-肾上腺素能受体起到了重要的调控作用。研究表明,当肾上腺素激活β-肾上腺素能受体后,腺苷酸环化酶被激活,cAMP水平上调,引起糖原合成水平降低,促进糖原分解过程。但另一方面,也有研究表明,β-肾上腺素能激活可能会通过激活PI3K下游通路导致心肌细胞和脂肪细胞中GSK3(Glycogen synthase kinase 3,糖原合成酶激酶-3 )的磷酸化,从而调控体内GS的磷酸化水平,上调糖异生途径,增加体内糖原积累。
参考文献:
[1] Carmean CM et al. PLoS One. 2013Jul 4;8(7):e67807.
[2] Yamamoto DL et al. Diabetologia.2007 Jan;50(1):158-67.
在WAT中,依赖CL-316,243的糖原代谢基因的mRNA水平升高,同时mGS、hGS、hGP的蛋白水平也升高(图S1c、S2c)。虽然在BAT中没有检测到这些蛋白表达的差异,但hGS显示出较高的基础表达水平,这与产热功能的上升有关(小编注:有研究报道指出,BAT在敲除TG合成酶DGAT1和DGAT2从而降低脂肪酸储存的情况下,可以利用循环葡萄糖和脂肪酸以及储存的糖原来促进产热,因此认为糖原合成酶可以提高糖原含量,显示出与产热的相关性)(图S2d)。使用CL-316,243处理的小鼠脂肪细胞中的糖原水平大约增加了3倍(图S1d)。UCP1主要在糖原水平最高的多房脂肪细胞中表达(图S1e)。电镜分析显示,在使用CL-316,243处理的小鼠脂肪细胞中,在线粒体旁(juxtaposed to mitochondria)的糖原颗粒更多(图S1f)。从iWAT中分离的成熟脂肪细胞分析也证实,上述基因表达变化具有脂肪细胞特异性(图S1g)。
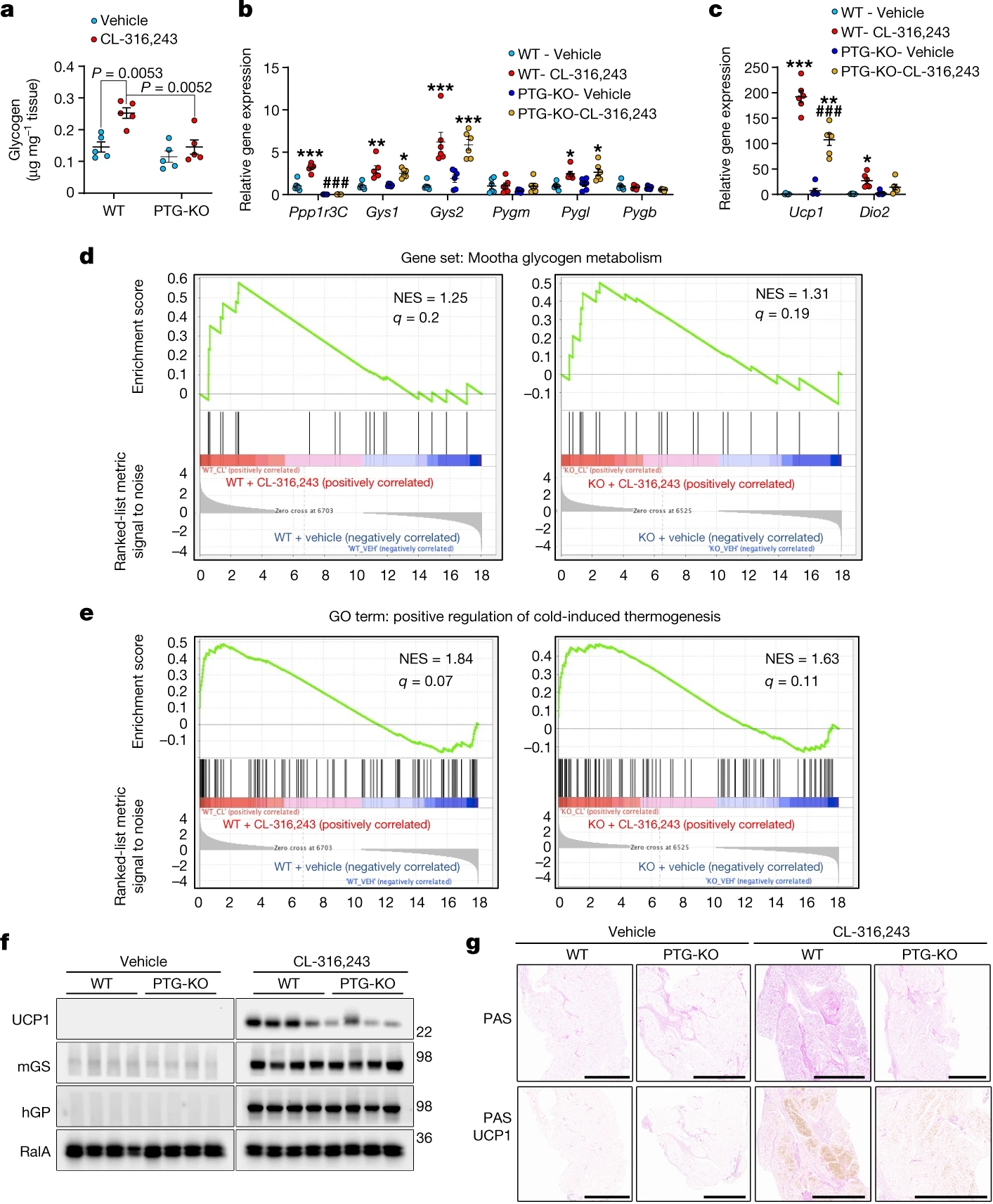
图1.PTG-KO降低了米色脂肪细胞中UCP1的表达
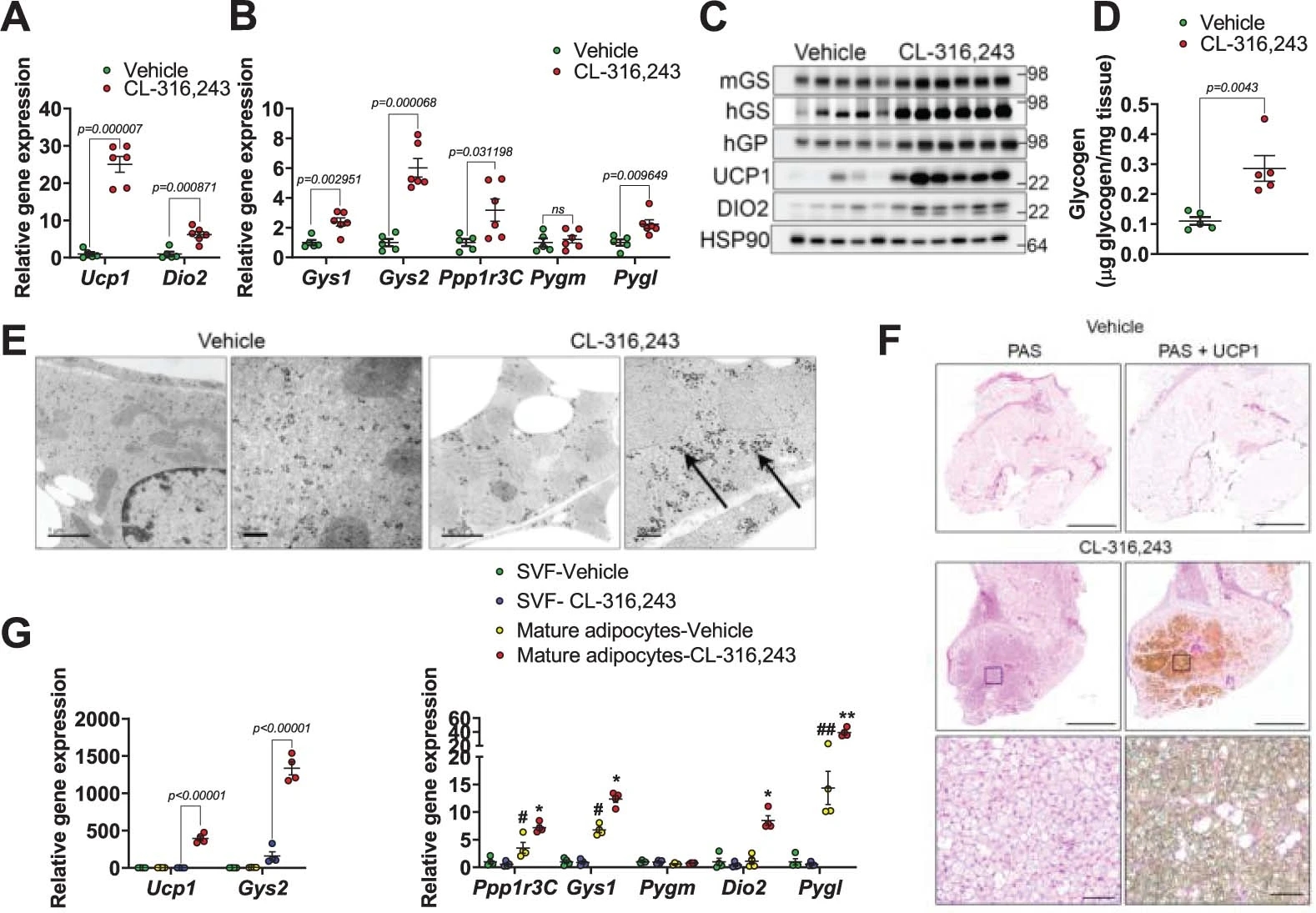
图S1.糖原代谢在米色脂肪细胞中增强
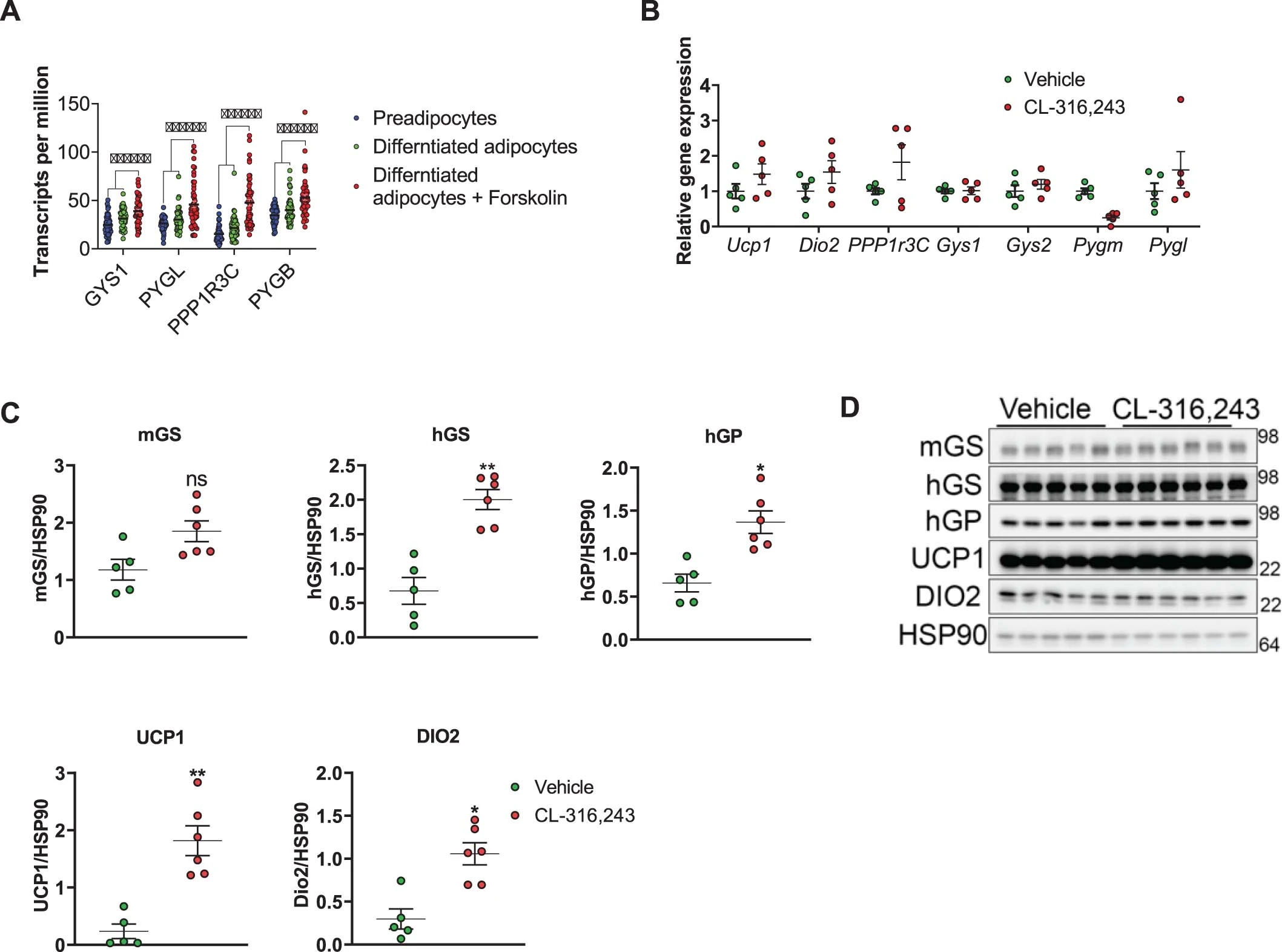
图S2.CL-316,243 处理不影响 BAT 中糖原代谢基因的表达
2、糖原影响UCP1的表达
米色脂肪细胞中糖原基因表达增加和糖原积累表明其与产热相关。靶向敲除Ppp1r3c的PTG-KO小鼠在CL-316,243处理后糖原积累减少(图1a),随后Ucp1和Dio2的表达增加程度降低(图1c)。对RNA-seq结果的差异表达分析也证实了这一现象(图S3c)。除编码Agl(Glycogen debranching enzyme,糖原去分支酶)的基因外,糖原代谢基因在不同基因型间表达无显著差异 (图S3c)。
在经CL-316,243处理的WT和PTG-KO小鼠的分离的脂肪细胞中,GSEA(Gene set enrichment analysis,基因集富集分析)显示PPAR (Peroxisome proliferator-activatedreceptor,过氧化物酶体增殖物激活受体)信号通路和线粒体生物发生途径的基因表达均增加 (图S3d, S3e(小编注:原文数据S3 D-E图片未显示)),这表明这些途径不受糖原水平的影响。相比之下,GO分析显示,冷刺激诱导产热的“正调控”通路,在WT脂肪细胞中富集,而在PTG-KO小鼠中没有被富集,表明糖原是产热基因表达的关键调控因子(图1d)。此外,经CL-316,243处理后,WT和PTG-KO小鼠的脂肪细胞中糖原代谢途径相关基因均有所富集 (图1e)。
在PTG-KO小鼠的iWAT中UCP1蛋白表达降低(图1f,S2f)。iWAT组织学结果显示,CL-316,243诱导的糖原水平和UCP1表达均显著降低(图1g)。UCP1表达降低与对CL-316,243的敏感性下降无关,因为激素刺激和基础脂解在不同基因型小鼠之间的情况相似(图S3g)。
为了排除全身敲除的影响,作者构建了PTG脂肪组织特异性敲除小鼠(PTG-AKO小鼠)。在PTG-AKO小鼠的iWAT中,CL-316,243诱导的UCP1表达显著降低,这证实了脂肪细胞糖原代谢对UCP1表达的直接影响(图2a,图S3a)。在CL-316,243处理的前3天,不同基因型小鼠之间的耗氧量相似(图2b)。但随后的几天里,Cl-316,243处理的WT鼠的耗氧量增加,而PTG-AKO小鼠则没有(图2c)。CO2产生量也有类似的趋势(图S4b, c)。PTG-AKO小鼠与WT小鼠在高脂饮食诱导下的体重并没有差异(图2d)。此外,与对照组相比,CL-316,243处理PTG-AKO小鼠导致UCP1诱导降低(图2e,S3d-e)。不仅如此,在PTG-AKO小鼠中,由于能量消耗降低,CL-316,243导致的体重减轻明显更少(图2f,S3f-g)。
总的来说,这些数据表明糖原代谢是正常和肥胖小鼠适应性产热所必需的。为了确定与人类的相关性,作者对来自非肥胖(n = 26)和肥胖(n = 30)女性皮下脂肪活检的微阵列数据进行了线性回归分析。Gys2、Pygm、Agl的表达水平与BMI(体重指数)呈负相关。不仅如此,Gys2、Pygm、Ppp1r3d的表达水平与log10 HOMA-IR(胰岛素抵抗稳态模型评估)也呈负相关(图2h)。第二组包含770名男性的队列验证了这些结果。其中,Gys2、Pygm与BMI 、HOMA-IR 和腰臀比呈负相关(图S4h)。总之,在以性别划分的两组独立的人类受试者中,脂肪组织中糖原代谢基因的高表达与较低的体重和较高的胰岛素敏感性相关。
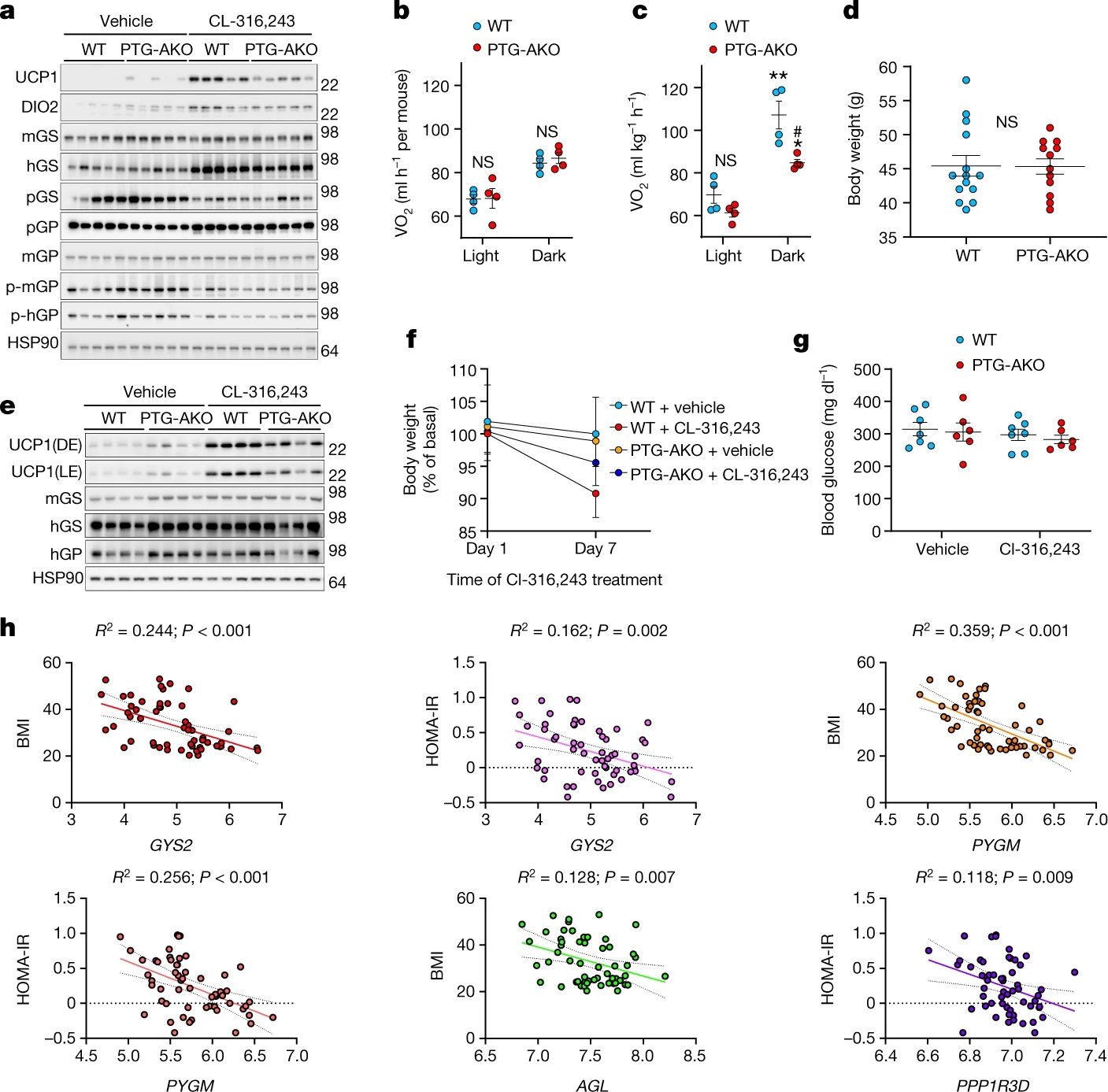
图2.脂肪特异性 PTG 敲除减少了 UCP1 表达和能量消耗
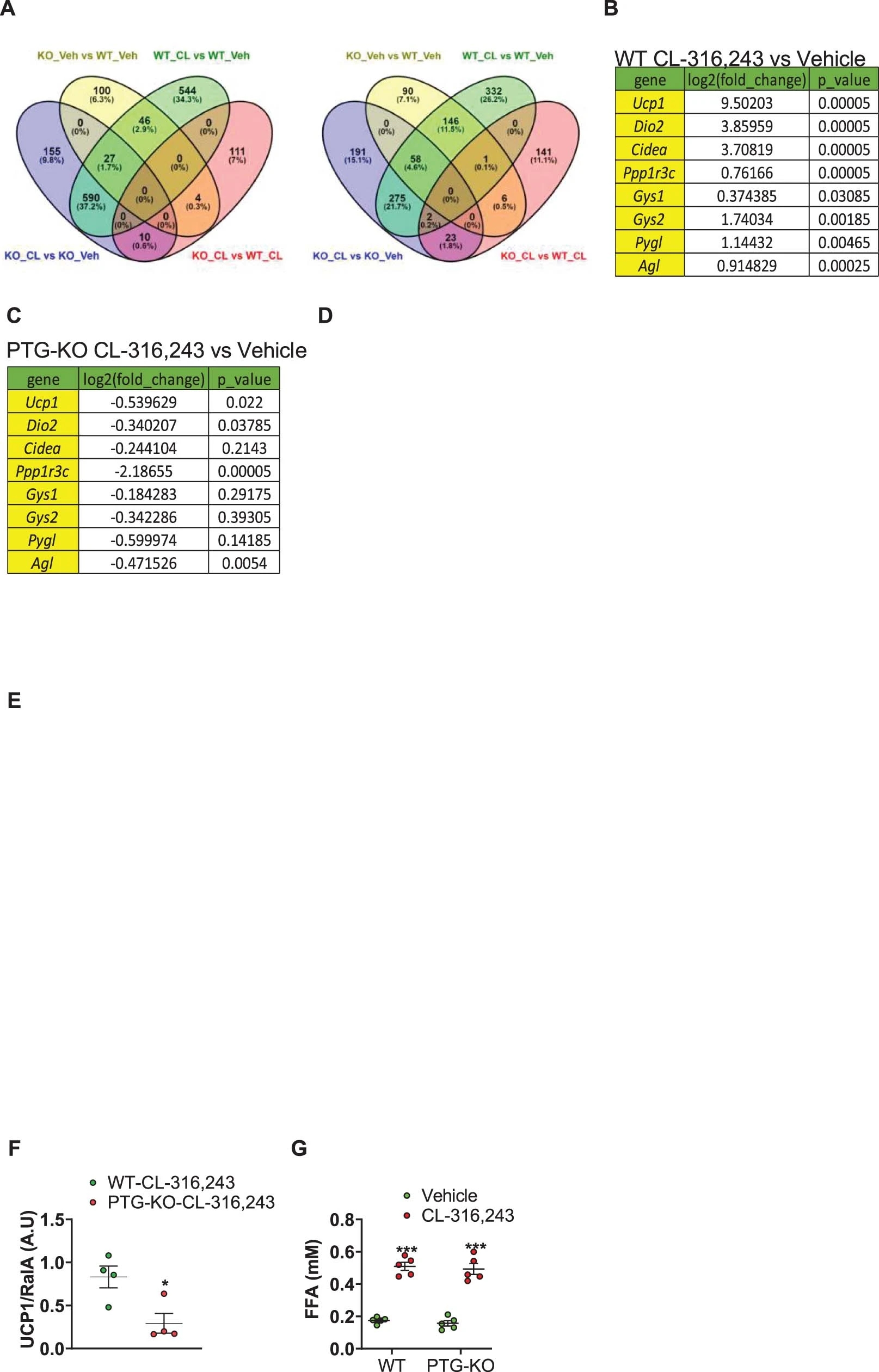
图S3.PTG-KO 不影响对 CL-316,243 的响应
(小编注:S3 D-E图片目前在官网处于图片缺失状态,对应网址为https://www.nature.com/articles/s41586-021-04019-8/figures/7)
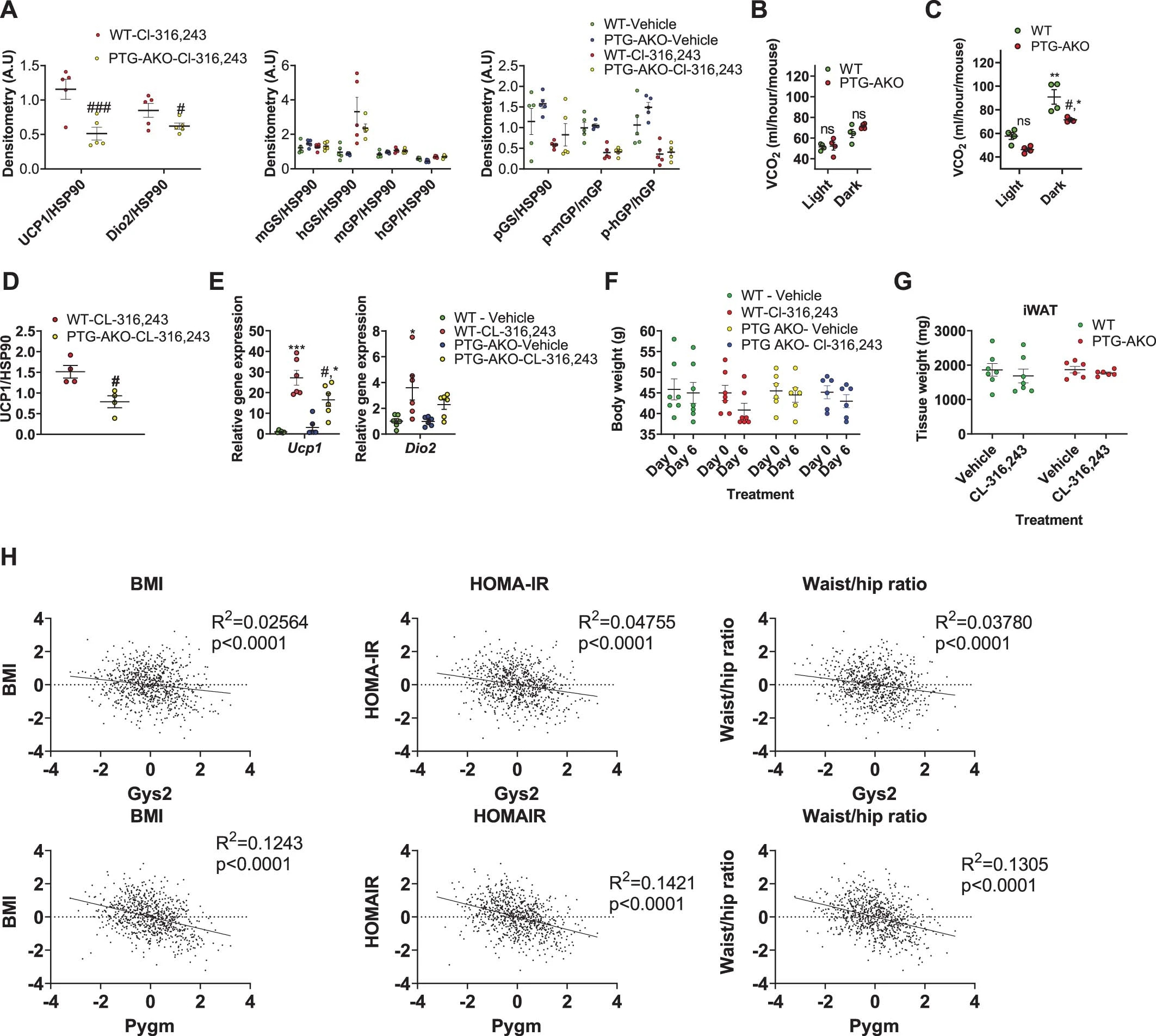
图S4.脂肪特异性敲除 PTG 降低了能量消耗
3、糖原影响p38 MAPK激活
为了进一步探究糖原响应β3-肾上腺素能激活的动力学机制,作者使用CL-316,243处理体外分化的iWAT原代前体脂肪细胞,结果发现来源WT小鼠的前体脂肪细胞中糖原大量积累,而PTG-KO小鼠则没有(图3a)。此外,在PTG-KO脂肪细胞中,糖原分解的终产物G1P(Glucose-1-phosphate,葡萄糖-1-磷酸)的水平也大幅降低(图3b),而胰高血糖素处理PTG-KO小鼠的肝原代细胞则可降低其中的糖原水平,表明肝细胞的糖原分解不受影响(图S5a),说明这两种细胞类型之间的反应存在差异。CL-316,243刺激PTG-KO分化的脂肪细胞显示Ucp1和Dio2的表达减少(图3c)。此外,在共表达PTG的细胞中,Ucp1启动子调控的GFP表达显著增加(图S5b, c),表明儿茶酚胺增加了脂肪细胞中糖原的合成和转换,进而调节产热。
抑制PKA或p38可以减弱CL-316,243诱导的WT脂肪细胞(图3d)和PTG-KO脂肪细胞中Ucp1的表达。值得注意的是,CL-316,243处理后,PTG-KO脂肪细胞中CL-316,243依赖的p38磷酸化激活水平被下调,而依赖于PKA的HSL(Hormone sensitive lipase,激素敏感性脂肪酶)磷酸化则未受影响(图3e,图S5f)。与PTG-KO脂肪细胞类似,使用变构霉素(小编注:变构霉素是一种蛋白磷酸酶特异性抑制剂,对PP1和PP2A均有效,其中对PP1的抑制效果强于PP2A,因此被广泛用于抑制PP1。)抑制PP1可降低儿茶酚胺刺激下p38的磷酸化水平(图S5d, e),这些结果表明糖原可以动态调节p38的激活以及随后的UCP1的诱导。
由于GS和GP的表达都是在CL-316,243刺激诱导的,作者推测糖原转换可以调节UCP1的表达。因此,作者使用GPI(GP inhibitor,GP抑制剂)阻断糖原分解,发现GPI增强了β3-肾上腺素能激活后糖原的积累(图3f),但降低了p38的激活(图3g,图S5g),并随后降低了Ucp1和Dio2的表达(图3h)。这表明糖原的转换是脂肪细胞中p38激活所必需的。
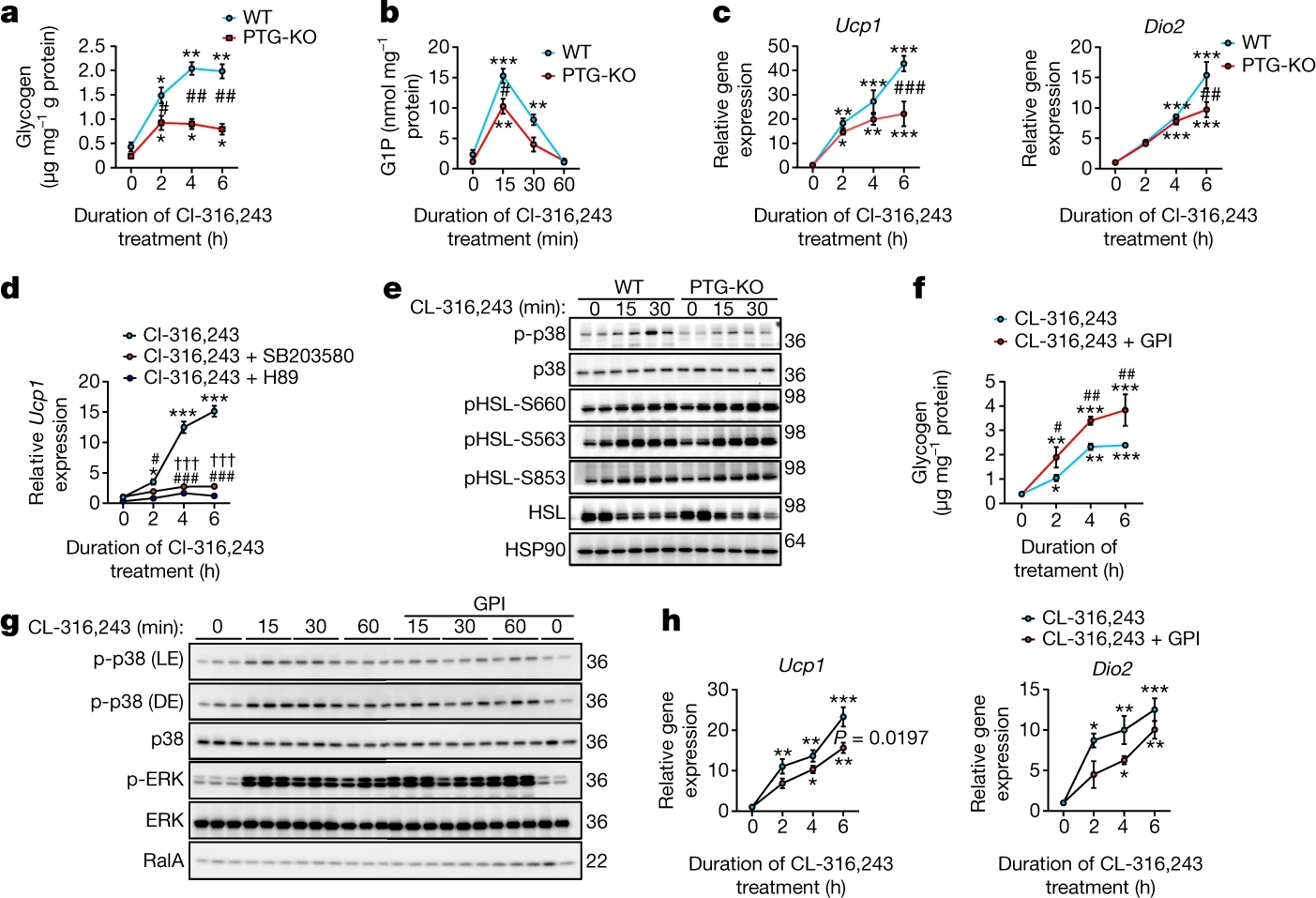
图3.糖原代谢的下调抑制了 p38 的激活
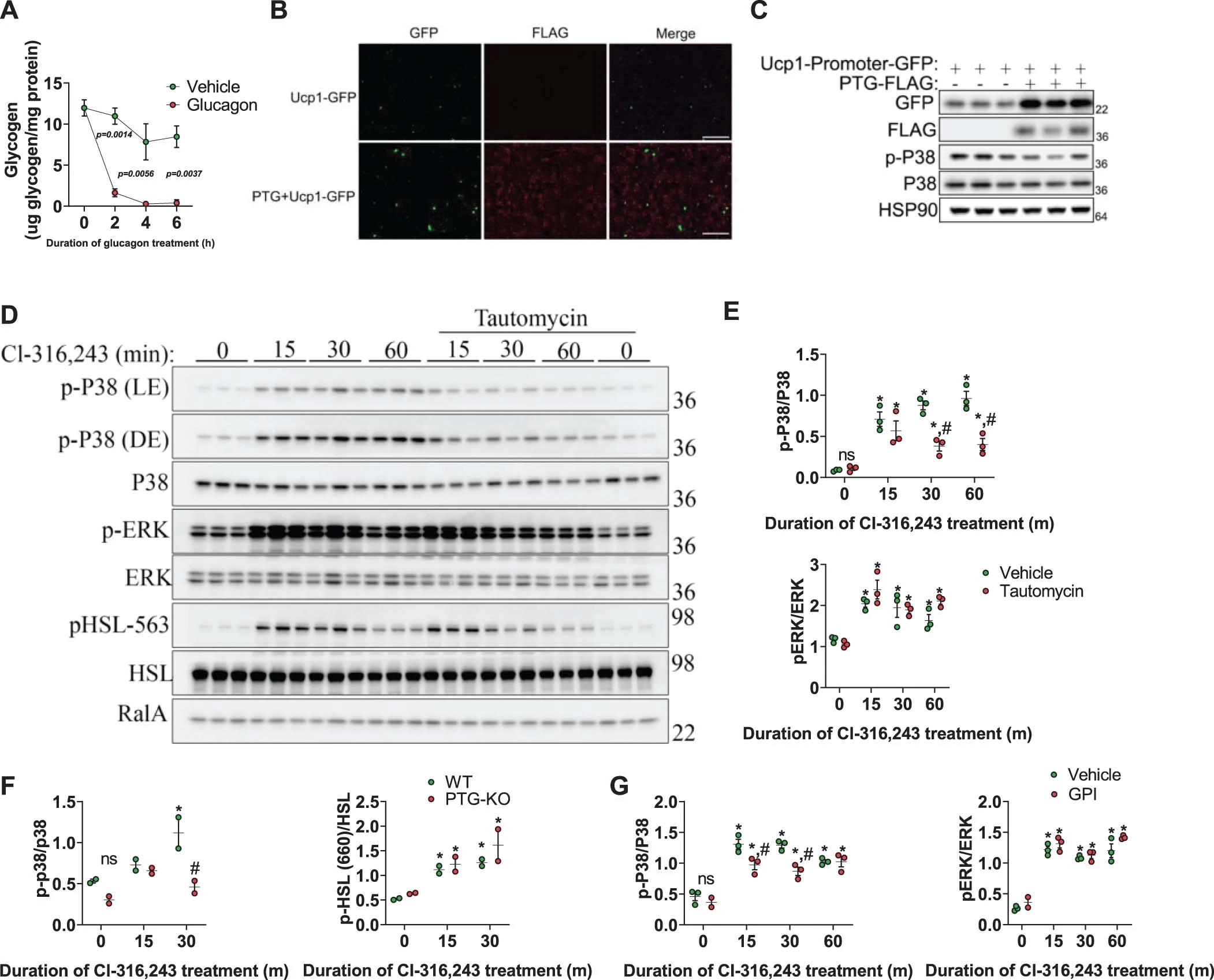
图S5.PTG 的过表达上调了体外UCP1 的表达
4、糖原调节ROS依赖的p38激活
由于ROS的产生是激活p38所必需的,因此作者使用CL-316,243刺激分化的脂肪细胞发现,ROS水平显著增加(图4a),抗氧化基因表达也相应增加,添加ROS清除剂NAC(N-Acetyl-L-cysteine,N-乙酰-L-半胱氨酸)后,可以降低这些基因的表达(图4b)。同时,NAC能够显著降低CL-316,243诱导的p38激活以及Ucp1和Dio2的表达(图4c, d,图S6a),这表明p38的激活和随后UCP1表达的增加依赖于ROS的产生。
拓展阅读
糖原、p38与ROS
该研究认为葡萄糖氧化是细胞质中ROS的主要来源,因而推测在糖原分解中衍生的1-磷酸葡萄糖为糖酵解提供了底物。而体内糖酵解会引起NADPH的大量产生,并通过在质膜和内质网上表达的NOX(NADPH oxidase, NADPH氧化酶)将NADPH中的电子转移到氧上,产生大量ROS。产生的ROS又可以调控体内p38的表达。
有研究表明,在生理条件下,p38可以作为ROS信号转导的介质,并根据不同刺激,激活或抑制细胞周期进程。当细胞处于缺氧条件下,细胞内产生大量ROS,从而促进p38的磷酸化。这种磷酸化即使在细胞状态恢复后仍会继续,因为p38的磷酸化激活又会进一步影响ROS的产生,从而陷入恶性循环。在BAT中,磷酸化后的p38可以通过ATF2(Activating transcription factor 2,激活转录因子2),使其转运至细胞核并结合在Ucp1和Pgc1α的启动子上,从而调控Ucp1和Pgc1α表达,影响产热。
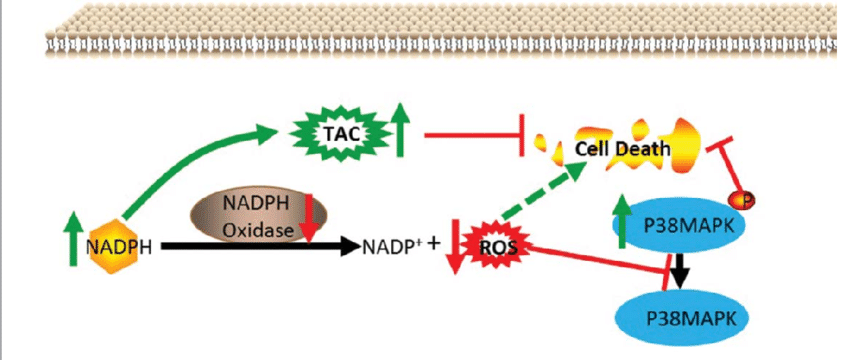
参考文献:
[1]Tormos AM et al. Free Radic Res. 2013 Nov;47(11):905-16.
[2]Fischer K et al. Nat Commun. 2020 May 8;11(1):2306.
[3]Bedard K, Krause KH. Physiol Rev. 2007 Jan;87(1):245-313.
[4] Pei H et al. Cell Cycle. 2017 Jan 2;16(1):113-122.
RNA-seq数据的GSEA显示,“ROS抗氧化反应”通路在CL-316,243处理的WT小鼠的脂肪细胞中高度富集,而在PTG-KO脂肪细胞中则完全缺失(图4e)。PTG敲除显著降低了CL-316,243引起的ROS产生(图4f),且抑制GP也能显著降低ROS,这表明糖原的转换是产生ROS所必需的。对加入CL-316,243或CL-316,243+GPI处理的脂肪细胞的半胱氨酸氧化进行整体分析发现,在加入GPI的β-肾上腺素能刺激后,特定蛋白亚群中不同蛋白的半胱氨酸氧化状态(小编注:由于ROS可以通过影响内环境氧化还原水平,从而影响蛋白质半胱氨酸氧化还原修饰水平。因而作者利用uniprot选定了受半胱氨酸氧化调控的蛋白亚群。通过对半胱氨酸氧化调控的检测可以研究细胞内蛋白的氧化还原情况,该结果表明,当抑制GP后,细胞内蛋白的氧化还原水平发生改变,从而推断出ROS受GP调控的糖原代谢调节)发生了变化(图S6b, c)。使用线粒体ROS探针(CM-H2DCFDA)进一步研究发现,在CL-316,243处理脂肪细胞后,线粒体ROS增加,但与GP无关(图4g)。因此,糖原的合成和分解导致ROS的产生和p38的激活很可能发生在细胞质中。
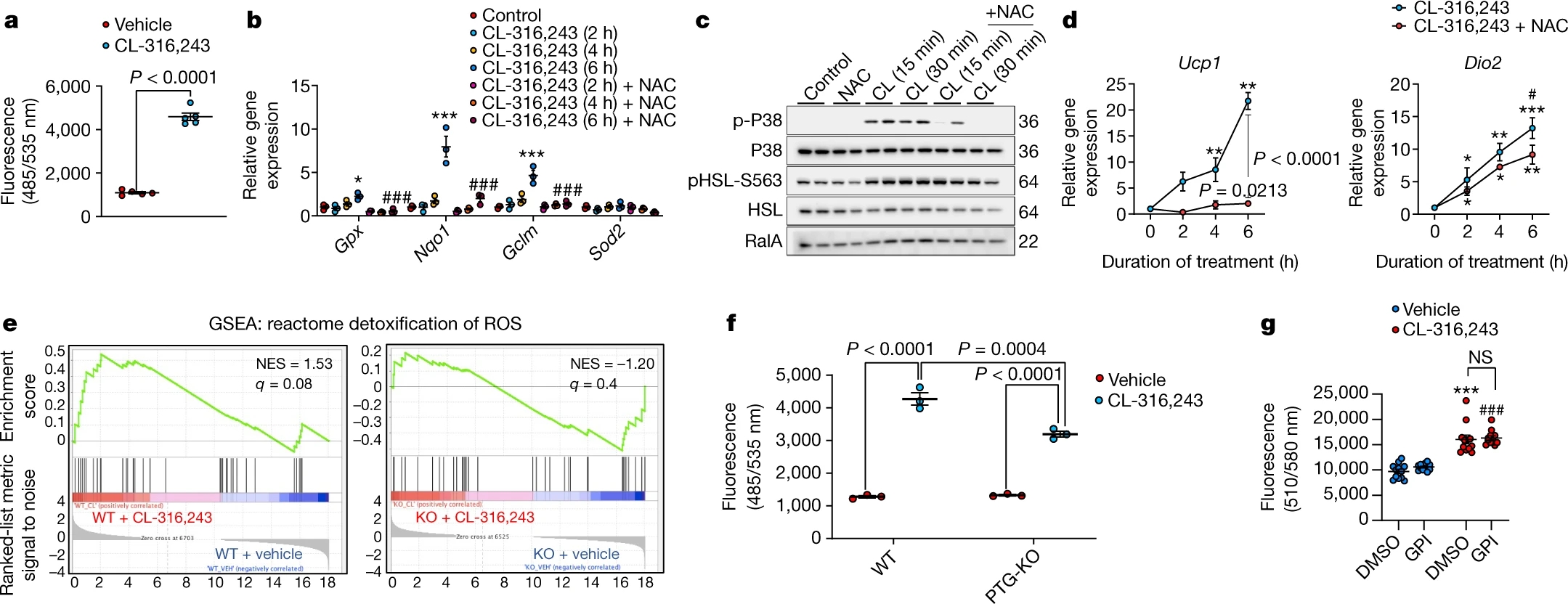
图4. 糖原代谢促进脂肪细胞中 ROS 的产生
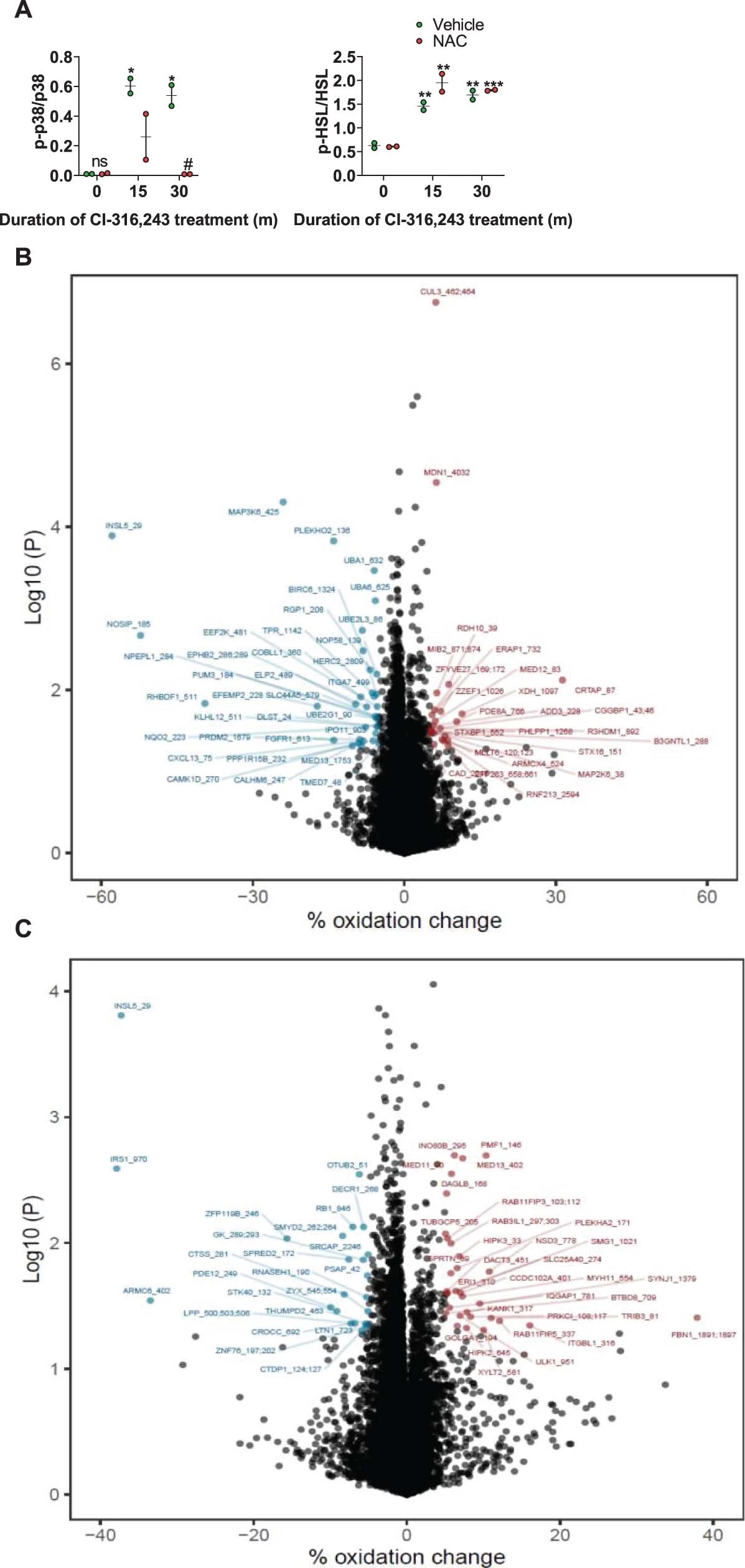
图S6.糖原代谢响应 CL-316,243以影响 ROS 的产生
5、糖原是适应寒冷所必需的
WT和PTG-KO小鼠在急性冷刺激时均能保持核心体温(图S7a)。而将小鼠恢复到室温后,发现与原本室温情况下BAT中糖原水平比较,WT小鼠BAT糖原水平出现了显著升高而PTG-KO小鼠则没有(图S7b)。随后进行第二次冷刺激,发现WT小鼠仍保持了核心体温,而PTG-KO小鼠则不能保持(图S7c),这表明糖原代谢是长期寒冷适应所必需的。在接下来的实验中作者构建了Ucp1-cre依赖的棕色和米色脂肪细胞PTG-KO小鼠(PTG-BKO),并通过18℃ 7天,然后4℃ 14天的长期冷刺激诱导(小编注:冷刺激实验时间周期为22℃3天,18℃7天,然后4℃14天,并非前文实验中急性冷刺激的4℃与室温RT的交替,因此影响小于急性实验。)WT和PTG-BKO小鼠糖原代谢相关基因的表达(图S7d, e)。结果显示,与对照组相比,冷刺激后的PTG-BKO小鼠的iWAT中Ucp1 mRNA表达下调(图S7f)。且UCP1蛋白水平也下降(图S7g, S8a)。
PTG敲除并不影响UCP1在BAT中的表达(图S8b)。在18℃低温适应时,两组间的耗氧量并无差异,然而,在4°C暴露3天后PTG-KO小鼠的耗氧量和CO2产量降低,继续暴露4天后会进一步降低(图S7h,S8c)。为此,作者提出一个模型,即通过脂肪细胞糖原合成和转换产生ROS来激活p38,随后诱导Ucp1和其他产热基因来调节能量消耗(图S7i)。
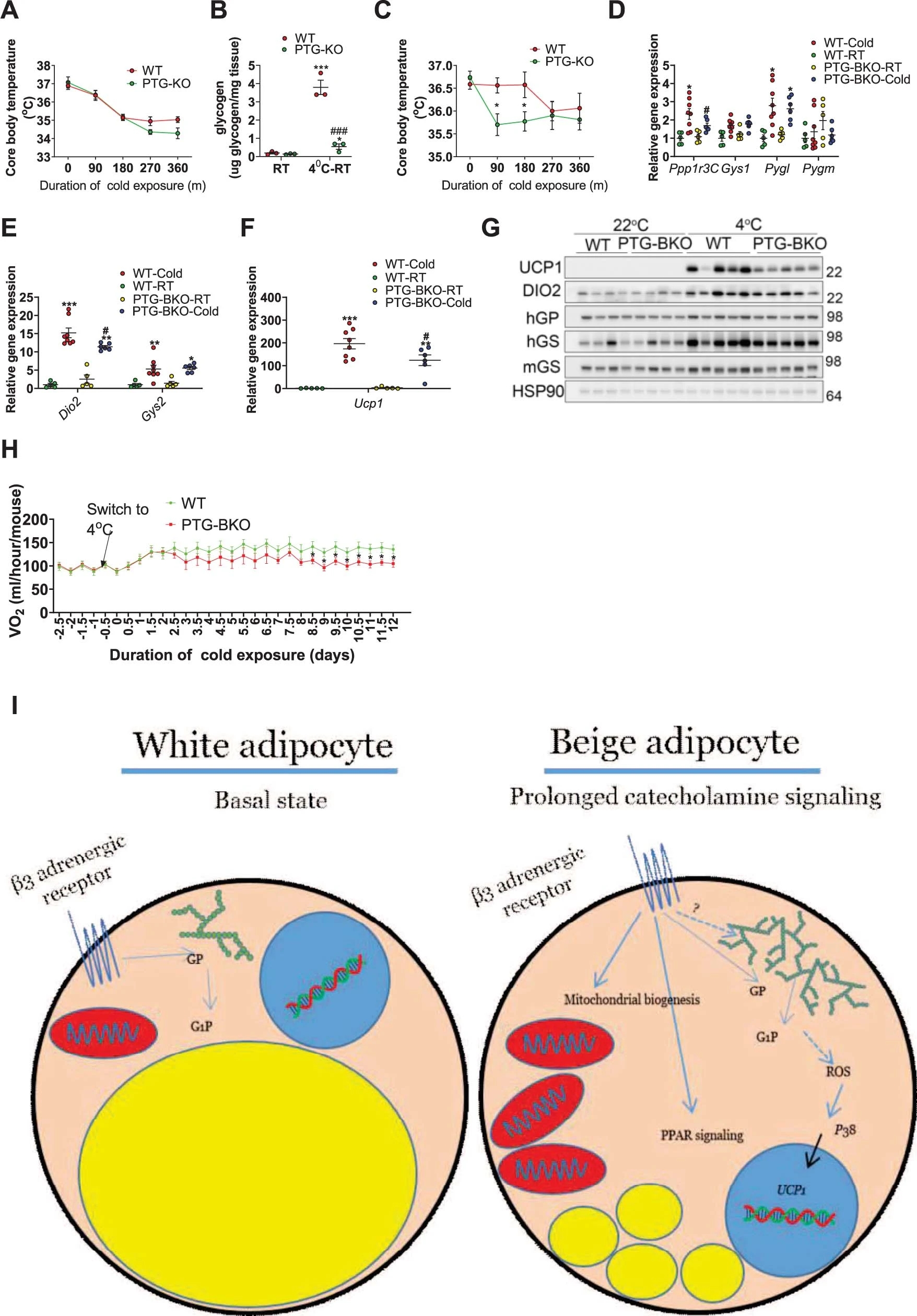
图S7.PTG-KO 降低了长期冷刺激期间的能量消耗
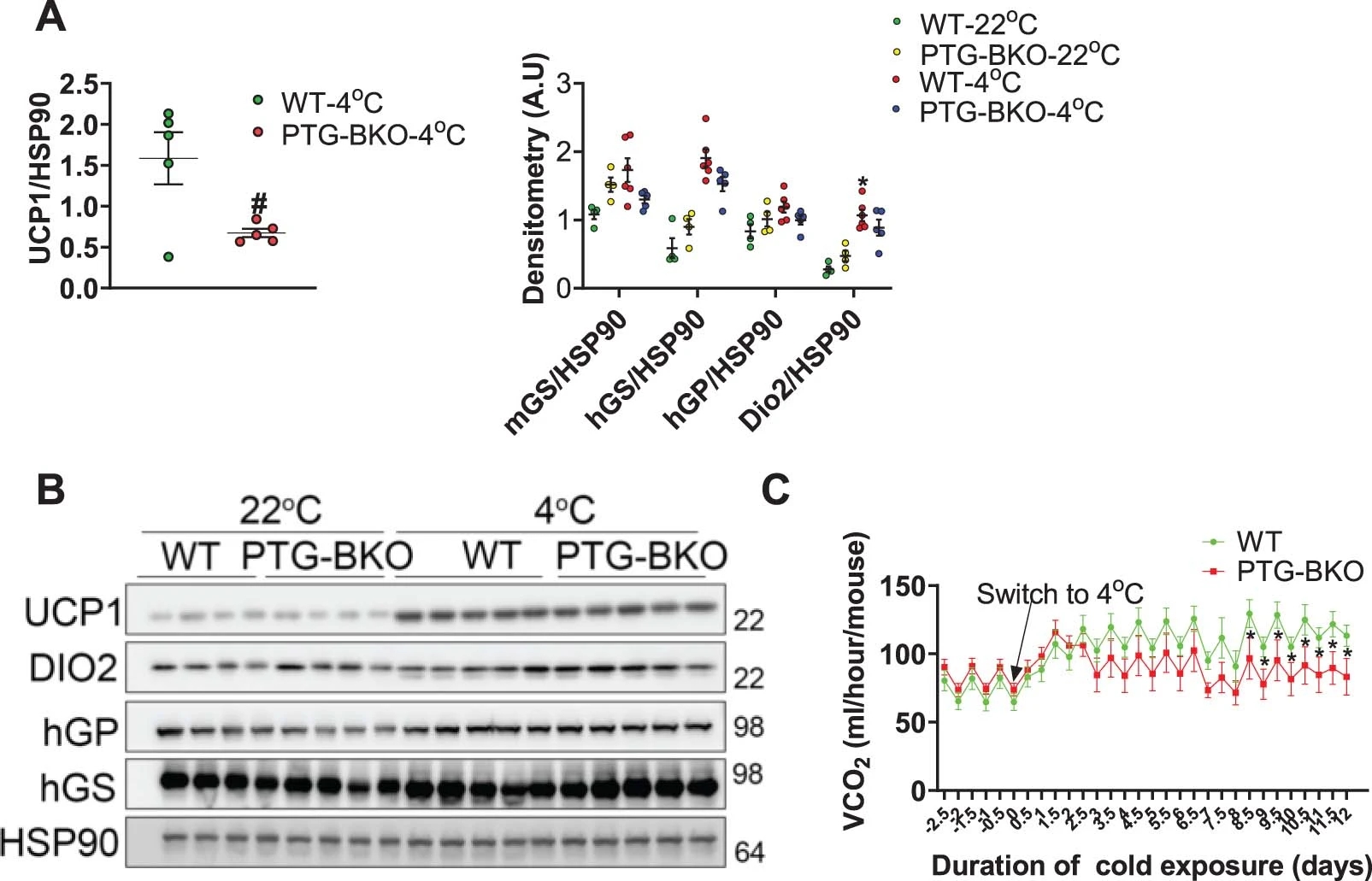
图S8.长期冷暴露后 BAT-Ucp1 的表达增加不需要 PTG
总结
肥胖已然成为一种日益流行的代谢性疾病,其原因是能量摄入大于能量消耗。作为能量调节的关键,适应性产热作用在其中起到重要作用。该研究发现,脂肪组织中的糖原代谢对于应激状态下UCP1的表达和产热至关重要,慢性β-肾上腺素信号的激活会诱导WAT棕色化以及米色脂肪组织中糖原的积累。而糖原稳态的调控还能够促进p38 MAPK发生ROS依赖性激活,进而诱导Ucp1及其他产热相关基因的表达,最终调控寒冷等应激状态下小鼠的能量消耗,并减轻体重。这一发现提示了糖原代谢的调节可能成为燃脂减肥的新方向。
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://wap.sciencenet.cn/blog-3483272-1318987.html
上一篇:代谢学人--Science子刊近期代谢精选
下一篇:代谢学人--Cell Metabolism:小孩子才做选择,除糖和降脂,Isthmin-1全都要