博文
《自然—免疫学》:浙江大学张进团队研发第二代功能增强型CAR-巨噬细胞
||
北京时间2023年11月28日,浙江大学张进团队在Nature Immunology上发表了题为“A second generation M1-polarized CAR macrophage with antitumor efficacy”的研究成果。
该项工作设计了抗原依赖性极化的第二代iPSC来源的CAR-macrophage(CAR-iMAC),阐明了其抗原依赖性极化和激活,以及通过“胞葬”作用杀伤肿瘤的机制, 为CAR-iMAC应用于实体肿瘤的免疫细胞治疗提供了更加坚实的理论基础。

实体肿瘤的有效治一直是困扰医学界的重大难题之一。传统的手术切除、放疗和化疗治疗方式在恶性程度较高的实体肿瘤面前显得力不从心。当前,肿瘤的免疫治疗展现出了良好的前景。以PD-1抗体等为代表的免疫检测点疗法在黑色素瘤等少数“热肿瘤”的治疗中表现出了一定疗效,但在大部分肿瘤的治疗中响应并不积极。于此同时,以CAR-T为代表的免疫细胞疗法虽然对血液肿瘤的治疗效果显著,但囿于实体肿瘤致密的细胞间结构和免疫抑制性的微环境等限制性因素,其对实体肿瘤的治疗效果也显得不尽如人意。
巨噬细胞因其对异常细胞和病原微生物等抗原的免疫清除功能,以及抗原呈递和免疫调节方面的功能在体液免疫和细胞免疫过程中发挥着重要作用。研究发现,巨噬细胞占据实体浸润免疫细胞的40%以上,并对肿瘤微环境的塑造至关重要。基于以上独特优势,巨噬细胞针对实体肿瘤的治疗研究就显得具有很高的价值。然而,目前巨噬细胞应用于实体肿瘤的治疗依然面临着诸多难题,如:肿瘤微环境中的易于被极化为促癌的M2状态;病人自体成熟巨噬细胞的基因编辑效率极低且制备周期长;治疗用细胞数量难以满足临床需求等。此外,如何赋予具有非特异性免疫功能的巨噬细胞靶向性抗肿瘤的能力继而增强其治疗效率,并克服On-Target Off-Tumor效应,也是巨噬细胞抗实体肿瘤研究必须解决的问题。
基于以上问题,张进团队充分利用其拥有的独立知识产权和成熟可靠的iPSC分化巨噬细胞(iMAC)平台,并借助基因工程化手段赋予巨噬细胞靶向M1极化和激活能力着手展开了研究工作。该团队首先基于一系列严格的筛选创造性地将具有极化和激活巨噬细胞功能的Toll 样受体4(TLR4)的胞内TIR信号转导结构域构建到靶向特定抗原的CAR的胞内位置,继而构建了macrophage专属的CAR(TIR-CAR/M-CAR)。紧接着,通过串联TIR和第一代CAR中的CD3ζ信号结构域构建了正交信号的第二代CAR,并得到了第二代CAR-iMAC。实验证实,第二代CAR-iMAC相对于TIR-CAR-iMAC和第一代基于CD3ζ的CAR-iMAC在极大地提升了靶向抗肿瘤功效的同时,也分泌了更高水平的TNF等促进抗肿瘤功效的免疫因子,并展现出了更强的抗原呈递和抵御肿瘤免疫抑制性微环境“裹挟”的能力,继而在抗肿瘤过程中维持了更高水平、更长时间的M1极化。接受第二代CAR-iMAC治疗的8只肝细胞癌小鼠中的6只得到几乎完全的肿瘤消除。负担恶性极强的胶质母细胞瘤(GBM)的小鼠在治疗后的生存期也得到了显著性延长。
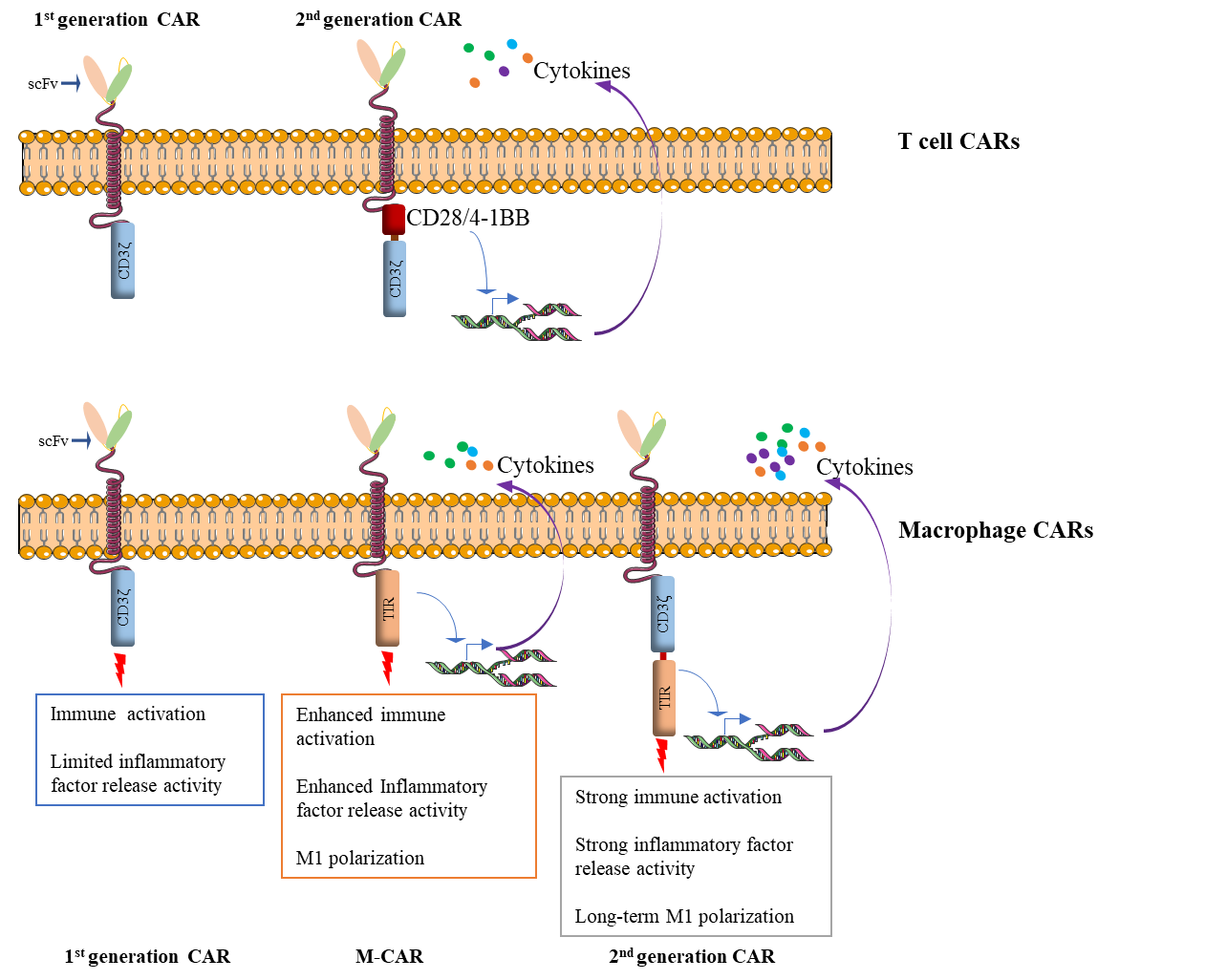
图1. 第一代和第二代的T细胞CAR与巨噬细胞CAR
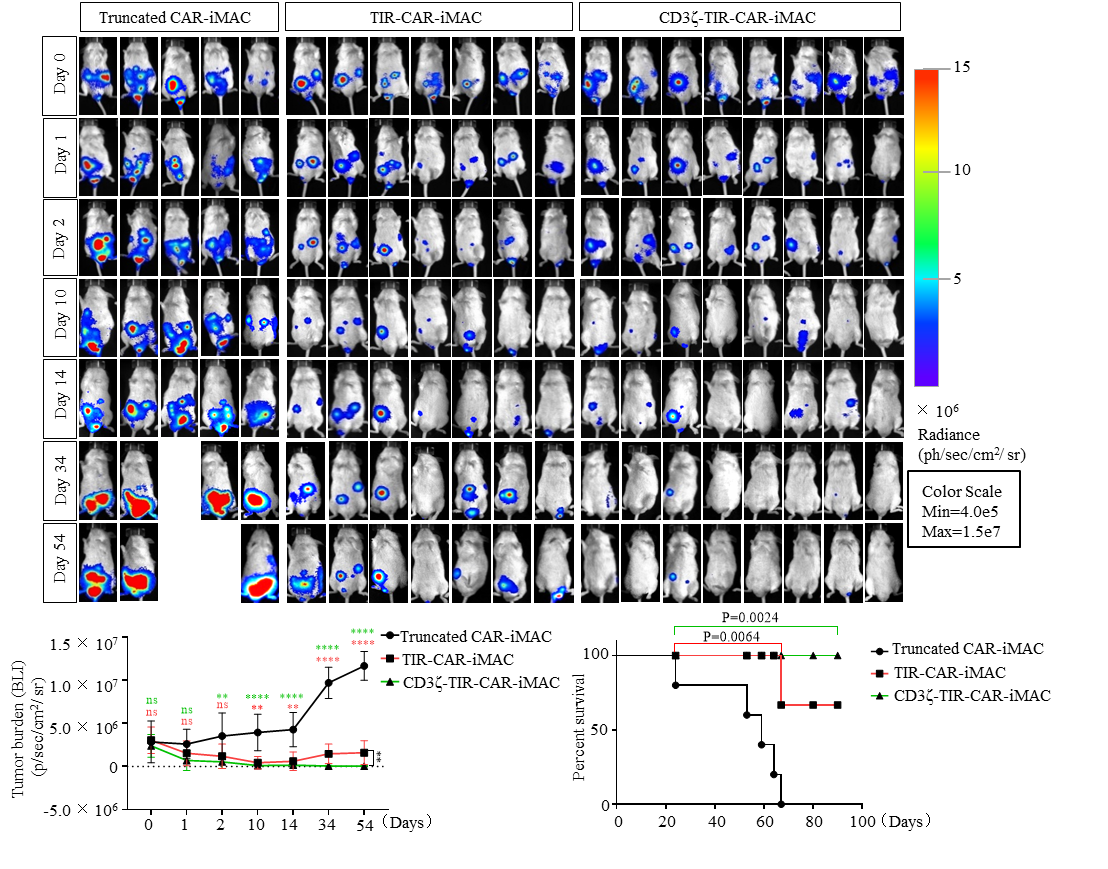
图2. 第二代CAR-iMAC展现出对肝癌的良好治疗效果
在机制上,该团队发现NF-κb/P65的核聚集介导了第二代CAR-iMAC的靶向M1极化和激活。阻止NF-κb/P65的入核显著性地抑制了该免疫细胞的靶向杀伤功能。这一工作也证明了引入TIR而构建的巨噬细胞专属CAR的合理性和可行性。同时,该项工作揭示了第二代CAR-iMAC对抗实体肿瘤的作用机制(mechanism of action or MOA),即通过诱导肿瘤细胞凋亡,而后清除凋亡小体的“胞葬(efferocytosis)”途径。
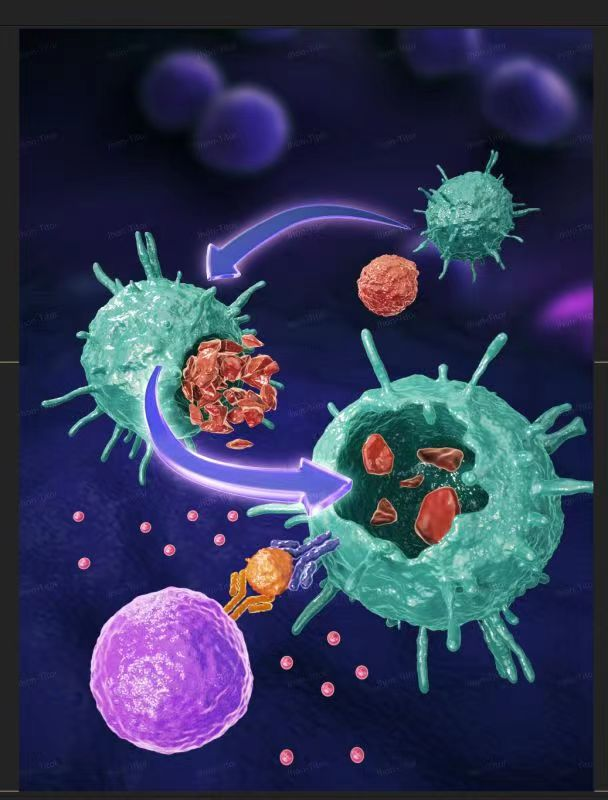
图3. 第二代CAR-iMAC通过“胞葬”和抗原呈递激活T细胞等多种手段发挥抗肿瘤功效
综上所述,张进团队设计了巨细胞专属的CAR和迭代升级的第二代CAR,并得到了iPSC来源的功能增强型第二代CAR-iMAC;阐明了第二代CAR-iMAC抗原依赖性极化和激活,以及通过“胞葬”作用杀伤肿瘤的机制。该研究中iPSC分化CAR-iMAC的策略不仅为后续的临床治疗提供了数量和来源可靠的治疗用细胞,第二代CAR-iMAC所展现出来的理想抗实体肿瘤功效也助推了CAR-巨噬细胞走向临床的进程。
该项工作的第一作者是浙江大学的雷安华,余华(现任南昌大学PI)是文章的共同第一作者。浙江大学的张进是该研究的通讯作者。研究受到了浙江大学陈家明教授、高志华教授、刘冲教授、刘志红院士、黄河教授,上海交通大学杨选明教授,哈佛大学George Church以及加州大学圣地亚哥分校Dan Kaufman与Huang Zhu的大力支持。
研究受到了国家自然科学基金委、浙江省自然科学基金委、中国博士后科学基金会的支持。
相关论文信息:
https://doi.org/10.1038/s41590-023-01687-8
https://wap.sciencenet.cn/blog-3423233-1411651.html
上一篇:《自然—细胞生物学》:北京生命科学研究所/清华大学沈博团队揭示骨髓移植后神经促进造血干细胞和血管再生的机制
下一篇:《自然—化学生物学》:钟超/周佳海/谭验合作报道新型活材料设计的“IT+BT”新范式