博文
《分子细胞》:生万强/施扬合作揭示MAVS棕榈酰化修饰响应表观干预增强抗肿瘤免疫
||
北京时间2023年11月28日,浙江大学医学院/良渚实验室生万强研究员团队与英国牛津大学Ludwig癌症研究所施扬教授团队合作,在Molecular Cell杂志上发表了题为“CPT1A induction following epigenetic perturbation promotes MAVS palmitoylation and activation to potentiate antitumor immunity”的研究论文。
该研究从比较表观干预和病毒感染在引起I型干扰素应答的异同入手,细致地揭示了线粒体蛋白CPT1A响应不同刺激信号调控MAVS蛋白S-棕榈酰化修饰的分子机制和产生的重要作用。

表观遗传调控异常促进肿瘤恶性转化和逃避免疫监视。肿瘤细胞中,编码非我抗原或免疫刺激分子的基因常常被表观遗传学机制所沉默,造成“免疫忽视”。广泛分布于细胞基因组中的逆转座子(REs)可以通过内源性双链RNA (dsRNA)的形式产生免疫刺激分子。近年来,包括DNMTs和LSD1在内的多个表观遗传因子被发现可以调控肿瘤细胞中逆转座子来源的dsRNAs的丰度和结构完整性,进而影响肿瘤免疫应答和免疫治疗效果。鉴于这些发现,表观疗法联合免疫疗法的治疗手段目前被应用于临床测试。值得注意的是,靶向上述表观遗传因子主要是通过RIG-I/MDA5-MAVS通路激活I型干扰素应答来发挥免疫激活作用,这提示肿瘤内I型干扰素应答的强度和时程可能对于表观联合免疫疗法的疗效至关重要。相对于目前诸多研究聚焦于发掘更多表观遗传因子调控内源性dsRNA分子的产生,我们对于细胞质中内源性dsRNA分子的免疫刺激效应是如何被调控的却缺乏研究。
研究团队发现与病毒感染激活的I型干扰素应答不同,表观干预可以维持MAVS蛋白稳定表达进而持续激活干扰素通路。MAVS是转导dsRNA模式识别受体RIG-I/MDA5 信号通路的中枢,其表达和功能很大程度上受到蛋白翻译后修饰的调控。进一步通过比较和分析病毒感染和表观干预对细胞基因表达的影响,研究团队发现线粒体蛋白CPT1A在病毒感染后会下调,反而在多种表观干预下均会显著上调。进一步研究发现,CPT1A是细胞静息状态下MAVS蛋白稳定表达所必需的。在表观干预激活dsRNA-RIG-I/MDA5通路时,上调的CPT1A通过提高MAVS的K63位泛素化修饰促进蛋白聚集激活,并降低K48位泛素化修饰抑制MAVS蛋白降解,进而产生以I型干扰素通路持续活化为特征的免疫激活效应,发挥了提高肿瘤微环境中CD8+ T细胞浸润和抗肿瘤免疫的作用。因此,CPT1A作为正调节因子,负责在表观干预激发抗肿瘤免疫过程中稳定MAVS的活化。
在生化机制层面,线粒体定位的CPT1A通过蛋白互作的方式招募内质网定位的棕榈酰转移酶ZDHHC4来催化MAVS的79位半胱氨酸S-棕榈酰化修饰,该修饰通过影响K48位和K63位的泛素化修饰水平促进 MAVS 稳定和激活。采用CRISPRa转录激活技术提高CPT1A表达水平会进一步增加MAVS的S-棕榈酰化修饰水平,放大I型干扰素通路应答,可以使表观干预发挥更有效的抗肿瘤免疫作用。此外,CPT1A化学诱导剂,比如临床使用的非诺贝特,可以在动物模型上增强表观药物与PD-1抗体联合治疗肿瘤的效果。
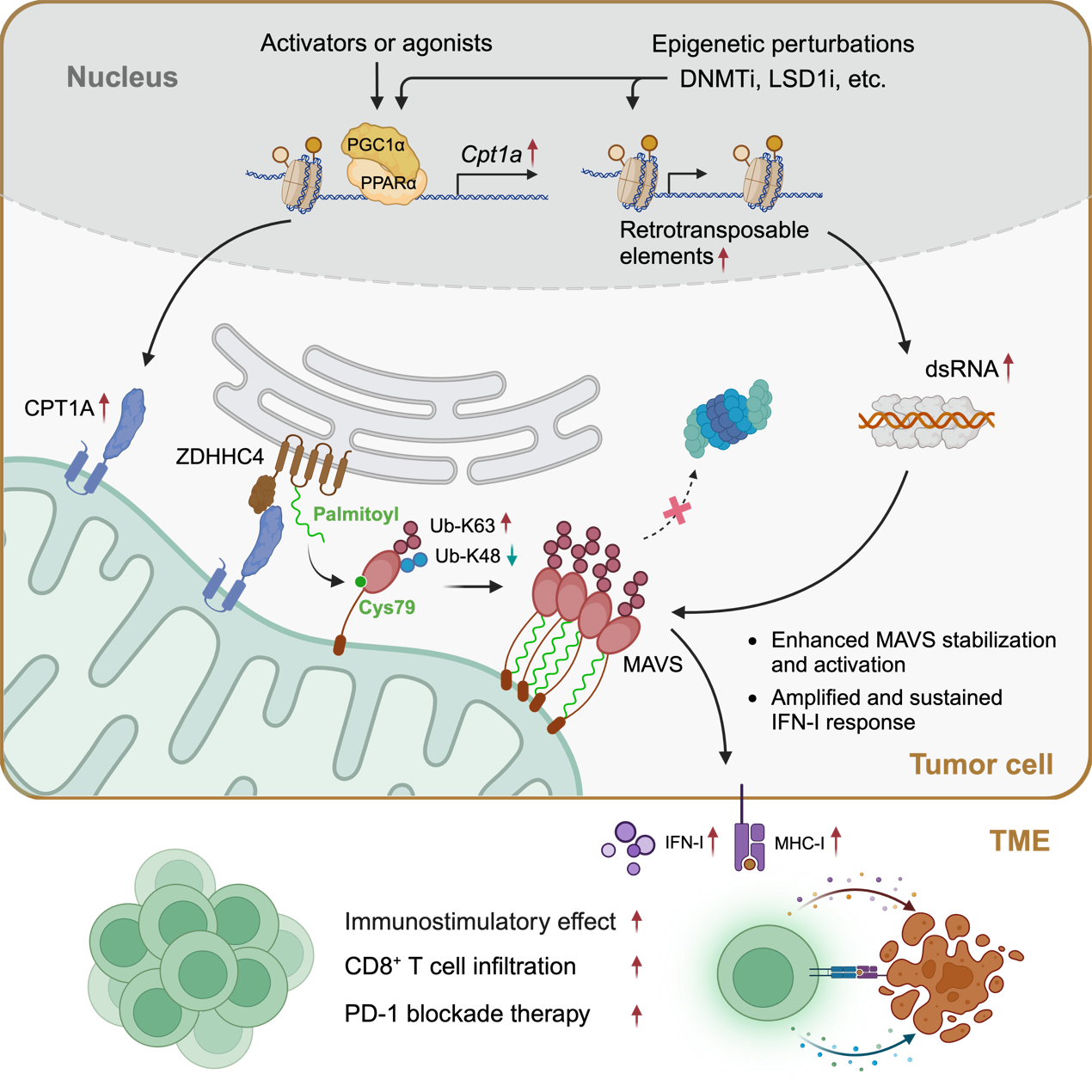
总之,该研究工作揭示了MAVS蛋白一种新的调控机制,其S-棕榈酰化水平显著影响表观疗法的免疫激活效应及与免疫疗法联合用药的抗肿瘤效果。
浙江大学医学院免疫所/医学院附属第一医院/良渚实验室生万强研究员和牛津大学Ludwig癌症研究所施扬教授为该论文的共同通讯作者,浙江大学医学院博士研究生张贵恒为该论文的第一作者。浙江大学医学院附属第四医院Dante Neculai教授,医学院附属第一医院周建娅教授和免疫所王晓健教授对本研究提供有力支持。该研究获科技部重点研发计划和基金委面上项目资助。
生万强实验室近年来在肿瘤表观遗传调控和T细胞免疫方面取得了一系列重要研究成果。实验室目前针对上述研究方向利用CRISPR功能筛选和多组学技术、T细胞基因改造、生物化学和分子生物学、基因编辑等方法结合小鼠肿瘤模型进行深入研究,诚聘相关专业的优秀博士后和科研助理加入研究团队。欢迎有扎实免疫学、肿瘤学、表观遗传学、分子生物学和生物信息学等研究背景者应聘(wanqiang_sheng@zju.edu.cn)。
相关论文信息:
https://doi.org/10.1016/j.molcel.2023.10.043
https://wap.sciencenet.cn/blog-3423233-1411567.html
上一篇:《自然—神经科学》:仇子龙/程田林团队成功利用全脑单碱基编辑技术改善孤独症小鼠核心症状
下一篇:《自然—细胞生物学》:北京生命科学研究所/清华大学沈博团队揭示骨髓移植后神经促进造血干细胞和血管再生的机制