博文
《细胞》:王俊/Aifantis等报道全新的肿瘤免疫逃逸膜相关MHC-I抑制轴
||
北京时间2023年8月8日晚,美国纽约大学格罗斯曼医学院王俊教授、Iannis Aifantis教授作为共同通讯作者在细胞Cell上发表题为“A membrane-associated MHC-I inhibitory axis for cancer immune evasion”的研究论文。
该研究基于王俊教授对肿瘤免疫和病毒免疫长达十数年的经验思考和深刻理解, 特别是观察到绝大部分病毒有很多非常有效的分子机制来主动抑制MHC-I抗原递呈,包括一些膜蛋白来直接作用于MHC-I来抑制其功能。既然病毒有那么多异常有效的抗原递呈负调机制,那肿瘤是否存在类似的普遍机制来介导免疫逃逸?
研究人员精巧设计了细胞表面肽-MHC-I复合物(pMHC-I complex)引导的全基因CRISPR筛选,并首次系统地鉴定了肿瘤细胞双向调节MHC-I抗原呈递的关键基因网络。该研究首次报道了一个以膜蛋白SUSD6和TMEM127为主的泛肿瘤细胞表面MHC-I抑制轴,为癌症免疫特别是冷肿瘤治疗提供了新的思路和靶点。
Aifantis教授课题组博士后陈旭峰和王俊教授课题组博士后鲁峤为本文共同第一作者。

免疫检查点阻断(ICB)免疫疗法在近年来取得了革命性的突破,极大地改变了癌症治疗的格局。【1】抗PD-1/PD-L1疗法,通常称为PD疗法,通过恢复肿瘤特异性T细胞的免疫应答,已在多种癌症类型中展现出持久的临床反应,Keytruda 等药物也预计于今年会成为全球销量最高的”药王”。【2, 3 】然而,对于许多肿瘤来说,T细胞浸润以及免疫应答相对较弱,即所谓的“冷肿瘤”现象,导致大部分患者对抗PD疗法无响应或者会出现获得性耐药。【2】 造成此类现象的其中一个原因是肿瘤可以显著降低肿瘤细胞MHC-I抗原呈递,从而影响介导肿瘤杀伤的CD8 T细胞数量以及功能,从而实现免疫逃逸。【4-6 】当前领域的主流理论认为促进MHC-I抗原递呈途径的关键基因(比如B2M, TAP1/2, JAK等等)的突变或者缺失是绝大部分肿瘤MHC-I抗原呈递下调的主要原因。但是这些基因的突变频率非常低,基于这些机制的潜在疗法 (比如gene therapy)对于肿瘤治疗实用性也不高,所以针对MHC-I抗原递呈途径的策略在肿瘤免疫领域一直没有得到显著的应用。
这项最新研究通过细胞表面肽-MHC-I复合物(pMHC-I complex)引导的急性髓系白血病(AML)细胞全基因CRISPR筛选,系统地鉴定了调节MHC-I抗原呈递的关键正调或负调因子。因为AML细胞起源于可以分化为抗原递呈细胞的髓系免疫细胞,在这些细胞系上发现的抗原递呈机制很有可能普遍存在于其他肿瘤类型。在该筛选过程中,研究人员验证了多种MHC-I抗原递呈途径正调因子,并首次发现了一种膜相关的MHC-I抑制性途径,其中涉及到三个关键因子,分别是两种膜蛋白SUSD6,TMEM127,以及参与蛋白降解的E3 泛素链接酶, WWP2 , 形成STW 抑制轴(图1)。
TMEM127是一种四次跨膜蛋白,与罕见的神经内分泌肿瘤易感相关,也被认为是一种Nedd4家族E3连接酶适配器,可以在沙门氏菌效应蛋白SteD存在下降解MHC II。而SUSD6,则是一种单次跨膜蛋白,在本文之前没有已知的免疫功能。
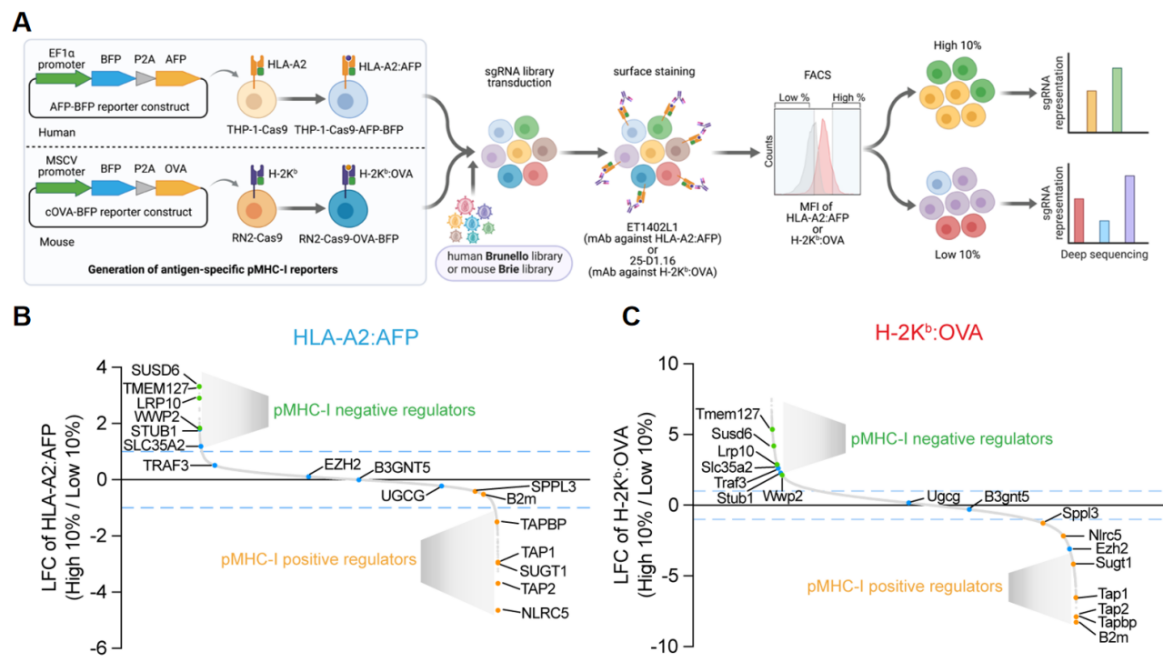
图1.全基因组筛选出肿瘤MHC-I 抗原呈递调节网络。A. CRISPR筛选示意图。B-C.人类和小鼠抗原特异性pMHC-I双向调节因子。绿色:未知的pMHC-I负调节因子,橙色:已知的pMHC-I正调节因子
实验结果表明,当SUSD6缺失时,MHC-I的细胞膜表面表达会得到增强,这进而促进了急性髓系白血病(AML)和实体肿瘤中T细胞介导的免疫监视。在小鼠AML模型中,SUSD6的缺失显著延缓了白血病的进展,并延长了动物的生存期(图2A-C),而且这种抗肿瘤活性主要依赖于CD8+ T细胞。另外,在多种实体肿瘤细胞系中,SUSD6的敲除同样显示出类似的免疫调节作用(图2D-G)。此外,生物信息学分析表明SUSD6在多种肿瘤,特别是冷肿瘤(胰腺癌,脑瘤等等)中高表达,并且其表达程度与癌症病人生存率成负相关的关系。SUSD6的表达与肿瘤微环境的T细胞激活特征也呈现负相关,暗示着SUSD6是一个具有临床价值的新型免疫调节分子。
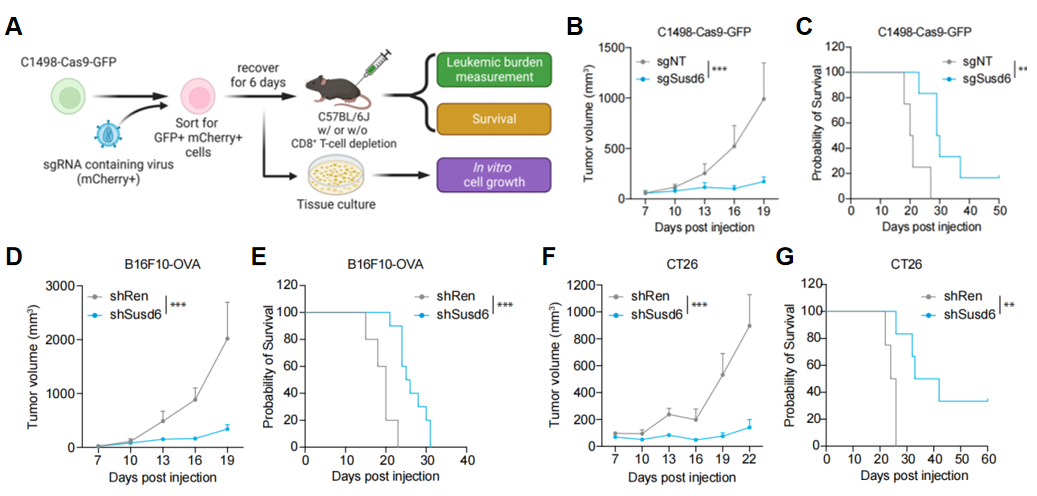
图2. 敲除SUSD6抑制肿瘤生长并延长小鼠寿命。(A)小鼠肿瘤模型示意图。(B-G)描述了移植了sgRNA转导的白血病肿瘤细胞(B-C),或者实体瘤细胞(D-G)的肿瘤体积(B,D,和F)和Kaplan-Meier生存曲线(C,E,和G)
有意思的是,SUSD6的敲除并不影响MHC-I的转录和翻译,但显著增强细胞的MHC-I总量(图3A)。因此,作者猜测SUSD6参与调节MHC-I的降解。实验结果证明,SUSD6推动了细胞表面MHC-I进入溶酶体降解(图3B),但不影响MHC-I的胞内贮存和再循环。进一步研究表明,SUSD6和TMEM127两个膜分子可以同时与MHC-I直接相互作用(图3C和D),并且共同招募E3泛素连接酶WWP2从而形成一个四元复合物(图3C,E,和F)。WWP2在SUSD6和TMEM127存在的情况下介导了MHC-I泛素化以及溶酶体降解,从而降低了MHC-I的表面表达(图3G)。
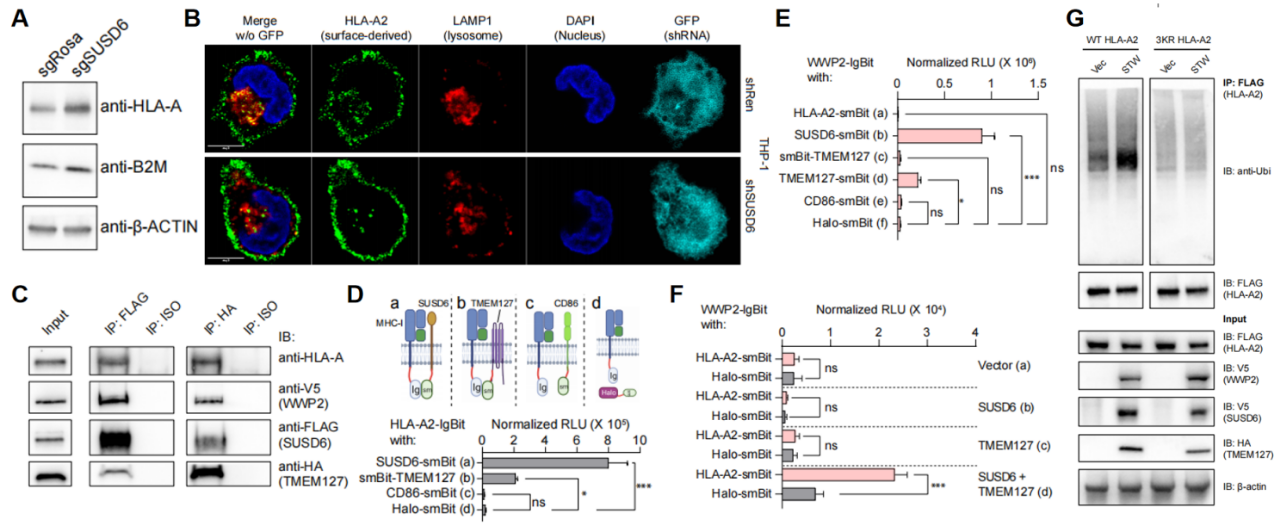
图3. SUSD6和TMEM127招募WWP2介导MHC-I泛素化从而被溶酶体降解。(A)蛋白质免疫印迹代表图。(B)表面来源的MHC-I与溶酶体标记物的共定位的代表性共聚焦图像。(C)免疫共沉淀显示四元复合物。(D-F)拆分荧光素酶实验显示分子间的直接相互作用。(G)免疫共沉淀显示STW复合物对于MHC-I泛素化的影响
研究人员还发现SUSD6/TMEM127/WWP2 (STW) 基因可以作为根据其表达特征作为生物标记物来预测病人的存活率。另外,通过敲除四元复合物中另一个重要分子,TMEM127,发现得到的现象与敲除SUSD6类似,从而揭示了靶向复合物其他分子来调节肿瘤MHC-I抗原呈递的可能性。
综上所述,该研究通过细胞表面肽-MHC-I引导的CRISPR筛选系统,鉴定了调节MHC-I途径的关键因子,揭示了SUSD6和TMEM127介导MHC-I降解的新机制(图4)。SUSD6的缺失能增强MHC-I表面表达,从而促进肿瘤免疫监视。这些发现有助于我们深入了解肿瘤免疫冷肿瘤现象,并为提高免疫疗法的治疗效果提供了潜在理论和靶点。未来,可以进一步探索这些调节因子在临床应用中的潜在价值,为个体化的癌症免疫治疗提供新思路和策略。
纽约大学王俊教授实验室致力于在人类疾病环境中发现关键的免疫反馈调节机制,深入了解其分子和疾病生物学,并设计基于这些新机制的前沿免疫疗法来治疗人类癌症和自身免疫疾病。实验室诚招对基础免疫学以及免疫治疗有着浓重兴趣以及具有探索精神的博士、博士后,以及访问学者加盟。Together, let’s make a difference and answer critical questions in immunotherapy!
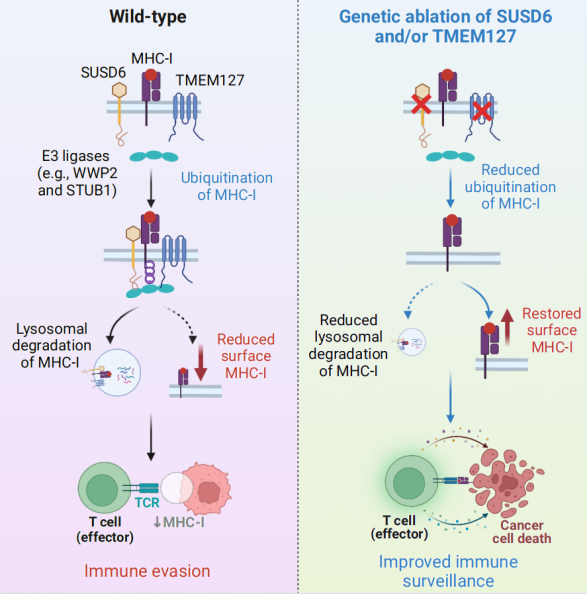
图4. SUSD6/TMEM127/WWP2复合物对于调节MHC-I抗原呈递的作用机制示意图
相关论文信息:
https://doi.org/10.1016/j.cell.2023.07.016
参考文献
1.Sharpe, A.H., and Pauken, K.E. (2018). The diverse functions of the PD1 inhibitory pathway. Nature Reviews Immunology 18, 153-167. 10.1038/nri.2017.108. 2.Sanmamed, M.F., and Chen, L. (2018). A Paradigm Shift in Cancer Immunotherapy: From Enhancement to Normalization. Cell 175, 313-326. 10.1016/j.cell.2018.09.035. 3.Wang, J., Yuan, R., Song, W., Sun, J., Liu, D., and Li, Z. (2017). PD-1, PD-L1 (B7-H1) and Tumor-Site Immune Modulation Therapy: The Historical Perspective. Journal of Hematology & Oncology 10, 34. 10.1186/s13045-017-0403-5. 4.Jhunjhunwala, S., Hammer, C., and Delamarre, L. (2021). Antigen presentation in cancer: insights into tumour immunogenicity and immune evasion. Nat Rev Cancer 21, 298-312. 10.1038/s41568-021-00339-z. 5.Dhatchinamoorthy, K., Colbert, J.D., and Rock, K.L. (2021). Cancer Immune Evasion Through Loss of MHC Class I Antigen Presentation. Front Immunol 12, 636568. 10.3389/fimmu.2021.636568. 6.Gettinger, S., Choi, J., Hastings, K., Truini, A., Datar, I., Sowell, R., Wurtz, A., Dong, W., Cai, G., Melnick, M.A., et al. (2017). Impaired HLA Class I Antigen Processing and Presentation as a Mechanism of Acquired Resistance to Immune Checkpoint Inhibitors in Lung Cancer. Cancer Discov 7, 1420-1435.
https://wap.sciencenet.cn/blog-3423233-1398512.html
上一篇:《自然》:哈佛医学院团队揭示禁食激活下丘脑-垂体-肾上腺轴的神经基础
下一篇:《细胞》:协同组装赋予调控特异性和长期的遗传环路稳定性