博文
王慧课题组揭示ucMSCs来源的外泌体对皮肤损伤的修复作用及分子机制
||
随着再生医学的不断发展,以干细胞为基础的皮肤组织工程在皮肤创伤愈合方面展现出巨大的应用前景。其中,脐带间充质干细胞(umbilical cord-derived mesenchymal stem cells,ucMSCs)具有对供体无风险、无不适、易获得,且与皮肤成纤维细胞基因表达模式高度相似的优点[1]。作为最重要的旁分泌因子,ucMSCs来源的外泌体(exosomes,Exos)与干细胞生理作用相似,通过向靶细胞直接递送生物活性分子例如蛋白质、mRNA以及microRNA等,进行细胞间的信息交流,从而影响多种生物过程,在损伤修复和组织再生中发挥着关键作用。
在皮肤损伤修复的炎症期,细胞代谢需氧量增加,而微循环血流瘀滞或血栓形成阻断了氧的供给,且侵入的炎症细胞摄取大量的氧,引起氧供相对不足,进一步加重缺氧。因此缺氧状态是皮肤创伤微环境常见的特征。伤口愈合过程中,涉及了许多类型的细胞及细胞因子的相互作用,其中内皮细胞(endothelial cells,ECs)负责形成微血管网络以启动血管生成,在整个修复过程中都至关重要。
2021年9月2日,华中科技大学同济医学院王慧课题组在Molecular therapy nucleic acids杂志(IF:8.9)在线发表了题为“Hypoxic ucMSC-secreted exosomal miR-125b promotes endothelial cell survival and migration during wound healing by targeting TP53INP1”的文章,揭示了缺氧诱导ucMSCs源性的外泌体通过富集microRNA成分调控内皮细胞功能促进皮肤损伤修复。

该团队前期的实验结果表明,三维共培养的ucMSCs和内皮细胞(ECs)提高了基于水凝胶的工程化皮肤组织的性能,可介导细胞间通讯和宿主整合[2]。与常氧培养上清液相比,缺氧培养ucMSCs的上清能够促进ECs增殖和迁移,说明ucMSCs主要通过旁分泌作用影响ECs的增殖和迁移,且缺氧促进了上述作用。鉴于水凝胶也为细胞提供了缺氧环境,该团队推测缺氧可能是ucMSCs和ECs相互作用的有利条件。
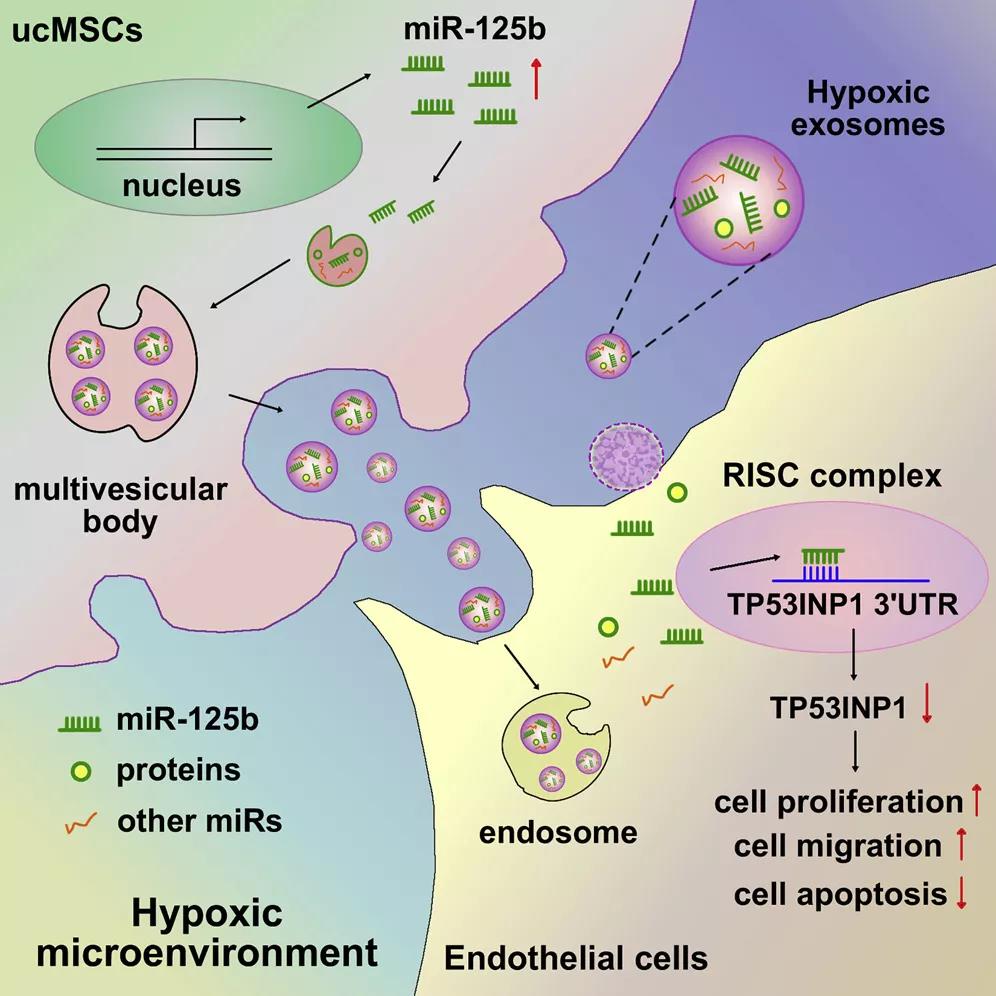
接下来,该团队深入研究了ucMSCs源性外泌体在体外调节内皮细胞功能的作用机制,并探讨了其在体内皮肤创伤修复中的作用。研究发现:ucMSCs源性外泌体促进内皮细胞增殖和迁移,抑制内皮细胞凋亡,从而促进创面愈合,且缺氧外泌体效果更为显著。
之后,该团队进一步探究了常氧及缺氧ucMSCs源性外泌体调控内皮细胞功能的分子机制。从已有研究中筛出ucMSCs源性外泌体中丰富的microRNA,包括miR-21-5p、miR-125b-5p、miR-23a-3p等[3],该团队证明在缺氧条件下ucMSCs的miR-125b表达水平显著升高,与内皮细胞相互作用是,能促进其增殖、迁移,抑制凋亡。
接下来,为了进一步探究miR-125b调控内皮细胞功能的机制,该团队通过GO、KEGG等生物信息学方法,结合TargetScan 、miRDB 、PicTar等数据库,寻找交集靶标,分析 MicroRNA-Targets配对,找到感兴趣的靶标TP53INP1,通过一系列实验验证了缺氧ucMSCs源性外泌体中的miR-125b通过靶向抑制ECs中的TP53INP1,促进细胞增殖、迁移,抑制细胞凋亡,从而促进创面愈合。
结果表明,在创伤后缺氧的微环境下,ucMSC-EC通过exosome传递miR-125b至内皮细胞,抑制TP53INP1信号通路,促进内皮细胞增殖和迁移,该研究为基于exosomal-miR-125b/TP53INP1的皮肤组织工程提供了新的机制和治疗靶点。
华中科技大学同济医学院王慧副教授为本研究的通讯作者。附属协和医院医学转化中心研究员张晓飞为第一作者。研究生王紫璇、汪婷、黄昆鹏等共同参与了此研究。该项目获国家自然青年基金(项目编号:81801923)的支持。
相关论文信息:
https://doi.org/10.1016/j.omtn.2021.07.014
参考文献
[1]CHEN D, HAO H, TONG C, et al. Transdifferentiation of Umbilical Cord-Derived Mesenchymal Stem Cells Into Epidermal-Like Cells by the Mimicking Skin Microenvironment [J]. Int J Low Extrem Wounds, 2015, 14(2): 136-45. [2]ZHANG X, LI J, YE P, et al. Coculture of mesenchymal stem cells and endothelial cells enhances host tissue integration and epidermis maturation through AKT activation in gelatin methacryloyl hydrogel-based skin model [J]. Acta Biomater, 2017, 59(317-26. [3]FANG S, XU C, ZHANG Y, et al. Umbilical Cord-Derived Mesenchymal Stem Cell-Derived Exosomal MicroRNAs Suppress Myofibroblast Differentiation by Inhibiting the Transforming Growth Factor-beta/SMAD2 Pathway During Wound Healing [J]. Stem Cells Transl Med, 2016, 5(10): 1425-39.
https://wap.sciencenet.cn/blog-3423233-1303204.html
上一篇:尹延东与合作者报道DNA复制的”进程监控”与”受激响应”的物理关联
下一篇:CELL突破!程亦凡/David Julius合作揭示痛觉感受器TRPV1如何感知多种自然界的刺激物