博文
Nature突破!迟洪波团队发现调控体液免疫应答新通路
||
北京时间2021年7月7日晚23时,美国圣犹达儿童研究医院迟洪波教授团队在Nature杂志上在线发表了题为“Metabolic control of TFH cells and humoral immunity by phosphatidylethanolamine”的文章[1]。
该研究鉴定了磷脂酰乙醇胺 (phosphatidylethanolamine, PE) 合成通路为调控体液免疫应答的新通路。该研究同时发现,区别于其他效应性CD4+T细胞 (effector T cell) 亚群,滤泡辅助性T细胞 (Follicular helper T cell, TFH) 细胞膜外叶上特异性的分布着一类有功能的磷脂—磷脂酰乙醇胺 。
在免疫反应过程中,许多免疫细胞经历成熟而变成功能增强的细胞,从而使得它们能够以特定方式对特定类型的病原体作出反应。这被称为“效应性细胞分化(effector cell differentiation[2])”。TFH细胞是近年发现的一类重要的效应性T细胞。TFH细胞的生理功能包括参与B细胞分化过程中的信息传递,协助激活B细胞,促进生发中心的形成和免疫球蛋白的类别转换,维持长时间体液免疫应答[3]。TFH细胞对免疫系统的建立以及功能的完善非常重要,特别是针对感染疾病的体液免疫起决定性调节作用,同时在自身免疫和肿瘤发生等相关疾病中也扮演重要角色[4,5]。虽然调控TFH细胞分化的转录因子已经被免疫学家们广泛研究和认知,然而,参与TFH细胞命运维持的转录及翻译后机制和代谢相关调控通路在TFH细胞中的作用一直是领域内的空白。
为鉴定调控TFH细胞分化的代谢基因,研究人员在LCMV-Armstrong 病毒株(Lymphocytic choriomeningitis virus,Armstrong strain)诱导的体液免疫应答模型中建立了靶向3017个代谢关联基因的体内CRISPR-Cas9 筛选系统。筛选结果表明, 参与磷脂酰乙醇胺合成(CDP-ethanolamine pathway)的三个节点基因,Etnk1, Pcyt2和Selenoi都是TFH细胞分化的正向调控因子。后续验证实验表明,CRISPR介导的Etnk1, Pcyt2和 Selenoi基因敲除能显著抑制TFH细胞分化,而且抑制程度与敲除TFH细胞转录因子Bcl6[6]敲除的效果相当,这提示CDP-ethanolamine pathway是决定体内TFH细胞分化的主要通路。
CDP-ethanolamine pathway为细胞内的PE 从头(de novo)合成途径,与其平行的一条通路是CDP-choline pathway,负责细胞内的PC (phosphatidylcholine) 的合成。另外PS (phosphatidylserine) 脱羧过程也可以产生PE。作者通过敲除CDP-choline pathway和PS脱羧途径中的节点基因,发现CDP-choline pathway 和PS 脱羧途径的阻断并不影响TFH细胞的体内分化,从而确认CDP-ethanolamine pathway特异性调控TFH细胞分化。
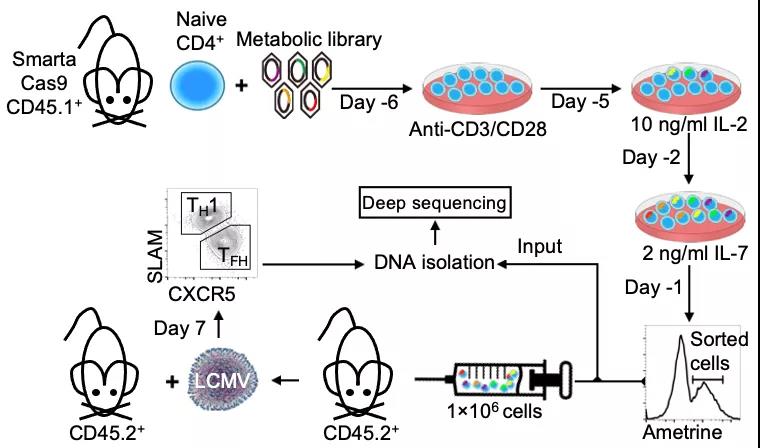
研究者对不同免疫细胞进行了Lipidomic(磷脂谱)分析,发现相比于naïve T 细胞(初始T细胞),TFH细胞的PE总量明显升高且TFH细胞具有更高的PE合成及降解速率。进一步的实验发现,不同于naïve和TH1细胞(能分泌IFN-γ的效应性T细胞),在TFH细胞分化的过程中,PE特异性的分布到小鼠TFH细胞浆膜的外叶。由于在多数情况下,细胞内PE主要分布于细胞膜的内叶,PE在TFH细胞的特殊定位进一步验证了PE代谢在TFH细胞中的关键作用。而且,通过对人的淋巴结和外周血的TFH细胞亚群的分析,作者发现这一表型是进化保守的,提示TFH细胞的PE浆膜分布存在重要生理功能。
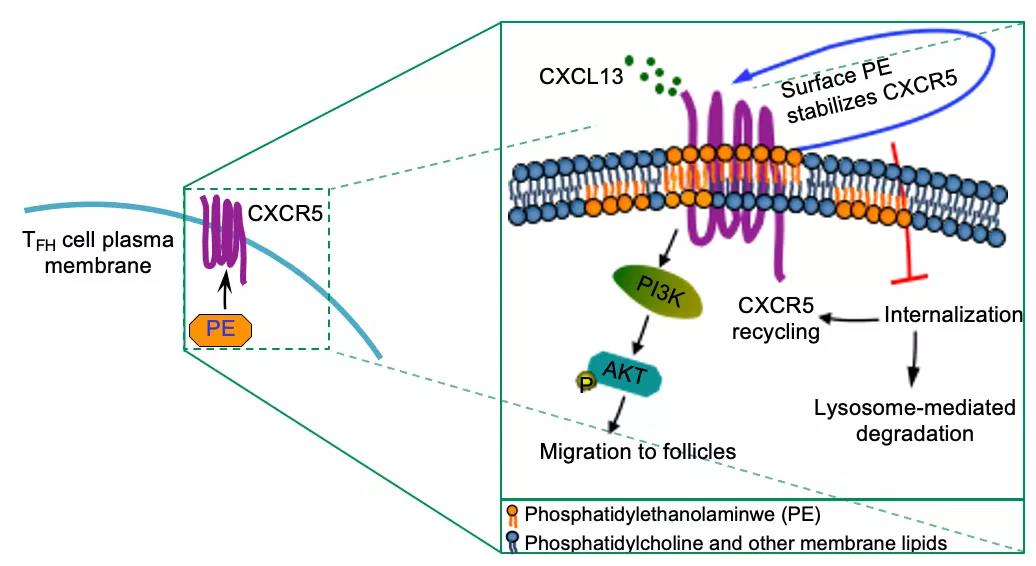
机制上,研究者发现,虽然CDP-ethanolamine pathway阻断后TFH细胞分化显著性降低,但是Bcl6的表达水平和表达量均没有改变。转录组学分析也进一步证实了CDP-ethanolamine pathway的阻断不影响Bcl6调节的早期TFH转录程序。这些都说明了CDP-ethanolamine pathway的功能独立于TFH细胞的转录因子Bcl6[6]。随后,研究者观察到了TFH细胞中特异表达的趋化因子受体CXCR5存在内化和降解现象。
同时通过多重实验手段,研究者发现CDP-ethanolamine pathway在TFH细胞分化早期特异性的调控CXCR5的蛋白表达,进而带动整个TFH分化程序的变化。PE在TFH细胞膜上和CXCR5相互作用并维持CXCR5的蛋白的稳定性。阻断CDP-ethanolamine pathway导致PE水平降低,CXCR5内化和降解加速,同时导致其浆膜再循环显著减少。
最后,研究者通过构建T细胞特异的条件型敲除小鼠,再次证实了CDP-ethanolamine pathway的缺失显著降低TFH细胞的体内分化,并减少淋巴组织生发中心面积和生发中心T细胞归巢数量。在抗原免疫诱导的TFH细胞分化模型中,CDP-ethanolamine pathway的缺失严重降低了生发中心B细胞和抗体分泌浆细胞的分化,进一步降低了抗原特异性抗体的分泌(如IgG, IgA, 和IgM),从而大大削弱了机体应有的体液免疫应答。
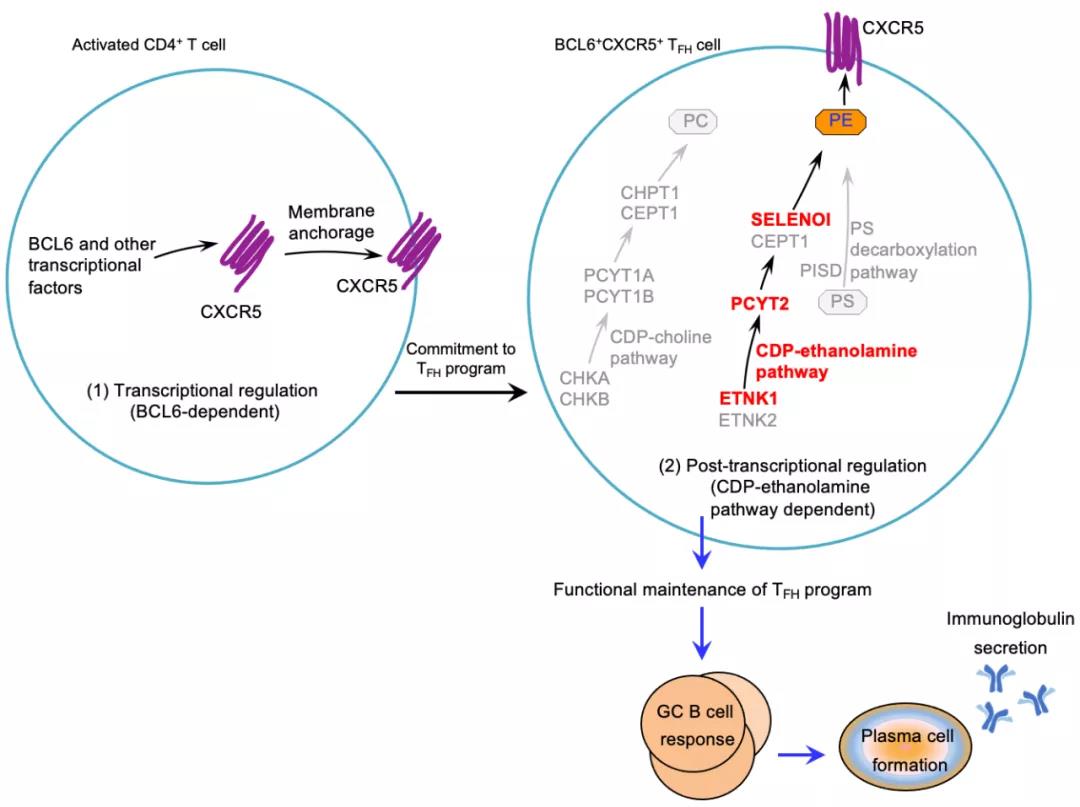
综上,此项研究鉴定了调控TFH细胞分化的新通路-CDP-ethanolamine pathway;阐明了de novo PE合成信号通过调控趋化因子受体CXCR5的定位和稳定性从而决定TFH细胞功能和体液免疫应答强度;揭示了代谢途径和转录后调节对效应性T细胞分化命运的重要性。CDP-ethanolamine pathway 是TFH细胞分化的正向调控元件,但CDP-choline pathway 和PS 脱羧途径的阻断并不影响TFH细胞的分化,这又强调了CDP-ethanolamine pathway对TFH细胞调节的特异性。
PE特异性分布于TFH细胞浆膜外叶和对CXCR5的稳定性和定位的时空管理回答了领域内的一个长期备受关注的科学问题,即TFH细胞的趋化因子受体的动态表达是如何被调控的。因此,这条代谢通路中的节点基因,如Etnk1,Pcyt2和Selenoi等非常有希望成为调控疫苗有效性和治疗自身免疫病的新靶点。
相关论文信息:
https://doi.org/10.1038/s41586-021-03692-z
参考文献
1,Fu., G. et al. Metabolic control of TFH cells and humoral immunity by phosphatidylethanolamine. Nature, (2021). 2,Saravia, J., Chapman, N. M. & Chi, H. Helper T cell differentiation. Cell Mol Immunol 16, 634-643, (2019). 3,Crotty, S. T Follicular Helper Cell Biology: A Decade of Discovery and Diseases. Immunity 50, 1132-1148, (2019). 4,Mintz, M. A. & Cyster, J. G. T follicular helper cells in germinal center B cell selection and lymphomagenesis. Immunol Rev 296, 48-61, (2020).
5,Wan, Z., Lin, Y., Zhao, Y. & Qi, H. TFH cells in bystander and cognate interactions with B cells. Immunol Rev 288, 28-36, (2019).
6,Choi, J. & Crotty, S. Bcl6-Mediated Transcriptional Regulation of Follicular Helper T cells (TFH). Trends Immunol 42, 336-349, (2021).
https://wap.sciencenet.cn/blog-3423233-1294606.html
上一篇:《细胞》:加州大学伯克利分校团队发现Th17细胞的代谢重塑能够影响自身免疫
下一篇:英国伯明翰大学郭志灵等首次发现生物转化调节金属纳米材料在血脑屏障中的穿越行为