博文
《自然》子刊:换上这个“小元件”,细菌就能“吃”塑料了
||
自然界有一种能“吃”PET塑料的细菌,它依靠一种特殊的酶将PET水解成可以利用的小分子。目前为止还没有找到第二种能“吃”PET的细菌。
这种细菌分泌的酶真的与众不同吗?它为什么能在同类酶中脱颖而出,练就“吃”塑料的独门绝技?
北京时间2021年5月20日晚23时,《自然—催化》在线发表了湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室郭瑞庭教授团队的最新成果。 他们发现这种细菌在不到100年时间内进化出这种特殊的酶,具备与众不同的结构,使其能够降解体积较大的PET分子。基于此,科学家可以开发出多种新型PET降解酶。

自然界独一无二的塑料降解酶
塑料废弃物在环境和生态系统中造成的污染,已经成为不可忽视的严重问题。聚对苯二甲酸乙二酯(polyethylene terephthalate,PET),是生产与消耗量最多的塑料之一,目前全球年产量已近7000万吨。
PET防水、耐热、抗酸碱腐蚀,所以大量运用在食品饮料包装和人造纤维中,大多数矿泉水瓶原料就是PET。大部分PET废弃物以土地掩埋或焚烧法来处理。
论文共同通讯作者郭瑞庭告诉《中国科学报》,PET的回收率仅有10%左右,而目前较常使用的物理或化学回收法都有其限制性。“因此,发展温和绿色的生物降解法来处理PET废弃物,是人类社会寻求可持续发展的重要课题。
”
PET为聚酯大分子,“理论上有可能被能够降解酯键的酶所水解,然而大量的芳香环以及结构致密的结晶区,使得PET对于酶介导的作用有非常强的抗性。因此,寻找更为有效的PET降解酶是开发生物降解PET技术的核心”。论文共同第一作者、湖北大学教授陈纯琪在接受《中国科学报》采访时说。
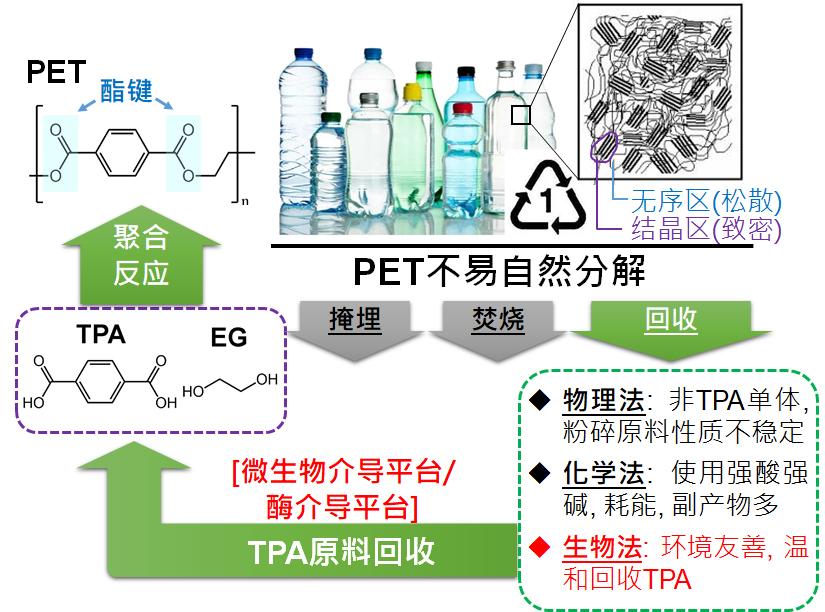
图一 PET塑料单体、聚合体、产品,以及废弃物处理的主要手段。
塑料性质稳定,一般认为需要数百年的时间才可能被自然分解。2016年,Yoshida等人在日本大阪近郊的PET回收处分离了一株能“吃”PET的细菌Ideonella sakaiensis。
这株细菌分泌一个能够将PET水解成小分子的酶,被称为IsPETase,分解后的小分子MHET与TPA可以被这种细菌吸收利用。
“IsPETase是目前为止唯一在自然界演化产生的真正意义上的PET降解酶。”郭瑞庭说,不过,IsPETase并不是一个全新的酶,而是属于一种古老的酶种——角质酶。
论文共同通讯作者、湖北大学副教授戴隆海介绍,角质酶原本是微生物用来分解植物角质层的。研究发现,古老的角质酶分解PET的活力非常低,但与角质酶结构非常相似的IsPETase却能够很好的水解PET。
“PET问世不到70年,细菌如何能够在这么短的时间内把角质酶转变成PET降解酶?”郭瑞庭说,其中的奥秘始终没有被揭露。
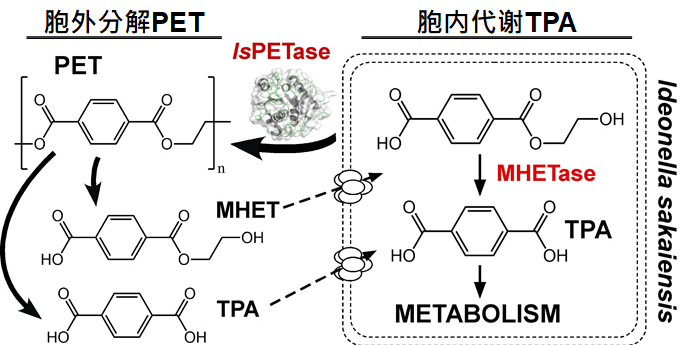
图二、PET生物降解机制。I. sakaiensis降解代谢PET途径简图。I. sakaiensis表达IsPETase与MHETase将PET降解成TPA单体后,在胞内进行TPA代谢。
从角质酶进化而来?
郭瑞庭与陈纯琪团队长期从事蛋白质结构与功能分析。此前,他们已经联手解析了IsPETase的晶体结构。
2017年,他们首度在国际上报道了IsPETase的晶体结构与酶和底物类似物的复合体结构。
陈纯琪介绍,他们发现,与经典的角质酶比对,IsPETase有三个主要结构特征:IsPETase的第二底物结合域多了一段,可能与PET的结合有关;IsPETase比经典的角质酶多出一对二硫键,作用在于稳定上述结构域多出的一段;IsPETase第一底物结合域较为宽阔,这是因为一个关键的底物结合氨基酸W185采取多样构型,导致底物结合口袋可能出现较为宽阔的构像。
2020年,他们又对比IsPETase与角质酶的蛋白质结构,发现角质酶的底物结合区较为狭窄,比较适合作用于形状细长的角质,而不利于作用在构造较为宽大的PET上。
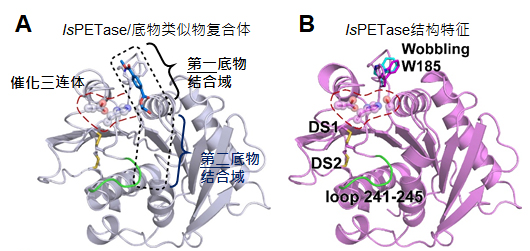
图三 PET降解酶结构特征。(A) IsPETase与底物类似物复合体结构(PDB ID,5XH3),红色虚线框:活性中心的催化三联体,黑色虚线框:底物结合域。(B) IsPETase特有之结构特征。

图四 2020年3月Nature Reviews Chemistry 封面文章。郭瑞庭教授团队总结各种高分子生物降解机理,特别针对酶的结构特性与底物结合模式进行讨论,找寻其中的关联以及微生物因应人造物质出现的演化方向,为生物质资源的利用与塑料生物降解提供未来展望。
解析大小二元体
论文共同通讯作者、湖北大学副教授黄建文介绍,他们根据上述三个结构特征来寻找更多具有降解PET活性的酶。
然而,利用第一个和第二个特征找到的酶降解PET的活力依然很低。“于是我们转而专注于第三项特征。”黄建文说。
于是,他们有了新的发现。
论文共同第一作者、中科院天津工业生物技术研究所助理研究员韩旭介绍,IsPETase底物结合区的组成与角质酶是一样的,但IsPETase底物结合区的氨基酸W185可以自由摆动。
“当PET结合到IsPETase上时,氨基酸W185会往下压低一些。如此一来,底物结合区的空间就变得较为开阔,这样就能够容纳较大的PET分子。”陈纯琪说。
郭瑞庭告诉记者,所有的角质酶在相对的位置都具有这个色氨酸,但是在所有角质酶里面,这个色氨酸侧链的方向都是固定的。“为什么同样的氨基酸,在两种相似的酶里面会展现不同的构像变化呢?这么细微的差异真的是造成IsPETase与角质酶降解PET活力高低不同的关键因素吗?”面对这两个问题,郭瑞庭团队开始了深入的解析。
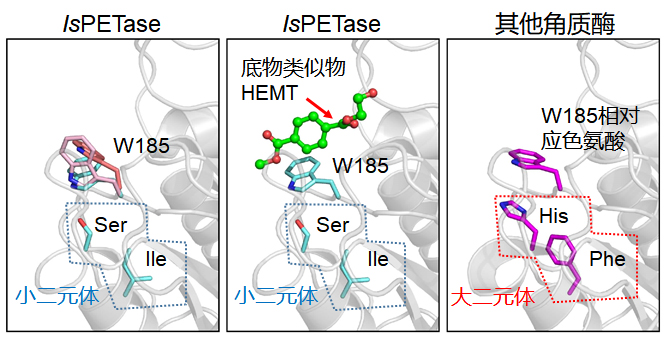
图五、IsPETase与其他经典角质酶活性区关键差异。IsPETase活性区当中负责结合底物的W185展现三种不同构像,结合了底物的是蓝色构像。在其他角质酶中W185相对应的色氨酸则是红色的构像,并不利于结合PET。
郭瑞庭介绍,进一步分析色氨酸邻近的区域发现,在所有角质酶中,色氨酸下方有组氨酸与苯丙氨酸这两个侧链较大的氨基酸(简称大二元体)支撑着,它们就像支架一样固定住了色氨酸使其无法转动。
而在IsPETase中,氨基酸W185下方则是丝氨酸和异亮氨酸(简称小二元体),它们的侧链基团较小,固定不住W185。“因此,W185就能自由摆动,IsPETase的底物结合区也就能够伸缩自如了。”陈纯琪说。
有趣的是,将IsPETase的小二元体换成大二元体, PET降解的活性就会大幅下降;反之,将角质酶中的大二元体换成小二元体,降解PET的活性就会大幅提升。
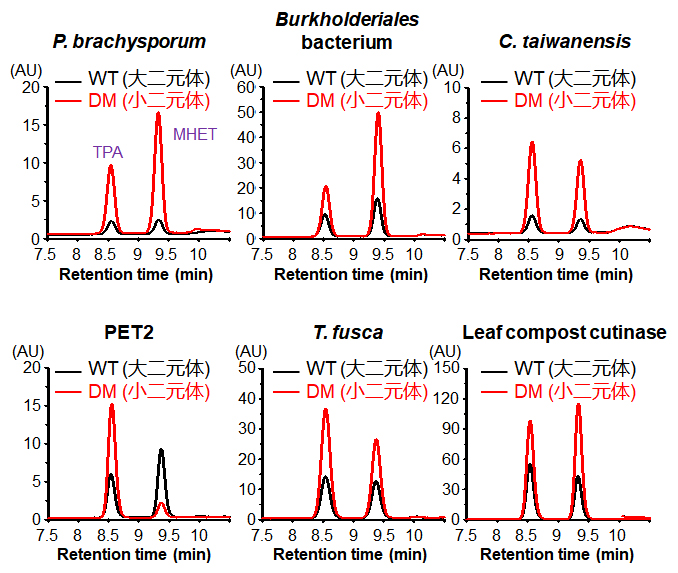
图六 郭瑞庭团队测试了8个角质酶,发现其中6个角质酶导入Ser/Ile小二元突变可创制新型PET降解酶。图为六个有明显效果的酶降解PET所得产物的HPLC层析图谱,黑色线为野生型带有大二元体的酶,红色线为DM突变带有小二元体的酶。
寻找更多塑料降解酶
“由此可知,大小二元体的转换极有可能就是产生一个PET降解酶最关键的条件。”戴隆海说,考查密码子可以发现,只需要突变三个碱基就能够将大二元体变成小二元体,而累积三个突变位点是有可能在短时间之内发生的。
郭瑞庭认为,由此可以推论,为了快速适应生存环境中堆积的大量PET废弃物,细菌在古老的角质酶中导入突变,将之转变成了一个有效的PET降解酶,用以分解PET作为能量的来源。
“微生物在短时间内选择了突变角质酶来分解PET,显示这可能是产生一个PET降解酶最快速有效的途径。”郭瑞庭说,这些结果为大自然应对并分解塑料的演化过程提出理论根据,也揭示了自然界在短时间演化出更多塑料降解酶机制的可能性。
此外,“导入小二元体是创制更多性质优良的PET降解酶的一个有效的策略。”陈纯琪说,他们已经利用这个方法获得了多个新型的PET降解酶,而这一系列的新酶将对发展生物降解塑料技术创造重要价值。
相关论文信息:
https://doi.org/10.1038/s41929-021-00616-y
参考文献
1, Structural insight into catalytic mechanism of PET hydrolase,Nature Communications volume 8, Article number: 2106 (2017).
2, Enzymatic degradation of plant biomass and synthetic polymers
,Nature Reviews Chemistry volume 4, pages114–126 (2020).
https://wap.sciencenet.cn/blog-3423233-1287556.html
上一篇:韩大力/徐萌团队联合揭示肿瘤相关巨噬细胞调控CD8+ T细胞命运新机制
下一篇:突破!科学家发现Zeb2基因的全新增强子及其在不同造血阶段中的调控机制