博文
张晓霆团队发现乳腺癌转移与耐药性的新型共驱动子
||
北京时间2021年3月10日凌晨, 美国辛辛那提大学医学院有关乳腺癌转移与耐药性的新型共驱动子发现的研究工作在Cell Reports在线发表——“Functional Cooperation between Co-amplified Genes Promotes Aggressive Phenotypes of HER2-positive Breast Cancer”。
辛辛那提大学医学院肿瘤生物学系张晓霆讲席教授为文章通讯作者。杨用光博士为第一作者。本课题在美国NIH、俄亥俄癌症研究基金、和辛辛那提大学癌症中心的资助下完成。

乳腺癌是全球最常见的女性肿瘤而且发病率还在继续持续上升 。乳腺癌包括雌激素受体 (estrogen receptor,ER) 阳性,人表皮生长因子受体2 (human epidermal growth factor receptor 2,HER2) 阳性和三阴性乳腺癌等几个亚类。其中ER阳性和HER2阳性乳腺癌为最主要的发病类型,分别占据临床病例的75%和20%左右。虽然针对ER或HER2 的靶向治疗在临床上被广泛应用,但是还是存在副作用,耐药性和高复发等难点 (1)。
HER2阳性乳腺癌是一类预后差和容易发生转移的乳腺癌亚类,并且经常对HER2靶向治疗产耐药性。在HER2阳性乳腺癌细胞中,HER2基因的扩增导致了HER2蛋白的高表达以及乳腺肿瘤的发生。在HER2扩增子的同一染色体区域,还有大约十几个其他基因,其中包括MED1,会与HER2一起在乳腺癌中扩增。
但是目前尚不清楚是否任何这些共同扩增的基因会与HER2合作,在乳腺癌的发生,转移和耐药性中发挥作用 (2)。此前通过临床样本分析、构建基因功能缺失小鼠模型以及耐药性试验,该团队已经报道了MED1对ER阳性乳腺癌 及ER靶向治疗耐药性的重要作用 (3, 4)。
为了进一步研究 MED1共表达在HER2阳性乳腺癌中的功能, 本研究构建了一个新型小鼠乳腺癌模型(MMTV-HER2/MMTV-MED1)。与此前的HER2 乳腺癌小鼠模型相比,这一新的HER2阳性乳腺肿瘤模型在乳腺上皮细胞中同时高表达HER2和MED1。进一步分析表明它们在这一模型中的蛋白表达水平与人类HER2阳乳腺癌细胞和临床样本非常类似。
利用此模型, 研究人员发现,HER2和MED1可以相互促进彼此的表达及功能,从而驱动癌细胞的生长、肿瘤干细胞的形成以及肿瘤的转移。此外,与对照组相比,MED1高表达同时也降低了乳腺癌对HER2靶向治疗的敏感性;而通过RNA干扰技术特异性的降低 MED1表达可以显著提高人源乳腺癌细胞对HER2靶向治疗的敏感性。
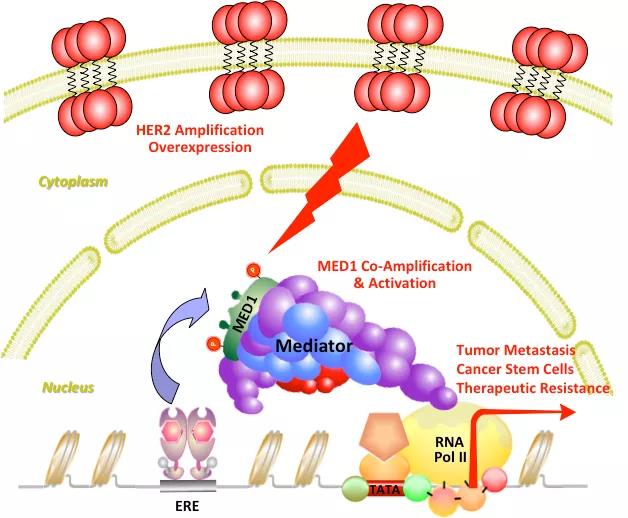
图1: MED1 和HER2协同促进乳腺癌的形成、转移和耐药性模式图。
通过RNA-Seq和ChIP分析,研究人员进一步发现并鉴定了MED1的关键下游分子Jab1。Jab1为COP9信号复合体(COP9 signalosome,CSN)的一个关键亚基,其主要通过调节底物的泛素化水平而发挥重要作用。研究发现MED1可以通过特异性识别并结合到Jab1基因启动子部位促进其转录;而Jab1则能够通过调节MED1的泛素化水平促进其在目标基因启动子部位的循环招募,从而进增强其转录功能。
最后,研究人员通过免疫组化方法分析了MED1和Jab1蛋白在乳腺癌临床样本中的表达。结果显示,MED1和Jab1在 HER2阳性乳腺癌中都高水平表达且具有非常显著的正相关性,而在HER2阴性的乳腺癌样本中则没有观察到这一现象。这与来自上述转基因小鼠乳腺肿瘤中得到的结果完全一致。
综上所述,本文建立了首个与临床更为相关的小鼠乳腺癌模型,并发现了一个与HER2共同扩增的基因MED1,可以与它一起协同作用共同驱动HER2阳性乳腺癌的发生和恶性表型。这一研究和模型的建立为进一步研究HER2阳性乳腺癌的发病机理和筛选更为有效的治疗方法奠定了基础,并为HER2阳性乳腺癌的治疗提供了新的思路和潜在靶点。
值得注意的是,该团队最近使用RNA纳米技术(RNA Nanotechnology)开发出一种针对MED1 高效安全的肿瘤靶向RNA纳米颗粒疗法并已申请专利(5,6)。
相关论文信息:
https://doi.org/10.1016/j.celrep.2021.108822
参考文献
1. Waks, A.G. and E.P. Winer, Breast cancer treatment: a review. Jama, 2019. 321(3): p. 288-300. 2. Kauraniemi, P., et al, New amplified and highly expressed genes discovered in the ERBB2 amplicon in breast cancer by cDNA microarrays. Cancer research, 2001. 61, 8235-40. 3. Cui, J., et al., Crosstalk Between HER2 and MED1 Regulates Tamoxifen Resistance of Human Breast Cancer Cells. Cancer Research, 2012. 72: p. 5625-5634. 4. Yang, Y., et al., HER2-Driven Breast Tumorigenesis Relies upon Interactions of the Estrogen Receptor with Coactivator MED1. Cancer Res, 2018. 78(2): p. 422-435. 5. Zhang, Y., et al., Overcoming Tamoxifen Resistance of Human Breast Cancer by Targeted Gene Silencing Using Multifunctional pRNA Nanoparticles. ACS Nano, 2017. 11(1): p. 335-346. 6. Leonard M., et al., Emerging Approaches to Overcome Breast Cancer Endocrine Resistance. Estrogen Receptor and Breast Cancer --- Celebrating the 60th Anniversary of the Discovery of ER, X. Zhang, Book Editor. Springer Nature, 2019. p. 379-403.
https://wap.sciencenet.cn/blog-3423233-1275920.html
上一篇:易庆团队发现脂代谢分子CD36调节肿瘤内CD8+T细胞功能的新机制
下一篇:载入教科书!历时百年,瓢叶目植物“认祖归宗”