博文
突破!裴华东/贺福初/秦伟捷等揭示O-GlcNAc修饰调控肿瘤细胞脂质从头合成的新机制
 精选
精选
||
北京时间2021年3月3日凌晨,裴华东团队与秦伟捷团队以及贺福初院士团队等合作再次在Molecular Cell杂志上发表了题为“Posttranscriptional Regulation of De Novo Lipogenesis by Glucose-Induced O-GlcNAcylation”的研究论文。 该研究报道了O-GlcNAc修饰通过增强SRPK2的细胞核内定位、在转录后水平上调控肿瘤细胞的脂质从头合成水平、进而促进肿瘤生长的新机制;这一调控依赖于importin α/β入核转运系统,且进一步研究提示importin α蛋白可能是O-GlcNAc修饰的“reader”。

肿瘤细胞中往往会发生葡萄糖和谷氨酰胺等代谢通路的异常激活[1,2],而葡萄糖与谷氨酰胺都是细胞内己糖胺生物合成途径(hexosamine biosynthetic pathway, HBP)的重要底物,该途径是产生糖基供体UDP-GlcNAc的关键通路[3]。糖基转移酶OGT可以利用UDP-GlcNAc在蛋白的丝氨酸或苏氨酸残基上形成O-GlcNAc修饰。
O-GlcNAc修饰已被发现参与调控细胞内多种重要的生物学过程,如基因转录和细胞代谢等[4],但细胞中O-GlcNAc修饰的“reader”还并不清楚。不仅如此,在多种肿瘤组织中,O-GlcNAc修饰的整体水平都有显著上调[5],因此鉴定其中O-GlcNAc修饰的重要底物与相应的功能机制研究显得尤为关键。
除了葡萄糖代谢异常外,肿瘤细胞还需要其他大量的代谢中间产物来满足其快速生长与增殖的需求,其中就包括脂质成分。尽管肿瘤细胞可以通过从外界微环境中摄取脂质成分,但是研究表明大多数肿瘤细胞中都会发生脂质从头合成途径的异常激活[6]。SREBPs是调控细胞脂质合成的关键转录因子。当细胞内脂质水平下调时,SREBPs蛋白可以发生蛋白切割活化,转位进入细胞核内,从而激活下游脂质合成相关基因的转录与表达[7]。此外,细胞的脂质从头合成也在转录后水平上受到严格的调控。
2017年,美国康奈尔大学Blenis教授团队等在Cell杂志上发文,首次发现作为重要的mRNA剪接调控蛋白激酶,SRPK2可以被mTORC1通路的关键下游蛋白激酶S6K1磷酸化修饰,从而增强其细胞核定位,促进脂质从头合成相关基因mRNA的剪接和稳定性,以及肿瘤细胞的脂质从头合成水平与肿瘤生长[8]。
在最新研究中,研究人员以O-GlcNAc修饰形成所需糖基供体 UDP-GlcNAc的合成通路—— 己糖胺生物合成途径作为切入点,通过敲低该途径的关键限速酶GFPT1与回补UDP-GlcNAc的方式,证实了O-GlcNAc修饰可以调控细胞内脂质从头合成水平以及相关基因mRNA的剪接、稳定性与表达水平,并且这种转录后水平的调控依赖于SRPK2。
接着,通过一系列的生化实验,研究人员证实了SRPK2是糖基转移酶OGT的新底物,并且鉴定到了3个高可信的糖基化修饰位点——S490、T492和T498。免疫荧光实验表明OGT介导的糖基化修饰可以促进SRPK2在细胞核内的定位。而在细胞中,importin α/β系统是调控蛋白入核的经典途径,其中importin α蛋白的N端可以结合importin β蛋白,C端可以结合货物蛋白的核定位序列(Nuclear-localization signal, NLS),从而形成三元复合物通过核孔将蛋白运入细胞核内[9]。SRPK2上的糖基化修饰位点位于其NLS里面,且体外实验表明糖基化修饰可以显著增强SRPK2与相应importin α蛋白的相互作用。
之后,考虑到前人报道的mTORC1/S6K1介导的SRPK2的磷酸化修饰位点与鉴定到的糖基化位点相近,那么其与糖基化修饰之间是否存在相互影响呢?实验表明,SRPK2糖基化修饰存在与否并不影响SRPK2 S494位点的磷酸化修饰,并且在雷帕霉素处理的条件下,SRPK2糖基化修饰仍然能够响应外界葡萄糖浓度的变化,进一步调控脂质的从头合成水平。这些结果都提示OGT-SRPK2通路平行于mTORC1-S6K1-SRPK2通路。不仅如此,体内体外实验都表明SRPK2糖基化修饰可以促进乳腺癌细胞的生长与增殖。
最后,研究人员结合自有数据和已发表的数据库信息,发现在三百多个鼠源或者人源蛋白的NLS里面或附近都存在糖基化修饰位点。从这些蛋白中,研究人员选择了RELA与Sp1进行了实验验证,结果证实了这些蛋白的糖基化修饰可以显著增强其与相应importin α蛋白的相互作用,进而促进其在细胞核内的定位。这就说明糖基化修饰促进蛋白入核是细胞内普遍存在的一个重要机制,而importin α蛋白本身很可能是一个O-GlcNAc修饰的“reader”。
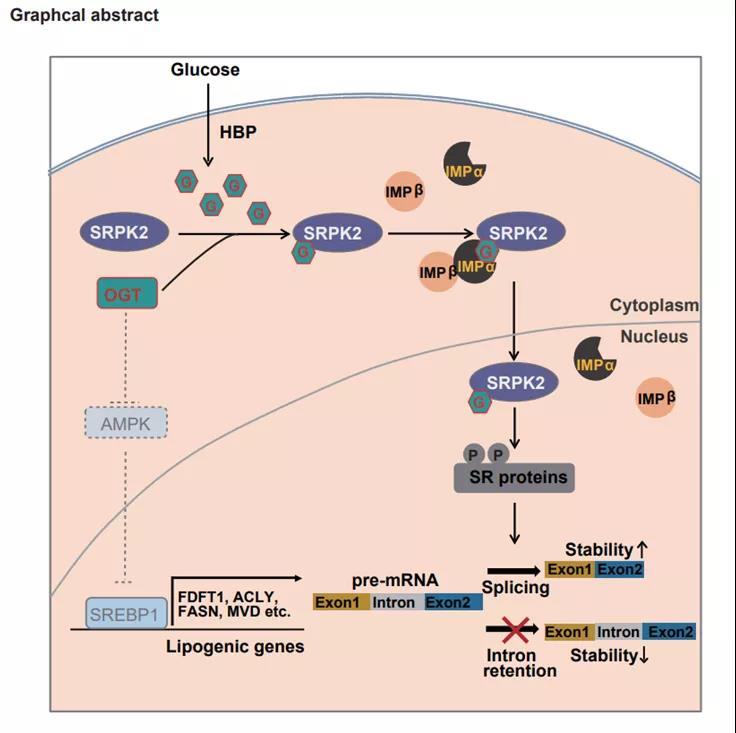
总的来说,该研究一方面揭示了O-GlcNAc修饰在转录后水平上调控肿瘤细胞脂质从头合成与促进肿瘤生长的分子机制,且OGT-SRPK2通路平行于mTORC1-S6K1-SRPK2通路,提示OGT与mTORC1通路抑制剂的联合使用可能对于相关肿瘤的治疗具有更好的效果;另一方面证实了糖基化修饰介导的importin α蛋白依赖的蛋白入核机制在细胞内普遍存在,提示importin α蛋白很可能是一个O-GlcNAc修饰的“reader”。
裴华东课题组的谭伟博士,贺福初院士课题组的蒋沛博士生,以及秦伟捷课题组的张万军博士为该论文的共同第一作者。裴华东,贺福初和秦伟捷为并列通讯作者。该工作得到了华中科技大学薛宇教授,乔治华盛顿大学的朱文革教授及武汉大学人民医院宋启斌教授团队的大力支持。
裴华东课题组主要有两个研究方向:1)DNA损伤修复应答与肿瘤发生;2)糖生物学和人类疾病。过去五年在Molecular Cell (2016, 2017, 2021), Nature Communications( 2016, 2019), EMBO J (2020)等杂志上发表文章。裴华东课题组现在招聘博士后,欢迎感兴趣的人联系,有肿瘤免疫微环境、肿瘤免疫应答或质谱经验的优先考虑。
相关论文信息:
参考文献
[1] Pavlova N N, Thompson C B. The Emerging Hallmarks of Cancer Metabolism[J]. Cell Metab, 2016, 23(1): 27-47. [2] Altman B J, Stine Z E, Dang C V. From Krebs to clinic: glutamine metabolism to cancer therapy[J]. Nat Rev Cancer, 2016, 16(11): 749. [3] Slawson C, Hart G W. O-GlcNAc signalling: implications for cancer cell biology[J]. Nature Reviews Cancer, 2011, 11(9): 678-684. [4] Yang X, Qian K. Protein O-GlcNAcylation: emerging mechanisms and functions[J]. Nature reviews Molecular cell biology, 2017, 18(7): 452. [5] De Queiroz R M, Carvalho E, Dias W B. O-GlcNAcylation: The Sweet Side of the Cancer[J]. Front Oncol, 2014, 4: 132. [6] Snaebjornsson M T, Janaki-Raman S, Schulze A. Greasing the Wheels of the Cancer Machine: The Role of Lipid Metabolism in Cancer[J]. Cell Metabolism, 2020, 31(1): 62-76. [7] Wu S, Naar A M. SREBP1-dependent de novo fatty acid synthesis gene expression is elevated in malignant melanoma and represents a cellular survival trait[J]. Sci Rep, 2019, 9(1): 10369. [8] Lee G, Zheng Y, Cho S, et al. Post-transcriptional Regulation of De Novo Lipogenesis by mTORC1-S6K1-SRPK2 Signaling[J]. Cell, 2017, 171(7): 1545-1558 e18. [9] Christie M, Chang C W, Rona G, et al. Structural Biology and Regulation of Protein Import into the Nucleus[J]. J Mol Biol, 2016, 428(10 Pt A): 2060-90. [10] Peng C, Zhu Y, Zhang W, Zhang H, Chen Y, Zhao X, Zhang J, Zeng P, Qin W, and Pei H*. Regulation of the Hippo-YAP Pathway by Glucose Sensor O-GlcNAcylation. Mol Cell. 2017 68(3):591-604.
https://wap.sciencenet.cn/blog-3423233-1274737.html
上一篇:姜有星团队解析人CNGA1同源四聚体开放和关闭状态的冷冻电镜三维结构
下一篇:浙江大学医学院郭国骥团队发表基于跨物种细胞图谱的谱系进化研究