博文
华中科大MOST团队曾绍群/袁菁合作实现亚细胞突触分辨的高通量多色全脑荧光成像
||
北京时间2021年2月2日,华中科技大学武汉光电国家研究中心生物医学光子学中心MOST团队在Cell Reports在线发表论文——“Chemical sectioning fluorescence tomography:high-throughput, high-contrast, multicolor, wholebrain imaging at subcellular resolution”。
该研究提出了化学层析荧光断层成像(CSFT)的显微光学成像新原理,在小鼠全脑、完整单神经元水平,实现了亚细胞突触分辨的高通量、多色荧光成像,为绘制介观脑联接图谱提供了新方法和新工具。
华中科技大学曾绍群教授和袁菁教授为该文共同通讯作者,研究生王小俊、熊汗青、刘钰蓉和杨涛为共同第一作者。

在全脑尺度、单神经元、亚细胞分辨水平,研究大脑的精细解剖结构,对我们理解脑网络的细胞类型、回路连接和功能机理等,起着至关重要的作用。神经元结构精细、跨尺度的内在特征(既有覆盖全脑的长程投射、又有突触水平的回路连接),对全脑成像方法提出了巨大挑战——如何实现全脑(大范围)、高分辨(突触)和高通量(快速)荧光成像。
全脑网络显微光学成像方法主要分两大类:点扫描成像和宽场成像
点扫描成像,以基于共聚焦或双光子的方法为代表,分辨率较高、背景抑制能力较强,但成像速度很慢。一味地提高点扫描速度,往往会导致成像效果变差:分辨率上的恶化以及荧光弱信号的丢失。
宽场成像,以结合组织光透明的光片成像(Light-Sheet Fluorescence Microscopy,LSFM)为代表,通量较高,但成像对比度受限于光片照明厚度。光学原理决定,光片厚度与照明范围难以兼顾,无法在全脑范围实现高分辨。目前,光片成像的应用还主要以牺牲分辨率、快速获取全脑细胞分辨的荧光数据为主。
课题组提出了化学层析(Chemical Sectioning)的新原理,建立了荧光断层成像新技术,打破高对比度和高通量全脑荧光成像的技术瓶颈
采用基于宽场的Block-face成像,似乎是最佳的高通量获取大范围荧光图像数据集的方法。但是,如何抑制焦面以外背景的干扰,直接决定其图像的对比度。对此,该研究基于荧光蛋白(fluorescent protein,FP)发光特性的化学操控,发展了化学层析荧光断层成像(CSFT)的新技术。首先,通过质子化将全脑中的荧光蛋白(FP)分子切换成不发光(OFF)状态;然后,在成像时通过去质子化激活表面荧光蛋白分子(ON),进行宽场成像;再结合超薄切削除去表面暴露出新的表面,进行循环激活-成像。
该技术的核心在于控制激活层的厚度。实验中通过调整激活液的浓度,可方便地控制表面激活层的厚度。该研究实现了亚微米(<500nm)的超薄轴向层析厚度,从而高效抑制宽场成像焦外背景的干扰,保证了高光学对比度。并且,借助于飞行成像中时间延迟积分(TDI)的成像策略,可在不牺牲信号探测灵敏度的前提下,进一步提高成像通量和体素采样率,完成小鼠全脑荧光数据的采集。
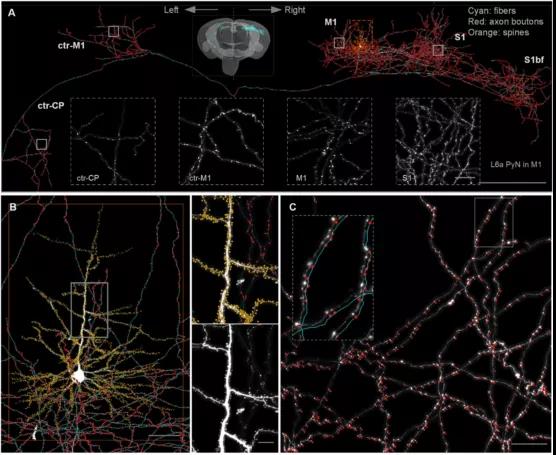
图1.全脑范围、完整单神经元的突触相关亚细胞精细结构(dendritic spine和axon bouton)
亚细胞突触分辨的全脑、多色、单神经元解剖结构成像
该研究探索了多色FPs在塑性包埋中的荧光保持机理,发现FP分子在树脂中的质子化水平是决定荧光保持与否的关键;从而,发展了多种颜色、兼容fMOST树脂包埋和精细成像的荧光蛋白工具,实现了高分辨的fMOST全脑多色荧光成像。
该研究证明了CSFT成像方法,可以系统性地以亚细胞分辨水平来获取病毒或遗传学荧光标记的长程投射神经元(long-projecting neuron)和中间神经元(interneuron)类型的精细解剖结构。首次在小鼠全脑尺度、亚细胞分辨、完整单神经元水平,演示了多色CSFT成像在定量获取神经环路突触连接节点信息上的应用。
该项研究得到国家973项目、基金委创新群体、博士后特别资助基金及武汉光电国家研究中心主任基金等的资助。
相关论文信息:
https://doi.org/10.1016/j.celrep.2021.108709
https://wap.sciencenet.cn/blog-3423233-1271700.html
上一篇:背靠背!邵振华/于晓/张磊/杜洋/孙金鹏课题组合作揭示多巴胺受体DRD1识别不同类型配体机制
下一篇:《自然》重磅!跨越百万年,科学家首次从猛犸象DNA中获得基因组信息