博文
厦门大学林友辉等: 仿生铜MOF纳米酶的理性设计和活性调控用于减轻化学性角膜烧伤
 精选
精选
|
化学性眼烧伤的主要特征之一是促进高水平的活性氧(ROS)产生,超过自身的抗氧化能力,最终诱发细胞死亡和炎症,严重导致失明。传统药物治疗策略因为成本高、毒性大、效率低的缺点使其在治疗角膜氧化性疾病方面受到严重限制。在本工作中,厦门大学物理科学与技术学院林友辉教授联合厦门大学医学院刘祖国教授和李程教授提出了一个简单而有效的方法,在MOFs中制造优秀的铜活性中心,以高效的缓解化学性角膜烧伤。具体来说,通过铜离子、卤素离子和4,4'-联吡啶的简单自组装,构建了一系列具有不同卤素配位铜节点的MOFs(Cu-X MOFs,X = Cl, Br, I)纳米酶。通过精确调整卤素原子的配位,具有最佳酶类活性的Cu-Cl MOF可以高效的将ROS分解为H₂O和O₂。密度泛函理论(DFT)计算揭示了Cu-X MOFs类超氧化物歧化酶(SOD)活性来源以及卤素对其活性的调节机制。同时,Cu-Cl MOF在体外角膜上皮(HCE)细胞中通过调节NRF2和JNK或P38 MAPK通路表现出明显的抗氧化和抗凋亡功能。此外,在化学性角膜烧伤的动物模型中,用Cu-Cl MOF处理的病理性角膜损伤得到有效缓解且其对眼球表面是安全的。
A Rational Design of Metal–Organic Framework Nanozyme with High-Performance Copper Active Centers for Alleviating Chemical Corneal Burns
Yonghua Tang, Yi Han, Jiachen Zhao, Yufei Lv, Chaoyu Fan, Lan Zheng, Zhisen Zhang, Zuguo Liu*, Cheng Li*, Youhui Lin*
Nano-Micro Letters (2023)15: 112
本文亮点
1. 受具有明确配位结构的金属酶启发,成功构建了一系列具有可调控铜活性中心的Cu-X MOFs纳米酶。
2. 实验和理论结果有力地支持了精确调整卤素原子配位可以通过影响空间构型和电子结构直接调节Cu-X MOFs的类酶活性。
3. 具有最佳类酶活性的Cu-Cl MOF可以通过抗氧化和抗凋亡机制有效缓解眼部化学灼伤。
内容简介
化学性角膜烧伤的显著特征之一是诱发高水平ROS的生成,超过自身抗氧化能力最终引发细胞死亡和炎症。传统的治疗策略成本高、毒性大、效率低而在治疗角膜氧化性疾病上受到限制。厦门大学林友辉教授/李程教授等人提出一种简单而有效的方法设计合成了一系列含有卤素配位铜节点的MOFs (Cu-X MOFs, X=Cl, Br, I)并且阐明了它们的构效关系。实验和理论结果表明,配位的卤素原子通过影响Cu活性中心的空间构型和电子结构能够直接调节Cu-X MOFs的类酶活性。最优Cu-Cl MOF表现出良好的类超氧化物歧化酶活性,在体外角膜上皮(HCE)细胞抗氧化实验中,可显著清除活性氧,减轻细胞的氧化应激。同时在动物模型中能够高效缓解化学性角膜烧伤。机制上,Cu-Cl MOF的抗氧化和抗凋亡特性是通过调节NRF2和JNK或P38 MAPK通路实现的。此外,将Cu-Cl MOF以眼药水的形式证明了其在眼部的安全性。该工作为直接调控MOF基纳米酶的活性提供了一种新思路,扩展了其在治疗眼科疾病中的应用。
图文导读
I Cu-X MOFs纳米酶结构-性能关系的建立
从图1a-c中可以看出,Cu-Cl MOF、Cu-Br MOF和Cu-I MOF中,铜原子所在平面与4,4′-联吡啶所在平面之间的二面角分别为16.32°、15.52°和14.41°。同时通过Bader电荷分析,随着原子序数的增加,卤素原子得电子的能力降低。由图1d可知,Cu-X MOFs在费米能级附近的态密度主要由Cu的3d轨道贡献,这意味着Cu更有可能成为底物分子的吸附位点。此外,不同卤素配位的Cu-X MOFs具有不同的d带中心。图2e-g所示,•OOH(超氧化物歧化酶底物分子)在Cu-X MOFs表面上具有非常相似的吸附构型。通过•OOH吸附前后的态密度图(图2h-j)可以看出,•OOH中H s和Cu-X MOFs中X的p轨道吸附以后都发生了明显的变化。根据图2k对•OOH在Cu-X MOFs表面的演化过程计算,Cu-X MOFs催化反应的决速步的能垒分别为0.52(Cu-Cl MOF)、0.59(Cu-Br MOF)和0.63 eV(Cu-I MOF)。因此,从而预测Cu-X MOFs类SOD活性顺序为Cu-Cl MOF>Cu-Br MOF>Cu-I MOF。以上证明卤素原子通过影响Cu活性中心的空间构型和电子结构能够直接调节Cu-X MOFs的类酶活性。

图1. a-c Cu-X MOFs中铜原子平面与4,4'-联吡啶平面之间的二面角以及相应的二维Bader电荷图;d Cu-X MOFs中Cu 3d轨道;e-g •OOH吸附在Cu-X MOFs表面的三维电荷密度差分图以及h-j相应的X p和H s轨道;k Cu-X MOFs表面•OOH的演化路径。(单位:eV)。
II Cu-X MOFs纳米酶的合成与结构表征
透射电子显微镜(TEM)图像显示,Cu-X MOFs是一种形态均匀的二维纳米片状(图2a-f)。XRD图显示,合成的样品具有与模拟的Cu-X MOFs类似的特征峰(图3k)。此外,通过XPS分析了Cu-X MOFs元素的表面组成(图3g-j)。如图3g-i所示,高分辨率XPS光谱中Cl 2p、Br 3d和I 3d的非常尖锐的特征峰意味着Cu-X MOFs表面存在大量的Cl、Br和I。一般来说,某个元素失去电子会使其结合能向高场方向移动。图3j中Cu 2p的高分辨XPS表明,不同卤素配位的Cu 2p结合能的大小顺序是Cu-Cl MOF > Cu-Br MOF > Cu-I MOF,这与DFT计算Cu失去电子数的趋势一致。这些结果表明,成功地构建了具有不同卤素配位的Cu-X MOF的节点。
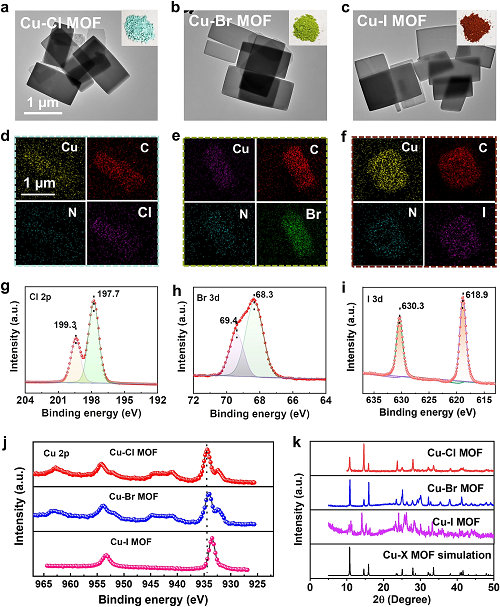
图2. a-c Cu-X MOFs TEM图像。插图:粉末样品照片和d-f对应的EDS;g-j XPS谱;g Cl 2p; h Br 3d; i I 3d; j Cu 2p。h Cu-X MOFs的XRD。
III Cu-X MOFs纳米酶类SOD和CAT活性
采用碘硝基氯化四氮唑蓝作为探针验证Cu-X MOFs纳米酶类SOD活性。如图3b所示,碘硝基氯化四氮唑蓝被•O₂⁻还原,在505 nm处有明显的吸收峰,当Cu-X MOFs存在时,•O₂⁻被Cu-X MOFs分解,抑制了•O₂⁻对碘硝基氯化四氮唑蓝的还原。因此,Cu-X MOFs类SOD活性的强弱顺序为Cu-Cl MOF> Cu-Br MOF> Cu-I MOF,与计算预测的结果一致。为了进一步探索Cu-X MOFs纳米酶在抗氧化方面的应用,测试了Cu-X MOFs去除其它ROS的能力,如H₂O₂和•OH(图3e-h)。Cu-Cl MOF在去除H₂O₂和•OH方面优于Cu-Br MOF和Cu-I MOF。
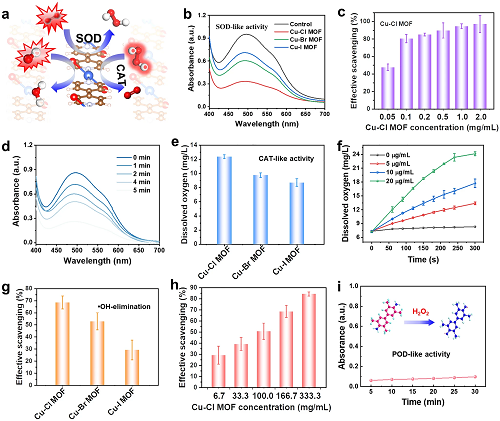
图3. a Cu-X MOFs类SOD和CAT活性示意图;b •O₂⁻/Cu-X MOF体系加入碘硝基氯化四氮唑蓝后的吸收光谱;c不同质量Cu-Cl MOF对•O₂⁻的去除率;d •O₂⁻/Cu-X MOF反应不同时间后加入碘硝基氯化四氮唑蓝的吸收光谱;e Cu-Cl MOF类CAT活性;f Cu-Cl MOF催化不同浓度H₂O₂产氧动力学曲线;g Cu-X MOFs消除•OH的活性;h不同浓度Cu-Cl MOF对•OH的去除活性;i Cu-Cl MOF的类过氧化物酶活性。
IV Cu-Cl MOF的体外细胞毒性和ROS清除活性
通过HCE细胞中的CCK-8测定法测试Cu-Cl MOF纳米酶的生物相容性。如图 5a所示,Cu-Cl MOF对 HCE 细胞没有显著的细胞毒性。同时,利用HCE细胞建立过氧化氢氧化应激模型,通过CCK-8测定法、DCFH-DA探针及流式细胞法进一步探讨了Cu-Cl MOF保护细胞免受氧化应激损伤的作用。结果表明Cu-Cl MOF有效地降低了ROS水平。总之,Cu-Cl MOF 清除了HCE细胞中的ROS,并保护细胞免受氧化应激损伤。

图4. a通过 CCK-8 测定,HCE细胞在 6、12和24小时内与不同浓度的Cu-Cl MOF共孵育的细胞活力;b使用200 μM H₂O₂和不同浓度的Cu-Cl MOF孵育的HCE细胞的细胞活力;c、d通过 DCFH-DA 染色检测细胞内 ROS 的荧光强度和代表性荧光图像的定量统计;e通过 DCFH-DA 染色对HCE细胞中ROS水平进行流式细胞术检测。
V Cu-Cl MOF 的潜在抗氧化和抗细胞凋亡机制
为了进一步研究Cu-Cl MOF抑制HCE细胞氧化应激的潜在机制,我们检测了NRF2蛋白的水平。结果表明,与H₂O₂刺激组相比,Cu-Cl MOF上调了NFR2的表达。NRF2的核染色通过用Cu-Cl MOF处理得到增强,这激活了NAD(P)H:奎宁氧化还原酶 1 (NQO1) 和过氧化氢酶的表达。因此,Cu-Cl MOF可能激活NRF2通路以平衡HCE细胞中的生物氧化还原。
此外,研究了HCE细胞的凋亡过程,以深入了解Cu-Cl MOF的抗氧化作用。过氧化氢诱导HCE细胞凋亡,而Cu-Cl MOF 通过上调抗凋亡蛋白BCL-2的水平并抑制凋亡标记半胱天冬酶3抵消了凋亡过程。Cu-Cl MOF处理后JNK和 P38(活性形式)的磷酸化水平显着下调,这表明Cu-Cl MOF通过降低JNK和 p38的活化来抑制细胞凋亡MAPK。
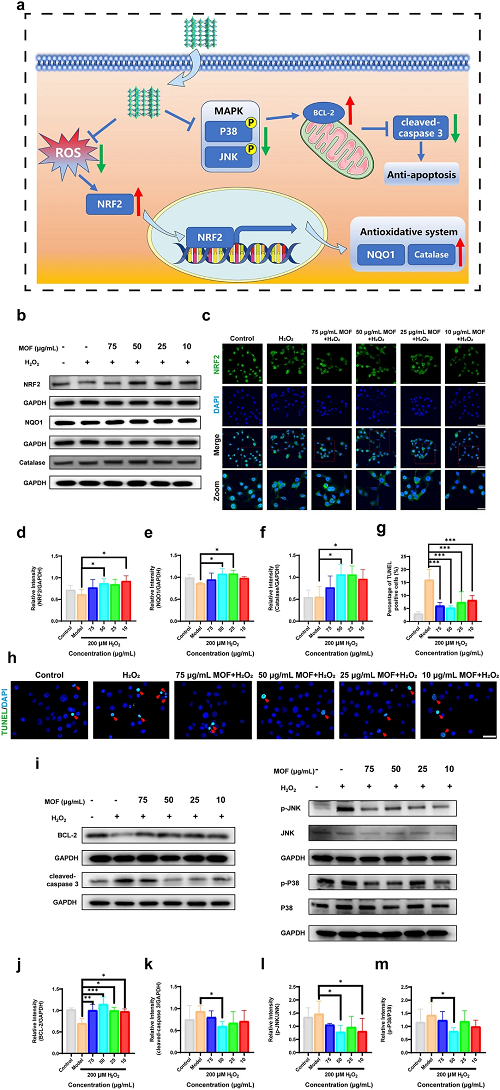
图5. a Cu-Cl MOF的抗氧化和抗细胞凋亡机制示意图;b使用GAPDH作为上样对照,通过蛋白质印迹法测定HCE细胞中NRF2、NQO1 和过氧化氢酶的蛋白质水平;c通过NRF2免疫荧光染色,用200 μM H₂O₂和不同浓度的Cu-Cl MOF孵育的HCE细胞的代表性荧光图像,比例尺:100 μm(缩放指示 NRF2 位置,缩放比例尺:50 μm);d - f NRF2、NQO1和过氧化氢酶蛋白的定量统计;g, h TUNEL 阳性细胞的定量统计和HCE细胞中TUNEL染色的代表性荧光图像,比例尺:50 μm。i通过蛋白质印迹法测定HCE细胞中BCL-2、裂解半胱天冬酶 3、p-JNK、p-P38、JNK和P38 的蛋白质水平,GAPDH 用作上样对照;j - m BCL-2 蛋白、cleaved-caspase 3 以及 p-JNK 与 JNK 和 p-P38 与 P38 之比的定量统计。
VI Cu-Cl MOF 减轻碱烧伤动物模型中的角膜损伤
为了进一步评估Cu-Cl MOF在治疗眼部化学性眼灼伤方面的潜力,在C57BL/6小鼠中使用氢氧化钠建立了角膜灼伤模型Cu-Cl MOF滴眼液的给药加速了角膜上皮的愈合。如图 6c所示,碱破坏了角膜上皮,募集白细胞(在IVCM中具有高反射)浸润中央或周边角膜基质,导致结构紊乱。根据临床评分,Cu-Cl MOF有效地减少了角膜混浊的进展,证明了对角膜炎症的极好抑制(图 6d)。由于Cu-Cl MOF在早期清除有害的自由基,因此有助于恢复角膜透明度。另外,角膜水肿会增加角膜厚度,通过观察角膜厚度可以判断角膜碱烧伤的严重程度。如图 6e所示,与对照组相比,Cu-Cl MOF 滴眼液显着控制了角膜厚度并避免了角膜水肿。Cu-Cl MOF滴眼液给药可保护角膜上皮和基质,使角膜基质细胞保持静止。
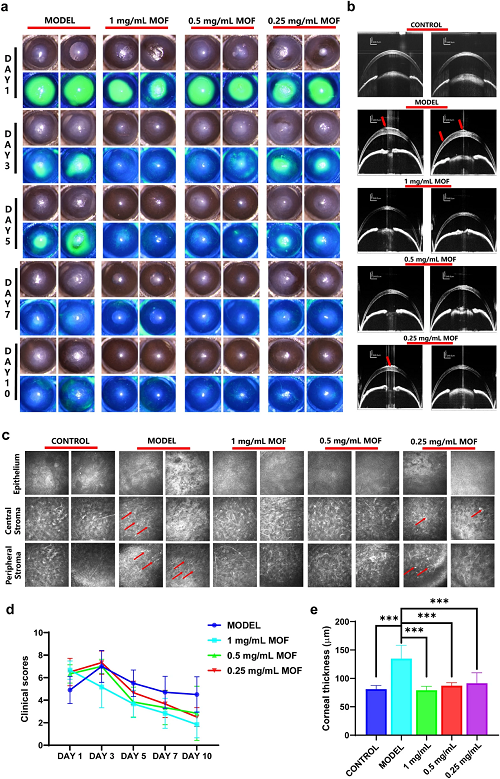
图6. a在第 1、3、5、7 和 10 天碱烧伤后用不同浓度的Cu-Cl MOF处理的眼表的宽光束照明和荧光素染色图像;b 眼表前段的代表性 OCT 图像(红色箭头表示角膜上皮缺损或不规则);c角膜上皮、中央和周围角膜基质的体内共聚焦显微镜图像(红色箭头表示白细胞浸润);d根据裂隙灯图像对小鼠角膜进行临床评分;e OCT测量和分析角膜厚度的定量统计。
VII Cu-Cl MOF 减少碱烧伤后的角膜炎症和纤维化
为进行组织学分析以阐明角膜碱烧伤治疗中的详细病理过程。H&E染色(图 7a)显示Cu-Cl MOF有利于更新被碱烧伤角膜的典型结构。进行Masson染色以确定胶原排列,在应用Cu-Cl MOF 滴眼液后,角膜结构恢复到稳定且完整的层状结构(图7b)。因此,MOF 减少了氧化应激炎症,并进一步阻碍了细胞重建不规则愈合的角膜。
在本研究中EMR1旨在指示巨噬细胞的位置和数量。由于碱烧伤引起的严重巨噬细胞浸润,在模型组的角膜基质内可以发现许多EMR1标记的细胞(图 7c)。而Cu-Cl MOF滴眼液有效减少了角膜中的巨噬细胞。α-平滑肌肌动蛋白 (α-SMA) 反映了肌成纤维细胞水平以及组织中的纤维化和疤痕。Cu-Cl MOF滴眼液减轻了α-SMA染色强度(图 7c),表明通过 Cu-Cl MOF 滴眼液具有控制角膜纤维化和疤痕形成的能力,这有助于恢复角膜的透明度。最后,检测了纤维化相关基因α-SMA和纤连蛋白的表达,并在α-SMA免疫荧光染色中发现了相同的趋势(图7d)。除了炎性细胞因子的表达外,通过qPCR系统检测IL-1β,发现Cu-Cl MOF在抗炎症中降低了角膜IL-1β的表达(图 7f)。因此,Cu-Cl MOF 可减轻碱烧伤引起的炎症和纤维化,对减少角膜损伤具有重要意义。
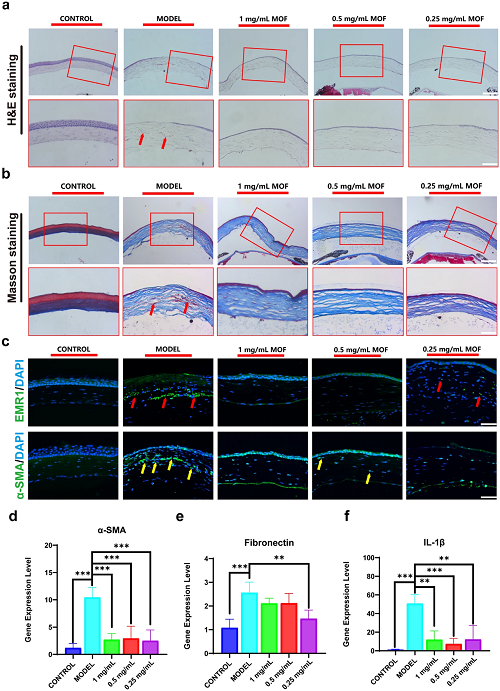
图7. a H&E 染色显示角膜的中央结构,比例尺:100 μm(红色矩形放大角膜,红色箭头表示炎症细胞,缩放比例尺:50 μm);b Masson 染色显示角膜的胶原蛋白排列,比例尺:100 μm(红色矩形放大角膜,红色箭头表示结构紊乱的区域,缩放比例尺:50 μm);c EMR1 染色显示巨噬细胞的位置和数量(红色箭头),α-SMA 染色显示纤维化和瘢痕形成的区域(黄色箭头),比例尺:50 μm。d α-SMA、纤连蛋白和 IL-1β 基因表达水平的定量统计。
作者简介

刘祖国
本文通讯作者
厦门大学 教授
▍主要研究领域
角膜与眼表疾病。
▍Email:zuguoliu@xmu.edu.cn

李程
本文通讯作者
厦门大学 教授
▍主要研究领域
角膜和眼表面疾病,包括眼部干细胞的基础研究,角膜组织工程,环境污染物损伤眼表机制研究。
▍Email:cheng-li@xmu.edu.cn