博文
Cell重磅发布!磷酸化修饰组学揭示COVID-19介导的心脏损害
|
SARS-CoV-2感染常导致心脏损伤和功能障碍,并导致已有心血管疾病患者的死亡率更高。患者的心脏后遗症包括急性冠状动脉综合征、心肌病、急性肺源性心脏病、心律失常和心力衰竭,此外,68%-78%的患者出现持续性心功能不全。其病因尚不清楚,并且目前缺乏针对性的治疗策略,尤其是在COVID-19等严重感染的患者中。
现有研究报道了SARS-CoV-2感染导致的免疫抑制和炎症反应。如4D蛋白质组学对新冠肺炎病毒患者的肺组织石蜡切片进行分析发现,患者的死亡可能是由于宿主严重的炎症反应所致,而不是病毒感染直接引起 [1] 。北京大学医学部精准医疗多组学研究中心黄超兰教授团队、中国科学院高福院士团队研究发现早期的新冠感染患者存在着显著的免疫抑制,可能进一步导致细胞因子风暴和器官损伤的发生 [2] 。众所周知,炎性介质如肿瘤坏死因子(TNF)可引起收缩功能障碍。因此严重的炎症可能在心脏损伤和功能障碍中起关键作用。
2021年3月,Cell上发表了题为“BET Inhibition Blocks Inflammation-Induced Cardiac Dysfunction and SARS-CoV-2 Infection”的最新文章,研究人员利用磷酸化蛋白质组学技术,结合单核RNA测序(snRNA-Seq),最终确定了诱导心脏舒张功能障碍的炎性 “细胞因子风暴”(CS),即干扰素γ(IFN-γ),白细胞介素1β(IL-1β)和聚 (I:C)的联合作用。研究同时发现,BET抑制剂(BETi)可降低COVID-19受体(ACE2)表达,恢复心脏类器官的功能障碍。包括FDA指定药物Apabetalone在内的BETi有望成为预防COVID-19介导的心脏损害的候选药物。

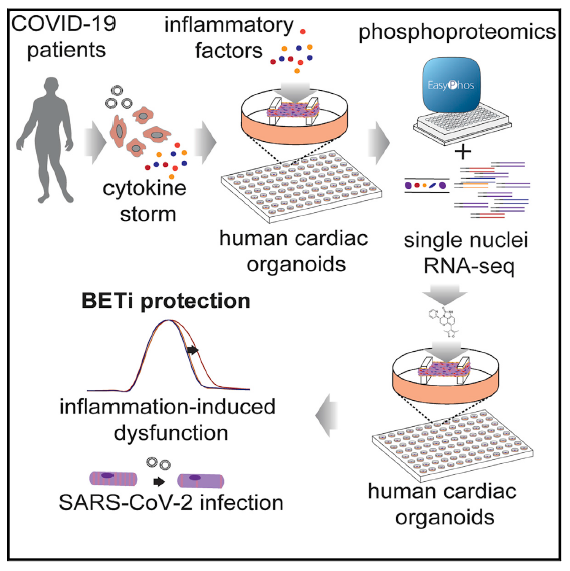
Graphical abstract
1、鉴定诱导心功能障碍的细胞因子
研究人员首先利用人类多能干细胞(hPSC)衍生出的心脏类器官(hCOs)模型,研究了COVID-19患者体内一系列促炎细胞因子升高对hCOs的影响。用于测试的炎症分子包括:肿瘤坏死因子(TNF),白细胞介素1β(IL-1β), 干扰素-γ(IFN-γ), 白细胞介素6(IL-6)、IL-17A(白细胞介素17A)和G-CSF(粒细胞集落刺激因子),以及病原体相关的分子模式,包括模拟双链RNA(dsRNA)的聚(I:C)和模拟TLR4激活和脓毒症反应的脂多糖(LPS)。结果显示,在hCOs中,IFN-γ、IL-1β和聚(I:C)联合诱导可以引起严重的舒张功能障碍。
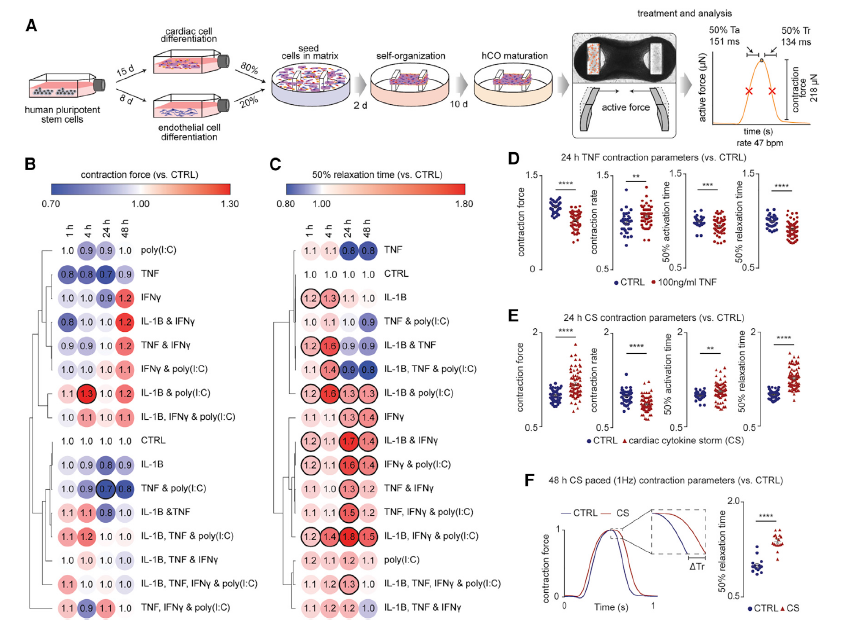
图 鉴定驱动心功能障碍的促炎因子
2、磷酸化蛋白质组学技术研究CS诱导心功能障碍的机制
研究人员通过利用磷酸化蛋白质组学技术测量了hCOs样本,重点研究了由细胞因子风暴(cytokine storm,CS)引起的舒张功能障碍,并利用snRNA-Seq技术验证了磷酸化蛋白质组学的数据。单次鉴定到位于大约3000种不同的磷蛋白上的7927个磷酸化位点。91个磷酸化位点在CS处理后显著上调,其中35个位点位于转录因子或染色质结合蛋白上,13个位点与细胞增殖相关蛋白上。根据磷酸化修饰组学结果,研究人员选择STAT1(S727)及BRD4(S469)和(S1083)为重点研究对象,因为这两种靶标或其上游调节剂均具有特定的小分子抑制剂。研究结果共同揭示了心脏多个细胞群体中的都有发生强大的病毒应激反应,研究人员推测是通过STAT1和BRD4的表观遗传激活介导的。
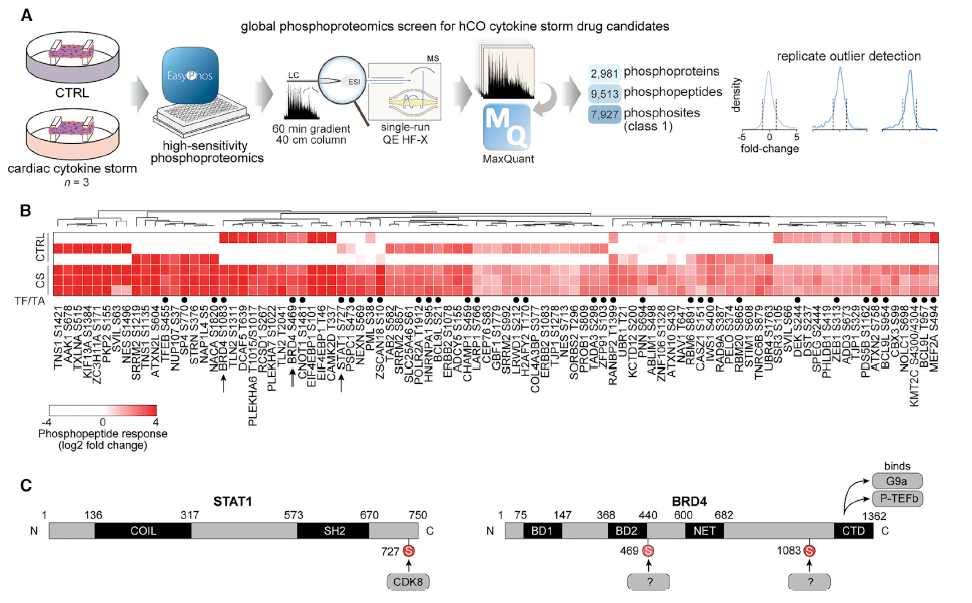
图 磷酸蛋白质组学揭示驱动心功能障碍的信号
3、筛选能预防和治疗心脏功能障碍的药物
接下来,研究人员筛选了可能治疗由肿瘤坏死因子(TNF)诱导的收缩功能障碍或CS驱动的舒张功能障碍引起的心功能障碍的药物。结果显示,Baricitinib(与AP2相关的蛋白激酶1介导的内吞作用抑制剂)可以预防hCOs中TNF诱导的收缩功能障碍。另一方面,CS条件下舒张功能障碍的一个关键特征是转录调节子的磷酸化水平升高。CS处理的hCOs磷酸蛋白质组中观察到表观遗传调节剂BRD4和其他表观遗传调节剂的磷酸化水平升高,这与snRNA-Seq分析结果一致。
然后研究人员评估了FDA化合物库中的三种BETi,发现INCB054329以剂量依赖的方式预防了CS引起的舒张功能障碍,并且在CS条件24小时后挽救了功能异常的hCO,并恢复了舒张功能。研究人员猜测,CS诱导的舒张功能障碍是可逆的,是由炎症因子存在驱动的。综上表明CS通过BRD4依赖的机制介导舒张功能障碍,BETi可阻断该机制。进一步研究发现,BETi可以降低ACE2表达,减少SARS-CoV2感染。
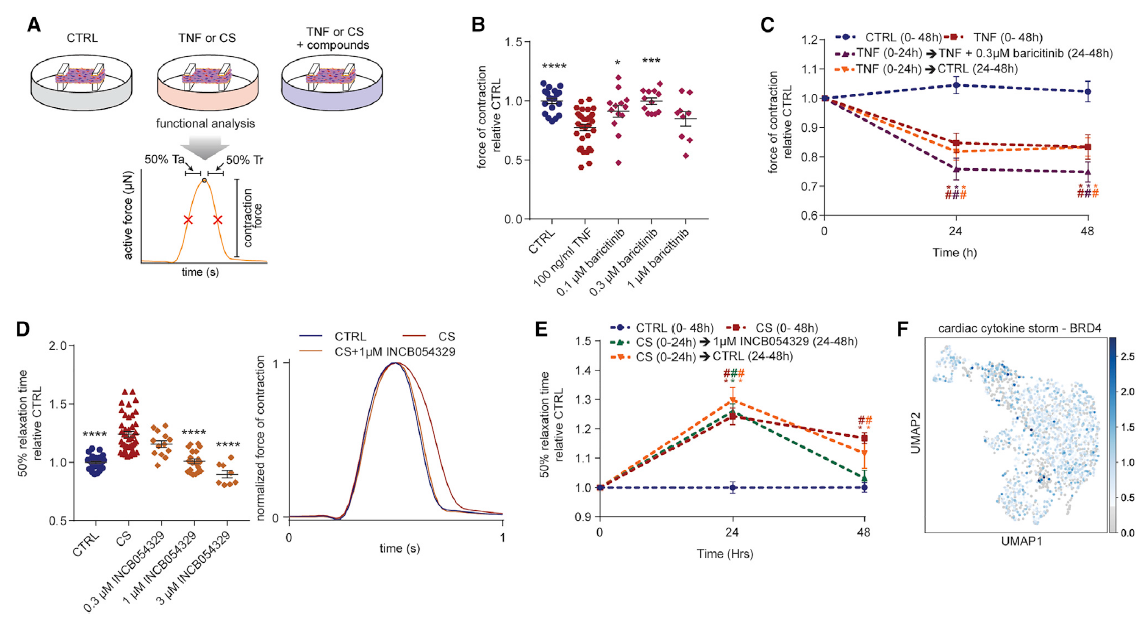
图 筛选能改善心脏功能障碍的药物
总结
本研究基于多能干细胞来源的心脏类器官,通过磷酸化蛋白质组学和单核RNA测序(snRNA-Seq)确立了BETi作为一种可行的治疗策略,可以减轻由IFN-γ、IL-1β和聚(I:C)通过BRD4依赖的机制介导的心脏功能障碍。此外,BETi可以降低病毒应答中的基因转录,从而降低ACE2的表达,减少SARS-CoV-2心肌细胞的感染。BD2选择性BETi药物是预防COVID-19心脏损伤的快速临床转化的领先候选药物。
参考文献:
[1] Meng Wu, et al., 2020. Transcriptional and proteomic insights into the host response in fatal COVID-19 cases. Proc Natl Acad Sci U S A.
[2] Wenmin Tian, et al., 2020. Immune suppression in the early stage of COVID-19 disease. Nature Communications.
[3] Mills R J, et al., 2021. BET inhibition blocks inflammation-induced cardiac dysfunction and SARS-CoV-2 infection. Cell.
https://wap.sciencenet.cn/blog-3404471-1289362.html
上一篇:【热点跟踪】20+分Nature子刊三连发,PWAS技术再揭抑郁症新靶标
下一篇:Cell Reports|蛋白质组学揭示HDAC抑制剂的全局性调控机制