博文
2019文献阅读大赛 | 整合组学分析揭示丙型肝炎病毒侵染的信号通路变化
|
“蛋白组学·2019”线上文献阅读大赛开赛以来,陆续收到了很多参赛作品。经过评审团队精心的审阅、筛选,优秀参赛作品将陆续在“精准医学与蛋白组学”学术平台发布。
此次活动由蛋白组学、修饰组学的领军企业——景杰生物独家支持,更多精彩活动,期待你的参与~~~

参赛者:刘*昕 (东北林业大学)
参赛作品:整合组学分析揭示丙型肝炎病毒侵染的信号通路变化
文献标题:Combined Analysis of Metabolomes, Proteomes, and Transcriptomes of Hepatitis C Virus–Infected Cells and Liver to Identify Pathways Associated With Disease Development
发表期刊:Gastroenterology(IF = 19.233 )
发表时间:2019.08
丙型肝炎病毒(hepatitis C virus,HCV)导致肝脏的急性和慢性感染,这是导致肝脏疾病从慢性炎症和代谢性疾病发展为纤维化、肝硬化,最终发展为肝细胞癌(HCC)的主要原因。然而目前,对丙型肝炎病毒的感染、肝病的恶化、肝癌的形成了解不够完全。
2019年8月,国际专业学术期刊Gastroenterology(IF = 19.233 )发表了题为Combined Analysis of Metabolomes, Proteomes, and Transcriptomes of Hepatitis C Virus–Infected Cells and Liver to Identify Pathways Associated With Disease Development的研究论文。法国斯特拉斯堡大学的研究者以HCV感染为模型,评估了导致慢性炎性疾病和病毒诱导癌症的细胞内环境稳态的扰动。通过将目前最先进的丙肝病毒感染模型与包括蛋白质组学、RNA-seq、代谢组学和数学建模在内的前沿筛选技术相结合,从系统层面深入了解病毒-宿主相互作用及其对肝脏疾病生物学的影响。这种方法揭示了丙型肝炎病毒如何逃避先天免疫反应,重组宿主细胞代谢,并引发慢性炎症和代谢性疾病和癌症。
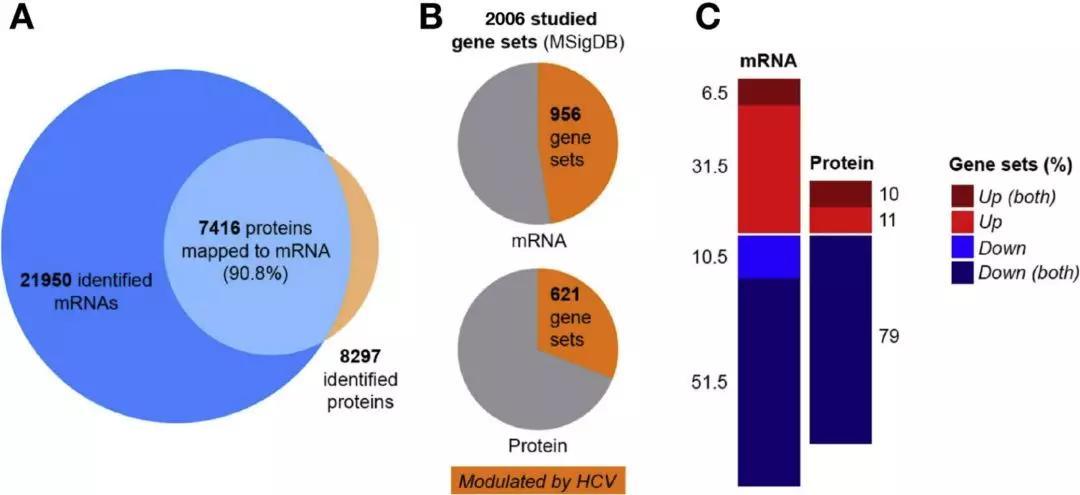
作者使用类肝细胞培养模型组成的DMSO分化的 Huh7来源的肝细胞(Huh7.5.1dif)作为实验材料,对被HCV感染后的第0-10天进行转录组研究、对第0、1、3、7、10天进行了蛋白组研究,对感染后第十天取样进行了代谢组的研究(图1A)。研究总共定量到了21,950个mRNA和8297个蛋白质(图2A),并且发现在HCV感染后的第3天、第7天,HCV蛋白发生富集(图1C)。
图1、利用蛋白基因组学研究HCV蛋白的表达
随后作者分析了代表特定宿主通路、细胞功能的2006个基因组,发现这些基因组在感染后7天内,HCV显著改变了47.4%(956个基因组、转录组数据组)和31%(621个基因组、蛋白组数据组)(图2B)。这些基因集大部分普遍下调。此外,这些RNA水平下调的基因组中,有83%的蛋白水平也明显受损。相比之下,只有17%的RNA水平的上调途径与相应的蛋白趋势相匹配(图2C)。这表明,HCV感染关闭了转录和/或转录后水平上的大多数非生命过程,将资源转向病毒复制和持久性。
图2、持续的HCV感染影响宿主通路,并引起先天免疫应答减弱
从HCV感染的蛋白基因组图谱中可以明显观察到,GSEA在RNA和蛋白水平上提示,HCV感染的过氧化物酶体功能严重受损(图3A)。过氧化物酶体参与脂质合成、信号传导、VLCFAs的β氧化和过氧化氢的解毒。因此,可以观察到过氧化物酶体生物发生、胆汁酸代谢、脂肪酸代谢和胆固醇生物合成相关基因表达受损(图3A)。11个前缘基因在HCV感染的肝细胞和HCV感染患者肝脏中的表达发生了显著变化 (图3B),过氧化氢酶在感染细胞中的表达受损(图3C),这是一种过氧化物酶特异性酶。过氧化氢酶染色过氧化物酶体的定量显示,与未感染肝细胞相比,HCV感染细胞中形成的过氧化氢酶斑点数量明显减少,表明这些细胞器的代谢功能受损,并在感染细胞中积累脂肪酸(图3C)。值得一提的是,与HCV损害过氧化物酶体基因表达相比,持续性乙型肝炎病毒(HBV)感染增加了过氧化物酶体功能及其相关的代谢过程(图3D)。
图3、HCV感染会损害过氧化物酶体基因在肝细胞和患者肝脏组织中的表达
此外,作者还发现肝细胞的HCV感染增加了链长为20-26个碳的VLCFAs的胞内浓度,而较短的脂肪酸(C16-C18)积累较少(图4A)。HCV感染肝细胞中葡萄糖代谢物琥珀酸、丙酮酸、3磷酸甘油酸和柠檬酸的浓度升高(图4),这与HCV复制的高葡萄糖依赖性一致。实际上,作者的分析显示了葡萄糖消耗的增加(图4C),乳酸盐的积累,和苹果酸盐的减少,证明了在感染细胞中糖异生作用受损(图4B)。在健康的个体中,乳酸由糖酵解依赖组织产生和分泌,包括骨骼肌、骨髓和缺氧组织。当测量肝细胞内乳酸通量时,观察到一个显著的细胞内积聚(图4D)。总的来说,这些数据表明,持续的HCV感染会导致受感染细胞的葡萄糖水平升高,从而导致过氧化物酶体功能受损。此外,感染会导致宿主代谢发生Warburg样的变化,这是癌症或细胞发生癌变的标志。
图4、持续的HCV感染增强了细胞内VLCFAs和葡萄糖的代谢,并造成乳酸通量的warburg样转移
过氧化物酶体增殖激活受体α(PPAR-α) 是HCV敏感的调节因子。作者观察到HCV感染强烈抑制了肝细胞中PPAR-α的表达(图5A)。作者通过数据分析发现,IL6/信号激活剂和转录转换器的功能在HCV感染中调节过氧化物酶体功能的信号通路。事实上,感染会诱发STAT3转录信号,而STAT3的激活会导致IL-6R受体转录的快速抑制(图5B),这是负反馈调节的一部分。此外,抑制STAT3活性(图5C)挽救了病毒对过氧化物酶体基因的抑制(图5D),表明STAT3信号通路与过氧化物酶体之间存在调控联系。
图5、HCV通过STAT3信号通路抑制PPAR-α功能,抑制过氧化物酶体基因表达
综上所述,作者的数据表明HCV感染通过干扰PPAR-α的表达和功能,在不同程度上抑制过氧化物酶体功能。这影响到脂肪酸与糖代谢之间的转换,导致了受感染肝细胞的糖依赖和脂质积累,从而导致慢性肝病和肝细胞癌。这些发现为肝脏疾病的发病机制提供了新的见解,并可能用于确定新的治疗靶点。
https://wap.sciencenet.cn/blog-3404471-1213082.html
上一篇:Nat Commun:蛋白组学“大案牍术”揭示阻止禽流感病毒向人类传播的决定因素
下一篇:2019文献阅读大赛 | EGFR-ROCK联合抑制细胞保护性自噬,有望攻克三阴性乳腺癌