博文
Nat Commun:蛋白基因组学再下一城!系统揭示乳腺癌的全景画像
|
编者按:相对于转录组学,基于蛋白质的分类方法能够更准确的反应功能异质性及预测治疗反应。高通量蛋白质定量技术进步使人们在蛋白质水平上对胃癌、结肠癌、前列腺癌等肿瘤分子特征进行研究成为可能(相关研究案例可详见文末更多阅读)。今天介绍的文章近日发表在Nature Communications上,首次以高质量的蛋白质组学分析为基础,实现了对乳腺癌瘤进行多层次系统性检测,包括mRNA表达、基因拷贝数改变,单核苷酸多态性,磷蛋白水平和代谢物丰度等。
乳腺癌基于PAM50分为 Luminal A 型、Luminal B 型、HER‐2过表达型及基底样型(Basal‐like)、正常乳腺样型(Normol-like)五个亚型。尽管基于mRNA的分型方法在临床应用广泛,因为细胞功能和药物干预在很大程度上都是在蛋白质水平实现的,蛋白质-mRNA丰度相关性的差异导目前的分型方法存在某些缺点。
蛋白质组学和基因组技术的持续发展导致了蛋白基因组学的出现。蛋白质基因组学研究将在蛋白质水平观察到的畸变与基因组事件或特性,如突变、插入/缺失,替换和单核苷酸多态性相联系。这些分析可以识别以前被认为是基因组沉默区域和/或转化组织中特定表达可作为新抗原的蛋白质产物,成为有效的免疫疗法设计工具。
2019年4月8日,瑞典卡罗林斯卡学院挪威阿肯大学医院Henrik J. Johansson等人在国际著名学术期刊Nature Communications上发表论文。本研究对乳腺肿瘤的蛋白质组进行无偏分析,首次以高质量的蛋白质组为基础,实现了对乳腺癌瘤进行多层次系统性检测,包括mRNA表达、基因拷贝数改变,单核苷酸多态性,磷蛋白水平和代谢物丰度等。为难以分类的患者提供了分类及选择治疗方案的新型免疫组化候选生物标志物,将免疫细胞浸润和肿瘤细胞外基质成分与疾病预后联系起来,将分子分型与代谢表型联系起来。

作者发现预测乳腺癌分型的mRNA组别中的基因,其mRNA-蛋白相关性显著高于平均水平,并且基因拷贝数的变化在蛋白质水平上出现减弱,再次强调了蛋白质组定量对于预后和表型分类的价值。此外,蛋白质组分析的深度和质量促进了基因蛋白质组学的应用以及新抗原的发现,对应于非编码基因组区域的蛋白质产物的鉴定,可以作为了一类潜在的新的肿瘤特异性免疫治疗靶点。
1. 基于MS的乳腺肿瘤队列蛋白质组学定量研究
作者从OSLO2研究队列的5个PAM50亚型分别选取9名患者以确保肿瘤多样性。基于248949个特异性肽段,共鉴定到12645个基因编码的13997个蛋白产物(FDR=1%)(图1)。45个肿瘤样品中每个样品鉴定到9995个可定量蛋白质。
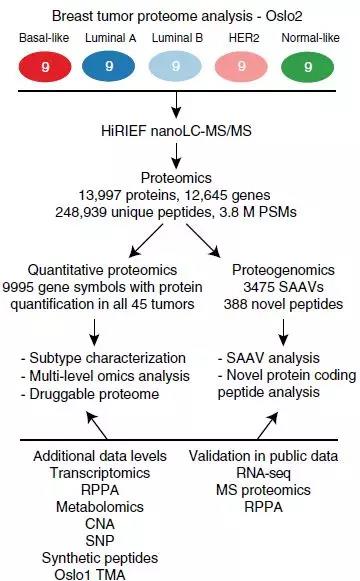
图1. 蛋白基因组学分析工作流程概述
PSM: 肽段匹配谱图,SAAV:单氨基酸变体,HiRIEF:高分辨率等电聚焦,RPPA:反相蛋白质芯片,CNA:基因拷贝数改变,SNP:单核苷酸多态性,TMA:组织芯片。
2. 肿瘤蛋白质组与代谢组的相关性分析
基于对蛋白质丰度变化明显的1334个蛋白的无监督聚类方法,将肿瘤进行重新分类得到6个核心肿瘤簇(CoTC)(图2c)。CoTC分类与PAM50分型中的normal-like和 luminal A亚型重叠,但是把PAM50分型中的basal-like亚型分为两群,并将HER2和一部分luminal B亚型整合在一起,此外,还单独包含PAM50分型中luminal B亚型的另一群(图2c,2d)。CoTC1和2对应PAM50分型中的normal-like亚型肿瘤,它们可利用相关免疫标记分子、E2F及MYC靶蛋白以及G 2M检验点相关的蛋白质进一步区分(图2e)。对应于luminal以及HER2亚型的 CoTC 3, 4以及6主要表现在不同程度的雌激素反应相关蛋白、E2F靶蛋白, G2M检验点蛋白以及MYC靶蛋白相关蛋白的富集。最后,代谢组学检测结果表明,CoTC6的成员表现出明显的糖酵解特征(图2f),这类肿瘤中的MKI67(细胞增殖marker)水平升高,与出现的沃伯格效应现象一致(图2g)。
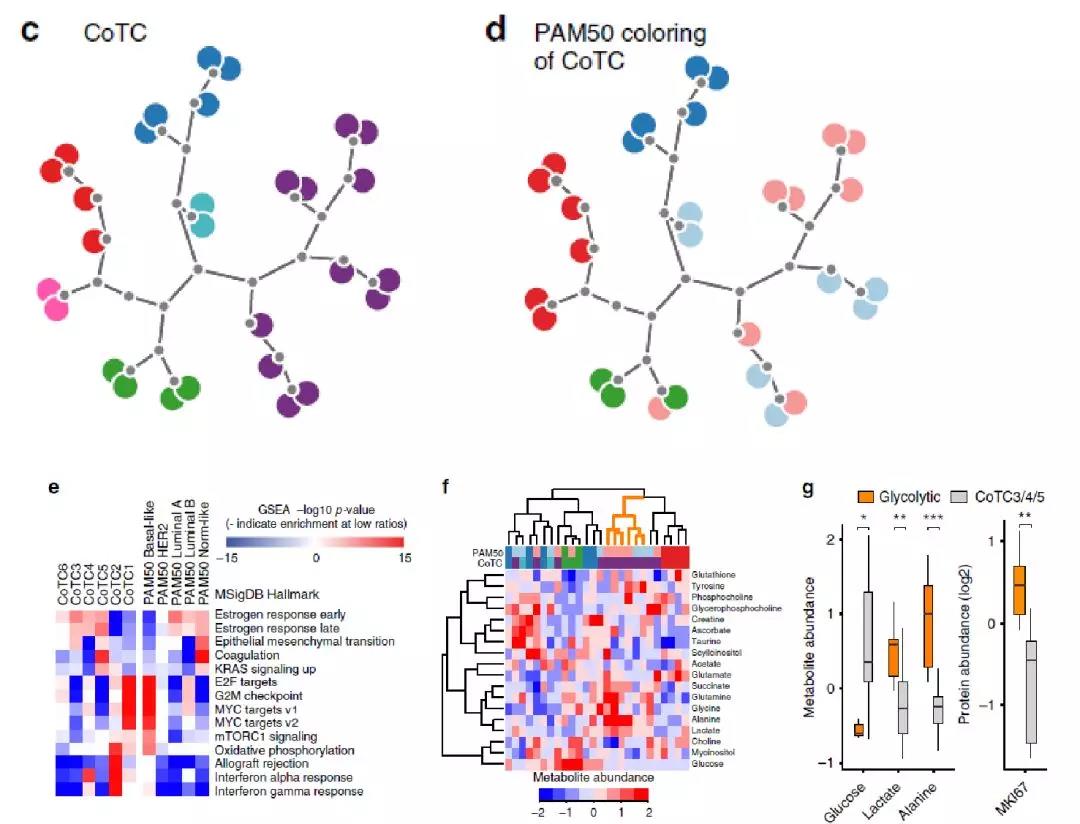
图2. PAM50亚型及代谢相关蛋白的聚类分析
3. RNA及蛋白质相关性分析
作者描述了mRNA转录与蛋白质丰度之间的关系,在Oslo2队列中,70%的蛋白及其mRNA转录本存在正相关和显著相关(图3a)。其中,作为BC分型的一部分转录本编码的蛋白质与mRNA具有显著相关性(图3b)。与癌症和乳腺癌发生相关的基因,其mRNA -蛋白表现出不同程度的相关性,提示有些蛋白质不能仅通过检测其mRNA的表达作为其替代检测手段(图3c)。高度增生型肿瘤(basal-like、HER2、luminal B和/或高MKI67)比低增殖型肿瘤(luminal A, normal-like)蛋白质组和转录组具有更高的相关性(图3d)。
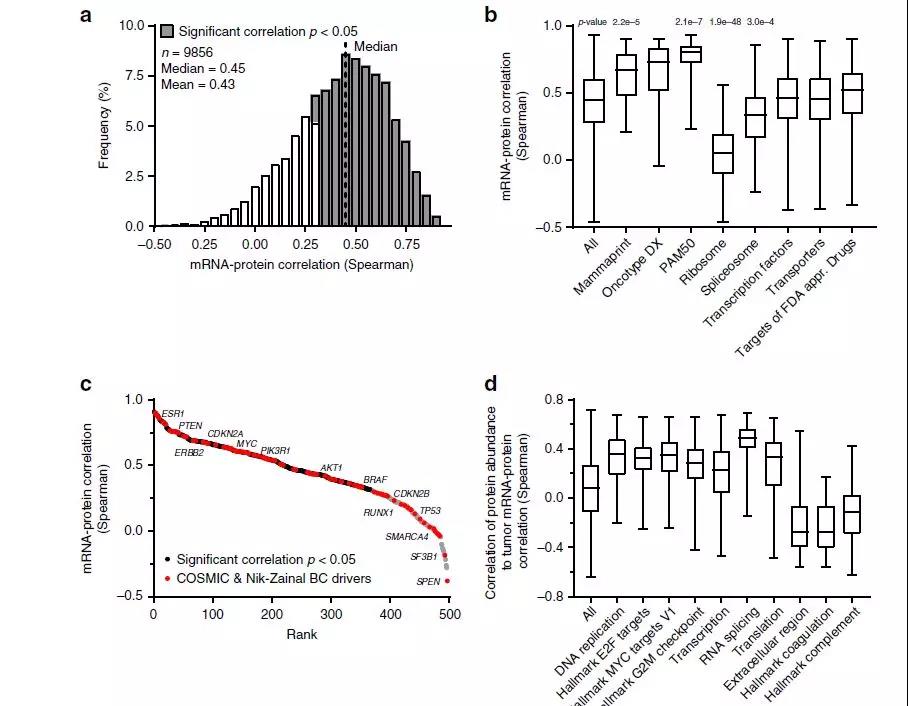
图3. RNA-蛋白质相关性分析
4. 蛋白质基因组学确定候选免疫治疗靶点
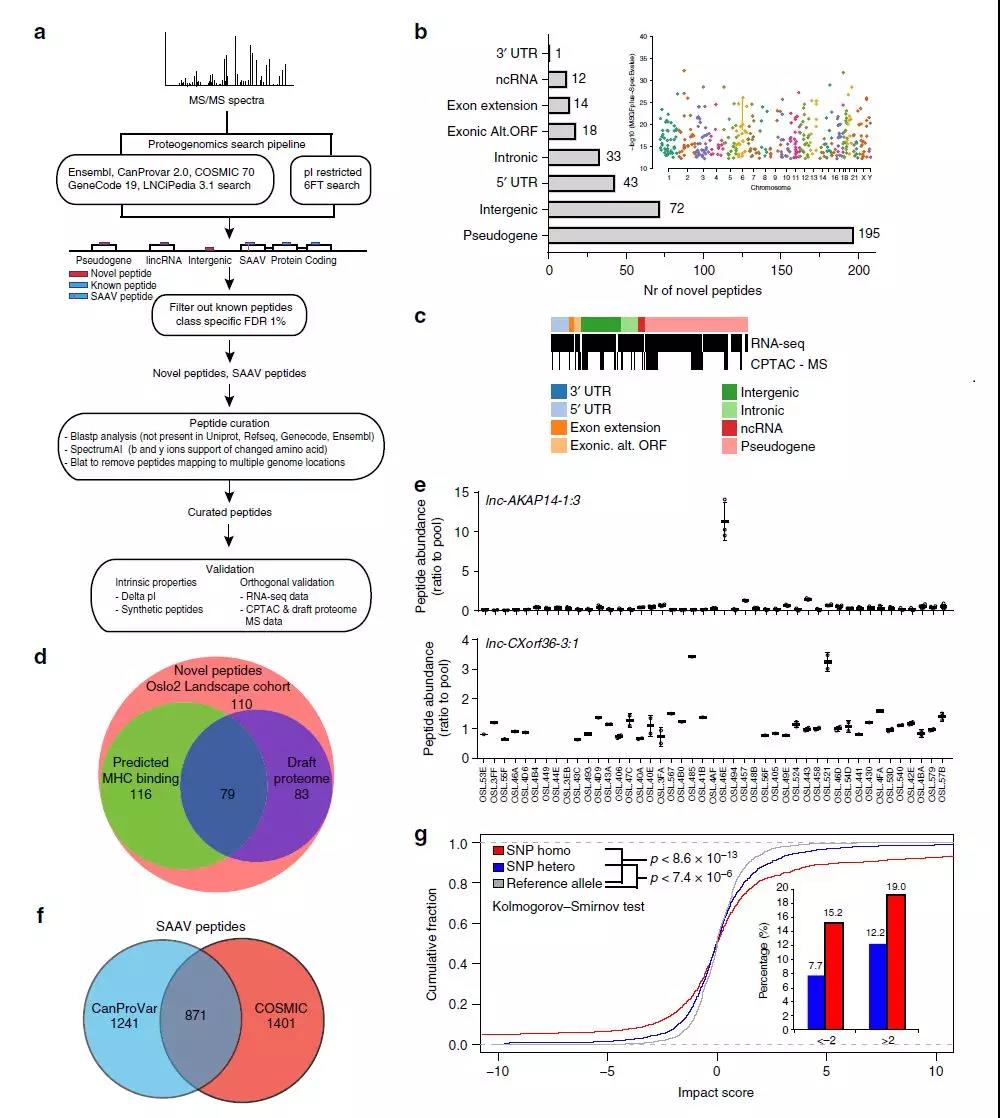
研究者应用最近开发的蛋白质基因组学分析工作流程对Oslo2队列进行深入分析。简而言之,在已知的多肽,SNPs,突变,以及来自于基因组非编码区的理论多肽数据库中对MS谱图进行搜索,将与已知肽段和多个基因组区域匹配的谱图与不符合SpectrumAI12严格验证标准的单个氨基酸变体(SAAVs)一起过滤掉(图4a)。在Oslo2队列中,最终鉴定到对应于基因组非编码区或内含子(假基因,非编码RNA),或对应于未注释的选择性基因翻译区(外显子扩展,3'和5′UTR,外显子选择性开放阅读框)的数百个多肽(图4 b)。
RNAseq以及蛋白质组学质谱检测结果证实,这些鉴定到的多肽很多在其它的乳腺肿瘤中都能够转录和翻译(图4c)。在鉴定的肽段中,有30%预测可以与MHC I类分子结合,在正常组织的MS数据中未识别到(图4d)。由lnc-AKAP14-1:3和lncCXorf36-3:1扩增得到的患者特异性候选免疫靶点,分别都对应于非编码区域,在一个肿瘤和两个肿瘤中表达量升高(图4 e)。这些肿瘤特异性蛋白可以作为靶向免疫治疗候选抗原。在Oslo2队列蛋白组中还鉴定到几千个SAAVs(图4f)。
本研究中,作者首次以高质量的蛋白质组为基础,实现了对乳腺癌瘤进行多层次系统性检测,包括mRNA表达、基因拷贝数改变,单核苷酸多态性,磷蛋白水平和代谢物丰度等。为难以分类的患者提供了分类及选择治疗方案的新型免疫组化候选生物标志物,将免疫细胞浸润和肿瘤细胞外基质成分与疾病预后联系起来,将分子分型与代谢表型联系起来。此外,利用蛋白质基因组学发现靶向免疫治疗的肿瘤新抗原,为乳腺癌研究者在其专业领域内探索和验证新理论提供了宝贵的资源。
更多了解:www.ptm-biolab.com
参考文献
Henrik J. Johansson, et al., 2019, Breast cancer quantitative proteome and proteogenomic landscape.Nature Communications.
原文链接:https://www.nature.com/articles/s41467-019-09018-y(点击阅读原文跳转原文页面)
https://wap.sciencenet.cn/blog-3404471-1179170.html
上一篇:Nature Plants | 中国农业大学高俊平组揭示玫瑰平衡生长和干旱存活关键机制
下一篇:研究新策略!Cell Systems:蛋白质组学与PDX双剑合璧,或将为高分级浆液性卵巢癌诊断带来福音