博文
破译“糖代码”,糖基化修饰研究近期精选
|
编者按:我们将每周三推送与蛋白质组学、翻译后修饰等相关文章的精选与概览。内容涵盖精准医学、表观遗传学与组蛋白修饰、外泌体、植物蛋白质组学等方面。欢迎关注!
上一期我们回顾了外泌体蛋白质组学的亮点研究:(文献速递 | 外泌体蛋白组学近期精选文章),随着蛋白质组学研究的日益成熟和规模化,蛋白翻译后修饰成为了新的研究焦点,糖基化修饰是一种重要且广泛存在的蛋白质翻译后修饰方式。今天继续给大家盘点近期的热点文章!
生物体内一半以上的蛋白存在糖基化修饰,包括转录因子,糖代谢相关酶类等,糖基化修饰影响蛋白质空间构象、活性、运输和定位,广泛参与到细胞间识别、调控、信号传导、免疫应答、细胞转化等生理过程,并且多种疾病的发生发展与其密切相关,如糖尿病、神经退行性疾病、癌症、心血管疾病等。
Molecular Cell :“糖衣炮弹”,病原菌通过糖基化修饰阻断宿主死亡受体信号通路
Sci Transl Med:首次发现人类新遗传疾病“卵子死亡”,糖基化为罪魁祸首
Immunity:糖基化调控天然免疫炎症反应的机制
eLife:研究揭示糖基化修饰参与癌细胞转移途径机制
Nature Reviews:系统解析,肿瘤细胞表面糖基化是如何影响抗肿瘤免疫功能?
精选 01 Molecular Cell :糖衣炮弹,病原菌通过糖基化修饰阻断宿主死亡受体信号通路
4月10日,中国科学院生物物理研究所王大成、丁璟珒团队同北京生命科学研究所邵峰团队、华中农业大学李姗团队合作,在MolecularCell杂志在线发文。研究完整地揭示了肠致病性大肠杆菌(EPEC)三型分泌系统效应蛋白NleB特异地识别并糖基化修饰宿主死亡结构域的关键精氨酸,阻断宿主死亡受体信号通路的分子机理。
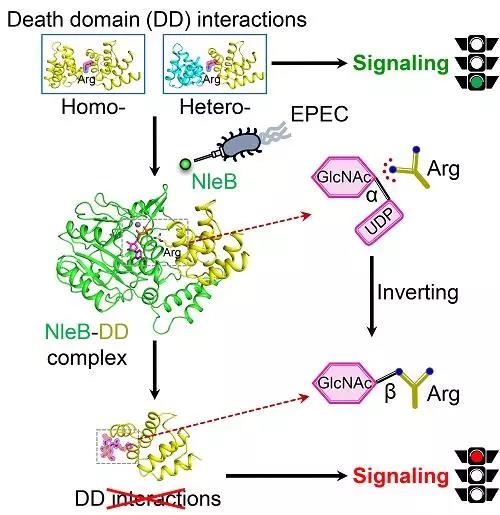
▲ EPEC效应蛋白NleB特异识别并糖基化修饰宿主死亡结构域的关键精氨酸,阻断宿主死亡受体信号通路的示意图
该研究不仅极大地丰富了人们对病原菌通过新颖的翻译后修饰破坏宿主关键信号通路的认识,为针对NleB开发拮抗EPEC感染的抗菌药物奠定了坚实的理论依据。更为重要的是,NleB介导的精氨酸糖基化不同于真核生物已知的各种糖基化修饰,这一研究成果为这种全新的蛋白质翻译后修饰的酶学反应机理提供了全面深入的理解,对病原菌效应蛋白NleB的改造和应用也将成为研究宿主死亡受体信号通路复杂多样的功能和调控机制的重要手段。
参考文献:Jing jin Ding, et al., (2019), Structural and functional insights into host death domains inactivation by the bacterial arginine GlcNAcyltransferase effector. Molecular Cell.
原文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(19)30232-1
02 Sci Transl Med:首次发现人类新遗传疾病“卵子死亡”,糖基化为罪魁祸首
3月27日,上海交通大学医学院附属第九人民医院生殖中心匡延平团队与复旦大学生命科学学院桑庆、王磊团队合作在杂志Science Translational Medicine(IF=16.710)发文。研究首次发现了一种新的人类遗传病,将其命名为“卵子死亡”。该疾病的致病基因为细胞连接蛋白家族成员PANX1存在突变,通过影响蛋白糖基化、激活通道、加速ATP释放,致使表型出现。

▲ 突变位点分布
PANX1为糖基化蛋白,细胞及卵子的系列功能实验证明:突变会改变PANX1的糖基化模式,被改变的糖基化模式与疾病密切相关,从而证明,“卵子死亡”是一种全新的孟德尔遗传病及糖基化疾病,也是PANX家族成员异常的首个离子通道疾病。
参考文献:Qing Sang, et al., (2019), A pannexin 1 channelopathy causes human oocyte death. Science Translational Medicine.
原文链接:
https://stm.sciencemag.org/content/11/485/eaav8731
03 Immunity:糖基化调控天然免疫炎症反应的机制
2月13日,美国俄亥俄州立大学温海涛团队在Immunity杂志上发文,报道了葡萄糖代谢分支途径-己糖胺生物合成通路(HBP)在调节天然免疫炎症反应和坏死性凋亡中的重要作用,研究发现RIPK3 T467位点糖基化修饰对于RIPK3介导的炎症反应和坏死途径至关重要。
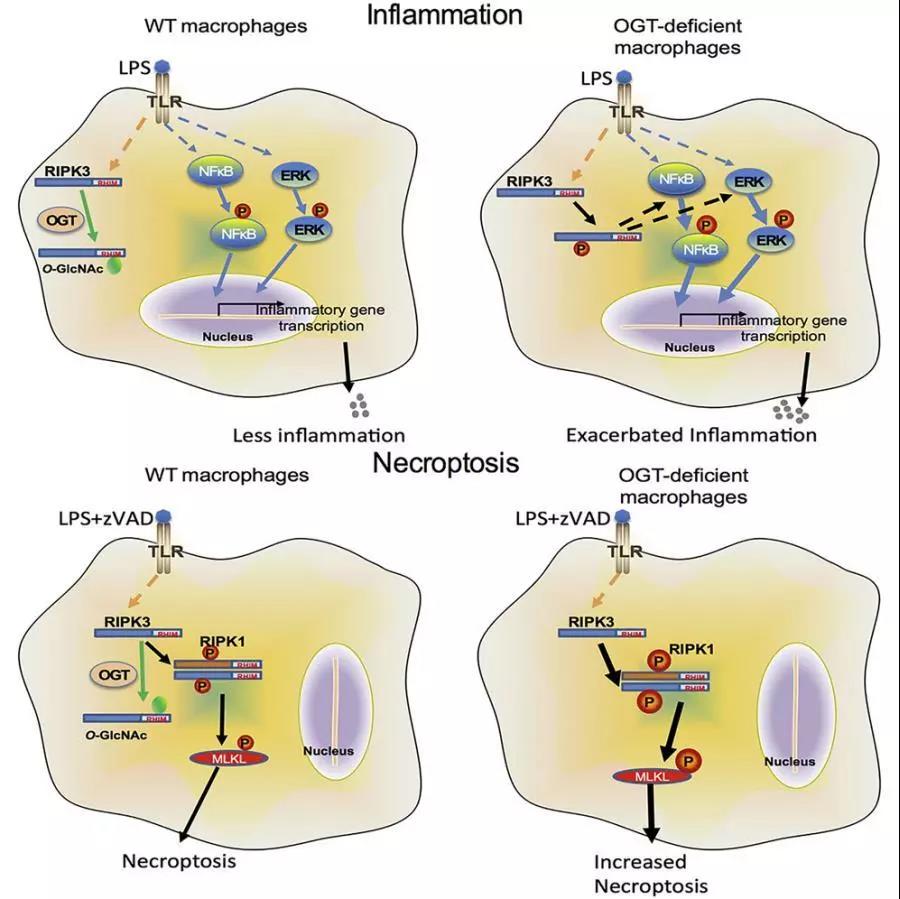
▲ 糖基化调控天然免疫炎症反应的机制
LPS(脂多糖,用于诱导炎症)激活巨噬细胞会增加糖酵解和磷酸戊糖途径的活性,但是却会导致HBP通路活性和蛋白质O-GlcNAcylation修饰的减弱。研究进一步揭示其中的分子机制:LPS通过下调O-GlcNAc转移酶(OGT)介导的RIPK3 T467位点糖基化修饰反应,阻止RIPK3-RIPK1异源以及RIPK3-RIPK3同源蛋白结合,并抑制下游天然免疫反应和坏死性凋亡信号,从而诱导炎症反应。
参考文献: Li,X., et al. (2019). O-GlcNAc Transferase Suppresses Inflammation and Necroptosis by Targeting Receptor-Interacting Serine/Threonine-Protein Kinase 3. Immunity.
原文链接:
04 eLife:研究揭示糖基化修饰参与癌细胞转移途径机制
研究发现,含有某些糖修饰的肿瘤细胞更有可能发生转移,然而,T抗原及糖基化修饰在这一过程中的具体作用还不清楚。3月26日,医学期刊eLife上发表文章,通过首次对黑腹果蝇胚胎的T和Tn糖型O-糖蛋白组进行表征,发现Minerva(一个非典型的主要促进因子超家族(MFS)成员)是一个关键的保守调节因子,它可以协调蛋白质子集上的O-糖基化,从而促进癌症的转移。
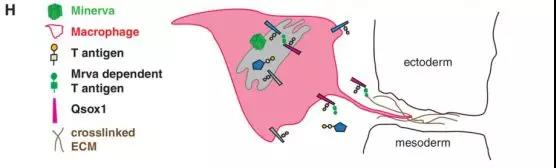
▲ 巨噬细胞侵袭时Minerva功能模型
为了研究Minerva作用于哪种蛋白质来影响T抗原,研究人员使用质谱技术,发现九种蛋白质在人体中具有直向同源物,其中六种在某种程度上与癌症有关。该研究只是了解糖类修饰参与癌细胞转移途径的第一步。未来,还需要更多的实验研究人体中Minerva在进入新组织的癌细胞中扮演的角色,以及它是否可以帮助我们预测癌症传播。
参考文献:Valoskova K, et al., 2019, A conserved major facilitator superfamily member orchestrates a subset of O-glycosylation to aid macrophage tissue invasion. Elife.
原文链接:
05 Nature Reviews:系统解析,肿瘤细胞表面糖基化是如何影响抗肿瘤免疫功能?
最后介绍一篇2018年发表在Nature Reviews Immunology上的经典综述文章。肿瘤的诊断和治疗一直是研究的热点和前沿,其中与免疫相关的诊疗手段更是研究的重点所在。该综述深入总结了在肿瘤微环境中肿瘤细胞表面糖基化是如何影响抗肿瘤免疫功能的,并介绍了“糖代码”在发展新的肿瘤诊断和治疗方法中的潜在作用。

▲ 与肿瘤“糖代码”相关的治疗干预
免疫细胞通过其凝集素受体来编码并翻译肿瘤细胞的“糖基化信号”,从而导致免疫抑制并促进免疫逃逸。由于一种类型的糖代码能够影响多种免疫细胞,因此想要通过干预肿瘤细胞糖基化来减轻免疫抑制作用,还需要进行更深入的研究。目前的研究表明,在肿瘤细胞上发现的特定糖基化可以被认为是一种新型的免疫检查点,同时肿瘤细胞表面的糖基化也可以作为肿瘤特异性T细胞的靶点。
参考文献:Ernesto RodrÍguez, et al., 2018, The tumour glyco-code as a novel immune checkpoint for immunotherapy. Nat Rev Immunol.
原文链接:https://www.nature.com/articles/nri.2018.3
https://wap.sciencenet.cn/blog-3404471-1176165.html
上一篇:专家评述 | 河南农业大学范国强组首次揭示翻译后修饰介导毛泡桐丛枝病发病新机制
下一篇:蛋白质组学揭示特发性炎性肌病发病关键机制 | Rheumatology