博文
Cell:亚硝基化修饰介导肠道微生物对宿主的影响
|
景杰学术/解读
2019年2月21日,凯斯西储大学医学院和克利夫兰医学中心的Jonathan S. Stamler研究团队在Cell发表了题为“Regulation of MicroRNA Machinery and Development by Interspecies S-Nitrosylation”的研究论文,揭示了肠道微生物可通过释放NO介导宿主蛋白的亚硝基化修饰,从而对宿主蛋白功能产生影响[1]。

肠道微生物菌群业已成为当前生物学医学研究领域中最为热门的话题之一,随着研究的不断深入,人们发现肠道微生物不但能够帮助宿主完成消化功能,而且同包括癌症、免疫等众多的生理病理过程密切相关。但是,位于肠道内部的微生物,是如何跨越肠道屏障的界限,来调控宿主本身的功能呢?
固然,在无损伤的情况下微生物本身是不能透过肠道屏障的,但是其产生的小分子代谢物却可以。一些肠道微生物产生的、扩散到宿主体内的小分子代谢物,确实能够对宿主蛋白的修饰状态和功能产生影响。例如已有研究表明,肠道微生物代谢产生的断链脂肪酸SCFA不但可作为一种能量分子,还可以通过抑制肠道表皮细胞的HDAC来促进其组蛋白H3K18的巴豆酰化修饰,进而影响宿主的基因表达调控[2]。而在这本文报道的这项研究中,作者发现肠道微生物产生的一氧化氮(NO)可以通过影响宿主蛋白的亚硝基化修饰进而影响其功能,再一次证明了代谢物所诱导的蛋白质修饰改变是肠道微生物-宿主调控中的重要机制。
亚硝基化(S-nitrosylation)是一种在生物界中广泛存在的氧化还原修饰类型,是由一氧化氮(NO)对蛋白质的半胱氨酸侧链巯基(-SH)氧化而产生的(图1)。而利用质谱来解析亚硝基化修饰组学的技术,近年来也取得了长足的发展,为系统研究这类蛋白质修饰提供了强大的武器,特别是我国科学家在这方面也取得了一系列成绩。早在2015年,中科院遗传发育所的左建儒研究员和汪迎春研究员就在Plant Physiology上发表文章,系统解析了拟南芥中的亚硝基化修饰图谱[3];在此基础上,2017年左建儒研究员又在Molecular Cell上发文阐述了蛋白质亚硝基化在植物抗逆中的重要功能[4]。

图1 蛋白质的巯基亚硝基化(S-nitrosylation)修饰[5]
图片来自http://watcut.uwaterloo.ca/webnotes/Pharmacology/NitricOxide.html
而在本文报道的这篇文章中,作者则采用以线虫为材料研究肠道菌群对宿主的影响。作者分别用WT和一氧化氮合酶缺陷型的枯草芽孢杆菌来饲喂线虫,待线虫长到幼虫第四阶段时提取线虫的总蛋白,并使用基于质谱的蛋白质组学技术来解析其亚硝基化修饰组。作者一共检测到约1000种线虫亚硝基化蛋白,并通过KEGG分析发现这些蛋白主要参与了能量等细胞代谢途径。在这些蛋白中,作者选择了功能较为保守和研究充分的蛋白ALG-1上的Cys691位点为进一步的研究对象。
接下来,作者通过蛋白序列和结构域的分析发现,Cys691位点毗邻ALG-1同AGO2和GW182相互作用的位点,因此推测该位点的亚硝基化修饰同与GW812的结合有关。作者接下来通过点突变等实验证明,ALG-1的Cys691位点亚硝基化能够抑制其与GW182的结合(图2)。
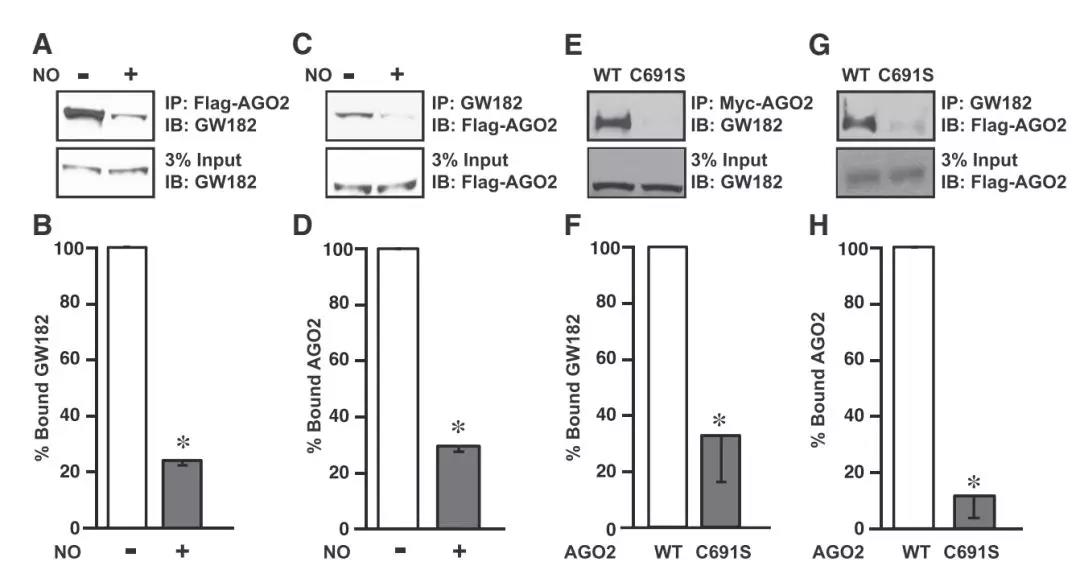
图2 ALG-1的Cys691亚硝基化影响其同GW182的相互结合
根据以往的研究,ALG-1同GW182的结合对其下游功能的行使至关重要。ALG-1通过GW182来募集其他蛋白质形成一个复合体,结合microRNA来降解相对应的mRNA并抑制蛋白质翻译[5]。作者接下来的实验证明,Cys691的亚硝基化确实也能够破坏microRNA对靶基因的抑制效果,并影响宿主的发育。因此,本项研究构筑了一个“肠道菌群-NO释放-宿主ALG-1亚硝基化-影响microRNA抑制靶基因-影响宿主发育”的完整story(图3)。
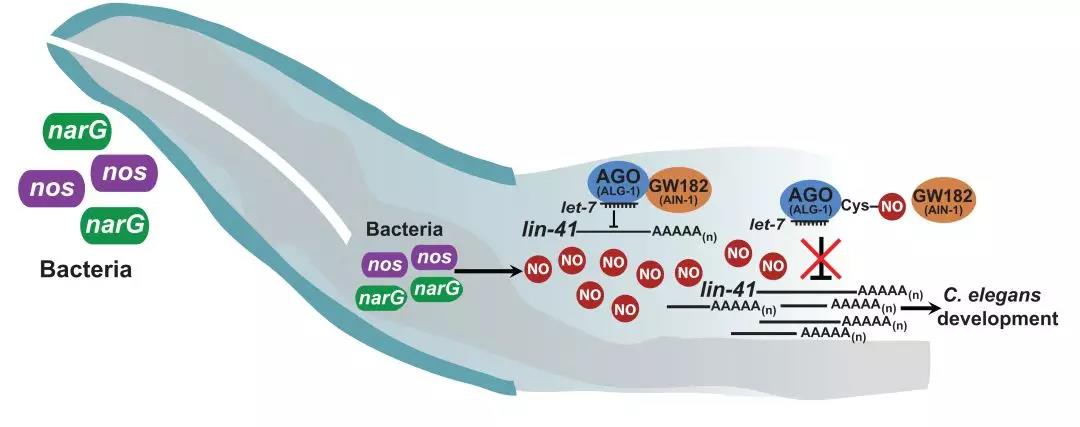
图3 肠道微生物释放NO影响宿主发育的机制模型
通过代谢物扩散并影响蛋白质的修饰和功能,是肠道微生物群落对宿主发挥调控作用的重要机制。本文通过组学筛选、生信分析和实验验证,为这一理论提供了新的有力证据。其新颖的观点、严密的逻辑和完整的实验结果,使得其能够发表在Cell本刊,其思路也值得未来相关领域的研究者所借鉴。
参考文献:
[1] Seth P, et al., 2019, Regulation of microRNA machinery and development by interspecies S-nitrosylation. Cell.
[2] Fellows R, et al., 2018, Microbiota derived short chain fatty acids promote histone crotonylation in the colon through histone deacetylases. Nature communications.
[3] Hu J, et al., 2015, Site-specific nitrosoproteomic identification of endogenously S-nitrosylated proteins in Arabidopsis. Plant Physiology.
[4] Hu J, et al., 2017, Nitric oxide regulates protein methylation during stress responses in plants.Molecular cell.
[5] Behm-Ansmant I, et al., 2006, MicroRNAs silence gene expression by repressing protein expression and/or by promoting mRNA decay[C]//Cold Spring Harbor symposia on quantitative biology. Cold Spring Harbor Laboratory Press.
https://wap.sciencenet.cn/blog-3404471-1169964.html
上一篇:北大医学院赵文会组首次发现P53 β-羟基丁酰化修饰减弱其肿瘤抑制功能
下一篇:Theranostics报道:基于血液蛋白质组学的中医药精准医学研究