博文
北大医学院赵文会组首次发现P53 β-羟基丁酰化修饰减弱其肿瘤抑制功能
|
p53蛋白是人类癌症中最常出现突变的抑癌基因,超过80%的人类癌症病例涉及到p53的突变和失活。p53的激活导致下游参与细胞生长过程,如细胞停止生长,细胞凋亡,自噬,衰老,以及新陈代谢等相关的基因以及小RNA的转录。
近日,北京大学基础医学院的赵文会教授课题组研究发现重要的肿瘤抑制因子p53能够发生β-羟基丁酰化修饰,CBP/p300(组蛋白乙酰转移酶)同时具有β-羟基丁酰转移酶活性,介导p53的β-羟基丁酰化修饰。赖氨酸的β-羟基丁酰化修饰减低其乙酰化修饰水平和活化,并减弱p53介导的细胞生长停滞和凋亡的功能。
组蛋白β-羟基丁酰化修饰(又称三羟基丁酰化修饰)由芝加哥大学赵英明教授课题组于2016年首次报道发现(点此阅读),该修饰广泛存在于细胞的组蛋白赖氨酸上,来源于酮体之一,β-羟基丁酸(BHB),与酮体代谢密切相关。目前对其研究主要集中在组蛋白上,关于非组蛋白特别是转录因子的β-羟基丁酰化修饰还知之甚少。本论文首次揭示了β-羟基丁酰化修饰是一种新的p53活性调控机制,为我们揭示了这一新型酰化修饰的新的生物学功能。

此外,之前研究发现,酮体在癌症生物学中发挥作用,但其具体作用机制尚不清楚。本研究表明肿瘤抑制蛋白p53在BHB存在条件下活性减弱,因此,可部分解释酮体在癌症中的作用机制。除此之外,脂肪酸经β-氧化的代谢生成乙酰辅酶a,进而在肝脏中合成酮体。因此该研究相当于从另一个角度关注脂肪酸与癌症的关系,为我们深入研究脂肪酸代谢与癌症的关系提供了研究思路。
1、p53 β-羟基丁酰化修饰的鉴定及特征
研究者分别利用BHB、丙酮酸或谷氨酰胺处理Flag-P53融合蛋白过表达的293T细胞,分别用抗p53和抗赖氨酸β-羟基丁酰化泛抗体(PTM Pan系列泛抗体,由景杰生物提供)对富集蛋白进行免疫印迹分析,结果表明,只有用BHB处理的细胞中p53发生β-羟基丁酰化修饰。此外饥饿处理组小鼠胸腺组织中P53 β-羟基丁酰化修饰水平也发现明显升高。以上研究说明:p53 β-羟基丁酰化修饰存在于用BHB处理过的细胞中,也存在于禁食导致血清中BHB浓度增加的小鼠的胸腺组织中。
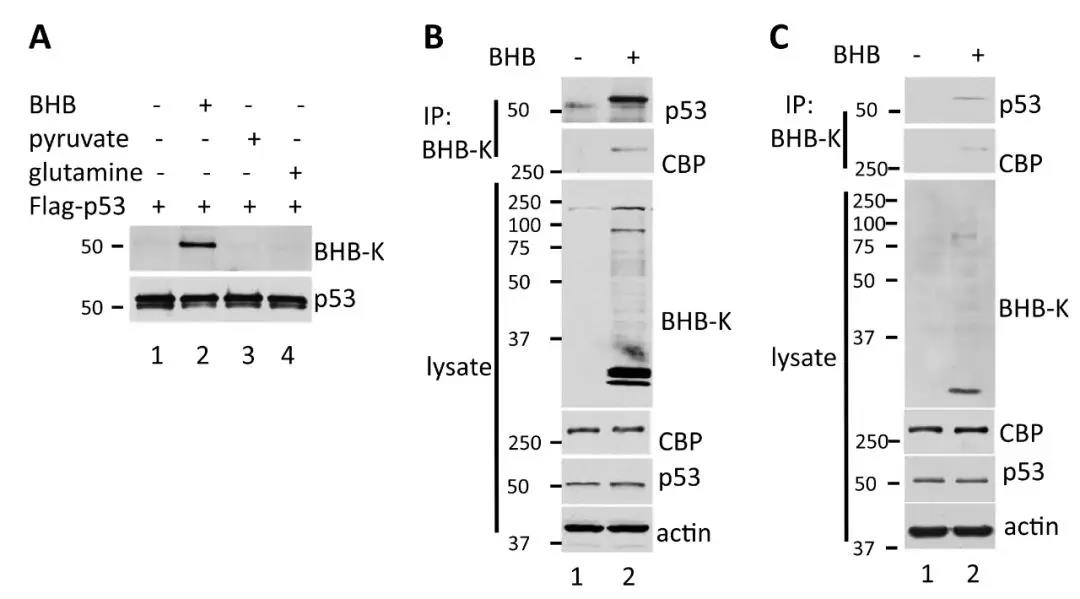
图1 p53 β-羟基丁酰化修饰的鉴定及特征
研究人员进一步通过HPLC-MS/MS检测,发现β-羟基丁酰化修饰发生在p53的120、319和370位赖氨酸上面。修饰位点氨基酸突变后,p53 β-羟基丁酰化修饰水平明显降低。
2、p53 β-羟基丁酰化修饰减低其乙酰化水平,减弱其肿瘤抑制功能
研究人员进一步利用BHB处理293T细胞,在p53 β-羟基丁酰化修饰水平能检测到的情况下,p53乙酰化修饰水平明显降低(图2 a,b),在HCT116细胞系和CBP过表达的细胞系,也表现出类似的现象 (图2 c, d)。说明p53 β-羟基丁酰化修饰减低其乙酰化水平。

图2 p53 β-羟基丁酰化修饰减低其乙酰化水平和活化
通常p53的翻译后修饰影响其活性,接下来,作者想研究p53 β-羟基丁酰化修饰对其活性的影响,用去乙酰化酶抑制剂Ex527和/或BHB处理HCT116细胞,结果表明Ex527处理后导致p53乙酰化水平增加以及靶基因p21和PUMA的表达上调,然而,同时用BHB和Ex527处理导致p21和PUMA表达水平低于仅Ex527处理组。这些结果表明,p53优先发生β-羟基丁酰化修饰,并导致p53基因调控活性减弱。
因为p53参与了细胞生长以及细胞凋亡的调节,这在肿瘤的发展过程中尤其重要,因此作者进一步用BHB和/或Nutlin(Nutlin有效抑制MDM2-p53相互作用,进而阻止MDM2降解p53)处理U2OS细胞,研究p53 β-羟基丁酰化修饰对其调节细胞生长停滞和细胞凋亡功能的影响。研究发现,BHB处理促进p53的β-羟基丁酰化修饰,进而减弱其调节细胞生长停滞和细胞凋亡功能。
3、禁食小鼠组织中基因毒性条件下p53调节基因表达减少
研究人员进一步用体内试验研究p53 β-羟基丁酰化修饰的作用。作者利用禁食并用γ射线照射引起DNA损伤的小鼠胸腺组织,通过跟踪其下游靶基因的表达监测p53活性。研究表明γ射线照射后,禁食组p21和PUMA的蛋白以及mRNA表达水平显著低于正常饮食组(图3a,b)。同样,饥饿导致小鼠血浆中BHB水平升高以及胸腺组织p53乙酰化修饰水平降低,这些与体外实验结论一致(图3 c)。
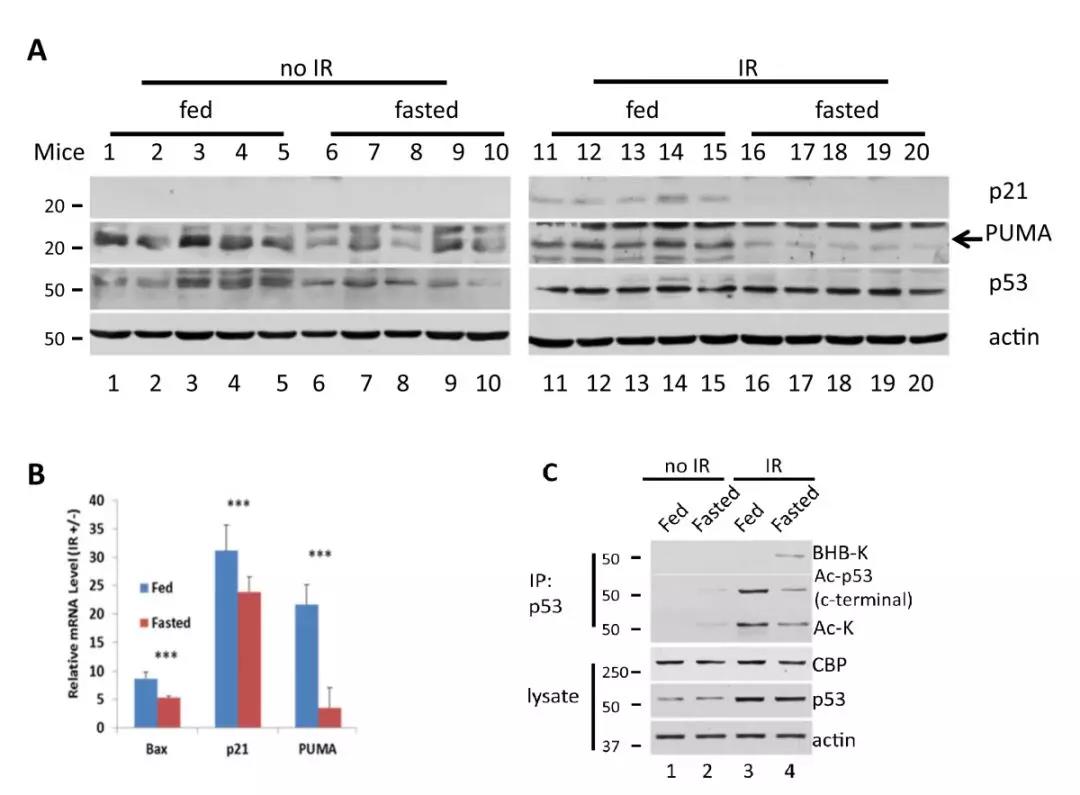
图3 p53 β-羟基丁酰化修饰抑制下游基因表达
相比之下,在γ辐射小鼠中,禁食组小鼠的凋亡细胞比例低于正常喂养组小鼠。以上实验结果显示赖氨酸的β-羟基丁酰化修饰,导致基因毒性诱导的p53活化降低,从而导致p53调节基因表达减少以及细胞凋亡减少。
综上所述,该研究首次发现p53可以在BHB作用下发生β-羟基丁酰化修饰,并且这个修饰是由CBP/p300是组蛋白乙酰转移酶催化的。p53 β-羟基丁酰化修饰存在于用BHB处理过的细胞中,也存在于禁食导致血清中BHB浓度增加的小鼠的胸腺组织中。
p53 β-羟基丁酰化修饰减低其乙酰化修饰水平和活化,并且相对于正常饮食小鼠,饥饿小鼠由基因毒性诱导的p53活化降低,从而导致p53调节基因表达减少以及细胞凋亡减少,进一步研究者发现BHB处理的细胞中p53的细胞生长停滞和凋亡诱导功能减弱。
研究也部分解释酮体在癌症中的作用机制,并且提示了另一个角度关注脂肪酸与癌症的关系,为我们深入研究脂肪酸代谢与癌症的关系提供了研究思路。
参考文献:
Kun Liu, et al., 2019, p53 β-hydroxybutyrylation attenuates p53 activity, Cell Death & Disease.
https://wap.sciencenet.cn/blog-3404471-1169050.html
上一篇:专家视界 | 上海生物信息技术研究中心谢鹭教授:用蛋白质组学破译癌症密码
下一篇:Cell:亚硝基化修饰介导肠道微生物对宿主的影响