博文
顺藤摸瓜,磷酸化组学寻找AMPK关键下游互作因子ARMC10
|
景杰编者按:
AMPK是细胞内能量稳态的关键调控因子,尽管关于AMPK在细胞过程中的功能已被广泛研究,但是AMPK是否还存在新的下游底物以及下游功能调控网络对细胞命运以及疾病发生发展的影响?现在知道的并不完全。
为了探究AMPK依赖的信号通路调控,来自美国德克萨斯大学MD安德森癌症中心实验放射肿瘤中心陈俊杰(Junjie Chen)研究团队运用定量磷酸化蛋白质组学分析了AMPK野生型和AMPKα1/α2双敲除的细胞系内的蛋白组变化,共鉴定到160个AMPK调控的磷酸化位点。进一步分析发现,AMPK可以在体内体外磷酸化一个新的底物蛋白ARMC10 S45位点。ARMC10过表达能够促进线粒体分裂,但是ARMC10敲除能有效的抑制AMPK介导的线粒体分裂。

研究结果证明ARMC10是AMPK下游新的底物并参与到AMPK介导的线粒体分裂和融合的动力学调控过程中,为揭示AMPK调控细胞过程新的机制提供思路。研究成果于2019年1月10日在线发表在国际专业学术期刊Nature Communications上,是一篇运用质谱依赖的修饰组学技术寻找已知蛋白下游互作因子以及信号调控网络与生理功能的经典范例。
研究对象:AMPK依赖的信号通路调控
实验样本:HEK293A, HEK293T and U2OS等肿瘤细胞系
发表期刊:Nature Communications(IF=12.353)
发表单位:德克萨斯大学 M. D. Anderson 癌症中心
发表时间:2019.01.10
AMPK(AMP-activated protein kinase)是一类激酶复合物,在真核生物细胞能量稳态过程中发挥关键功能。AMPK能够监测细胞内ATP的水平,当AMP:ATP和ADP:ATP的比例增加时,AMPK被活化进而调控下游多种通路的酶活性来控制能量稳态。AMPK活化葡萄糖吸收和分解代谢,促进ATP的产生;关闭合成代谢,抑制ATP的消耗。同时,ATP还能调控mTOR,后者能通过抑制自噬和凋亡来调控细胞增殖。
作为细胞过程中重要的调控因子,AMPK在多种疾病过程如癌症、糖尿病等发生发展中也发挥重要功能。因此,临床上已经开发了多种调控AMPK信号通路的化合物来治疗疾病,比如研究活化AMPK的二甲双胍,作为潜在的抗肿瘤药物在临床上使用。
鉴于AMPK在生理和病理中如此重要的功能,因此进一步挖掘AMPK下游的调控底物对于理解AMPK的功能以及疾病治疗上的应用具有非常高的价值。
1. 磷酸化蛋白质组学筛选AMPK下游底物
首先,作者运用CRISPR-Cas9基因编辑技术将AMPKα1/α2进行双敲除,并通过Western blotting对敲除效果进行验证。接下来运用SILAC标记的定量磷酸化蛋白质组学技术对WT组细胞系和敲除组细胞系进行实验(图1)。
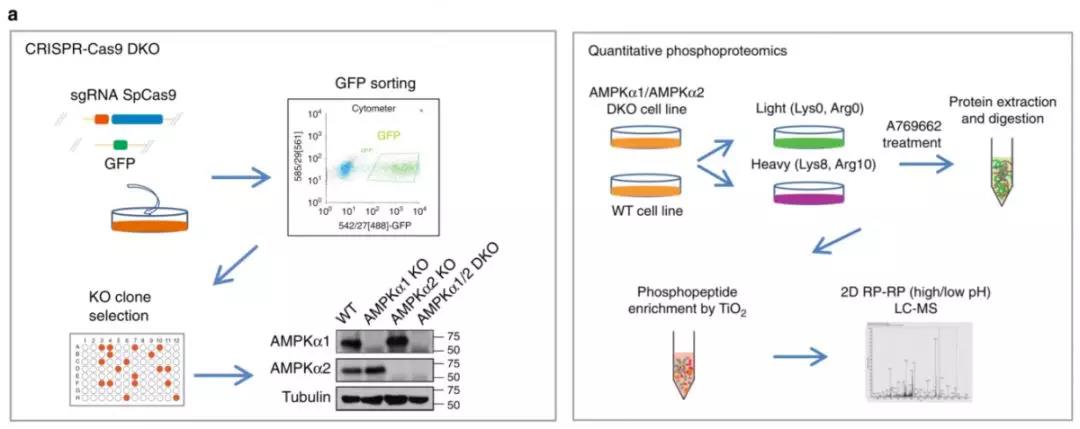
图1 磷酸化蛋白质组学筛选鉴定AMPK下游底物
2. 磷酸化蛋白质组学结果分析
生物信息学分析显示共鉴定到9122个磷酸化肽段;进一步分析发现,WT细胞组和AMPKα1/α2-DKO细胞组相比,共有109个磷酸化位点上调,51个磷酸化位点下调(图2a)。
为了在磷酸化蛋白质组学数据中筛选AMPK的潜在底物,作者将WT细胞组中109个上调磷酸化位点根据AMPK保守的底物序列分成两组,group1中32个磷酸化位点具有AMPK一致性序列,group2中77个磷酸化位点无AMPK一致性序列(图2b),WT组中下调的51个磷酸化位点被分成group3。
通过IPA(Ingenuity Pathway Analysis)对三组蛋白进行功能分析(图2c),结果显示,group1为AMPK直接调控的潜在底物,在胞质过程如代谢、细胞结构重组、线粒体分裂等过程中发挥功能。Group2、group3为AMPK间接调控的潜在底物,主要参与细胞核中包括转录、翻译、细胞周期、DNA修复等过程。

图2 磷酸化蛋白质组学数据分析
3. ARMC10是AMPK新的调控底物
为了在实验上验证AMPK新的调控底物,作者选取了排名最前的ARMC10(Armadillo repeat containing protein 10,alternative name SVH, specific splicing variant involved in hepatocarcinogenesis))进行pulldown实验(图2d,验证AMPK和ARMC10的结合)和体外激酶实验(图2e,验证AMPK对ARMC10的磷酸化),结合后续的S45磷酸化特异性抗体实验证明,AMPK确实可以磷酸化ARMC10的S45位点。
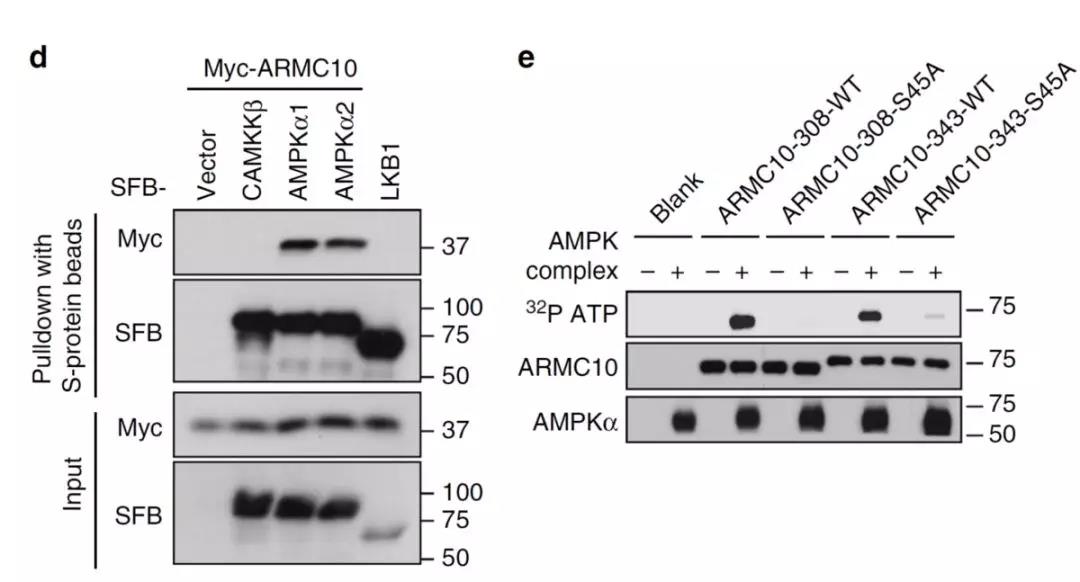
图3 AMPK底物验证
4. AMPK通过下游底物ARMC10调控线粒体动力学和细胞存活
在确认了ARMC10定位在线粒体并参与线粒体分裂后,为了进一步探究AMPK介导的ARMC10磷酸化对线粒体动力学以及细胞功能的影响,作者通过在筛选的U2OS稳定细胞中进行免疫荧光实验。结果显示,AMPK磷酸化ARMC10后促进线粒体分裂(图4a,4b)。
已有的研究表明线粒体分裂、融合与细胞生存密切相关,进一步通过生存实验发现,AMPK介导的ARMC10磷酸化促进细胞存活(图4c, 4d)。
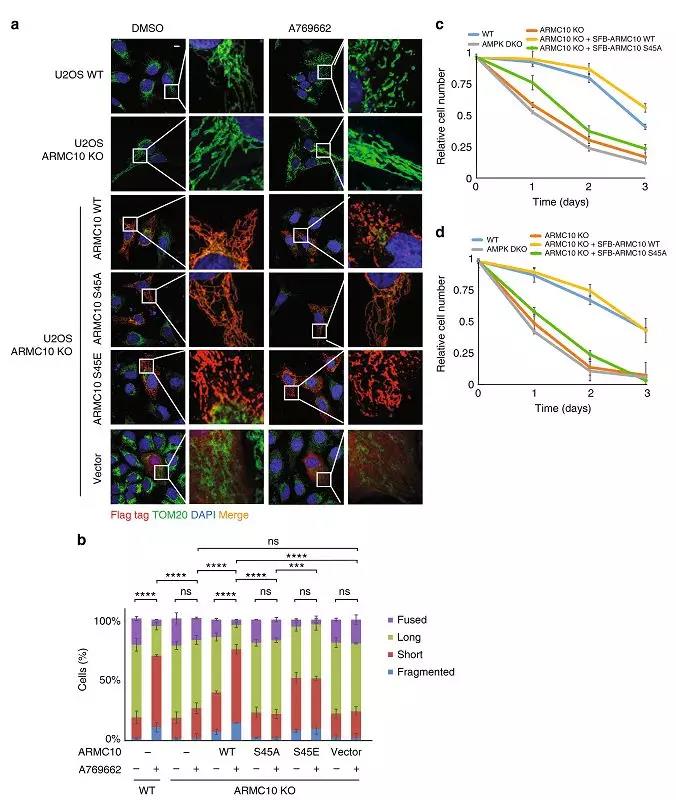
图4 AMPK通过下游底物ARMC10调控线粒体动力学和细胞存活
5. 蛋白互作组揭示ARMC10调控线粒体动力学的机制
为了探究ARMC10在线粒体调控过程中的具体机制,作者通过BioID技术进行蛋白互作的分析。在构建了BioID2-ARMC10稳定细胞系后进行BioID2-MS实验。实验结果显示,ARMC10作用的蛋白包括Drp1(调控线粒体分裂)、MEF, MIEF1, MIEF2(调控Drp1招募到线粒体)、MTFR1, MTFR2(线粒体分裂调控因子)、BNIP3, BAX(介导线粒体功能紊乱和线粒体自噬)。以上的结果表明,ARMC10可能通过与MFF, FIS1, Drp1蛋白作用调控线粒体功能(图5)。

图5 AMPK磷酸化ARMC10 S45调控线粒体分裂的模型
本篇文章是一篇运用质谱依赖的修饰组学技术寻找已知蛋白下游互作因子以及信号调控网络与生理功能的经典范例。AMPK是细胞内广为人知调控能量稳态的关键因子并与多种疾病如癌症、糖尿病等发生发展密切相关。本文运用近年来非常热门的CRISPR-Cas9技术结合定量磷酸化蛋白质组学分析,发现AMPK可以磷酸化一个新的底物蛋白ARMC10 S45位点并参与线粒体动力学和细胞生存,为揭示AMPK调控细胞过程中新的机制提供思路。
在基础科研中,寻找激酶的下游底物是一项非常有挑战的工作,而本文前期的筛选结果正是体现了蛋白质组学技术在基础研究中挖掘下游互作蛋白和调控网络机制的强大功能,对后续类似的科学研究具有非常重要的参考和指导意义。
景杰生物:蛋白质组产品与技术应用的开拓者与领跑者
了解更多:www.ptm-biolab.com
陈俊杰教授课题组简介:
陈俊杰教授,现任美国德克萨斯大学MD安德森癌症中心实验放射肿瘤中心主任。他是基因组稳定性,特别是DNA损伤应答通路和癌症生物学方面的国际著名科学家。他本科毕业于复旦大学,后来在佛蒙特大学获得博士学位,在哈佛医学院Anindya Dutta 和David Livingston实验室进行博士后训练。
陈俊杰教授实验室主要研究基因组不稳定性和肿瘤发生的分子机制。DNA损伤后的基因组完整性依赖于DNA修复和细胞周期检查点控制的协作。DNA损伤反应通路的完整性对防止细胞恶性转化,起到很重要的作用。
陈俊杰教授在发现DNA损伤通路的新组分上做出了许多重要贡献。近年来他的研究开始涉及基因组不稳定性的其他领域,包括有丝分裂调控和细胞衰老,阐明了有丝分裂检查点蛋白Chfr调控多种关键有丝分裂激酶,保证有丝分裂的进行。另外,他实验室也研究去乙酰化酶SIRT1在衰老和肿瘤发生中的作用。
参考文献:
Zhen Chen, et al. (2019), Global phosphoproteomic analysis reveals ARMC10 as an AMPK substrate that regulates mitochondrial dynamics. Nature Communications.
https://wap.sciencenet.cn/blog-3404471-1158318.html
上一篇:血浆蛋白质组或可揭示胰岛素抗性之谜
下一篇:古树新芽亦争春,蛋白质组学深入揭示囊泡运输的重要机制