博文
文献精读
|
Thermotolerance and molecular chaperone function
of the small heat shock protein HSP20 from hyperthermophilic
archaeon, Sulfolobus solfataricus P2
Dong-Chol Li & Fan Yang & Bo Lu & Dian-Fu Chen &Wei-Jun Yang
Cell Stress and Chaperones (2012) 17:103–108
小热休克蛋白在所有三个结构域(古细菌,细菌和真核生物)中普遍存在,并且通过与未折叠多肽结合并在体外防止蛋白质聚集而具有分子伴侣活性。尚未描述来自超嗜热古菌Sulfolobus solfataricus P2的小热休克蛋白(S.so-HSP20)的功能。在本研究中,我们使用实时聚合酶链反应分析来测量S.so-hsp20在S.solfataricus p2中的mRNA表达,发现这是由明显低于(60°C)或高于(80°C)S.solfataricus p2(75°C)的最佳温度诱导的。冷休克(4°C)也能上调S.sohsp20的表达。表达S.so-hsp20的大肠杆菌细胞对温度冲击(50°C,4°C)表现出更强的耐热性。通过酶活性测定,发现S.so-hsp20能促进热变性柠檬酸合成酶和胰岛素B链的正确折叠。这些结果表明,在应激反应过程中,S.so-hsp20促进了耐热性,并参与了类似伴侣的活动。
材料和方法
在不同温度和冷激处理下培养S. solfataricus P2
培养S. solfataricus P2,标准培养基(酵母提取物,2.0g; KH2PO 4,3.10g;(NH 4)2 SO 4,2.50g; MgSO 4×7H 2 O,0.20g; CaCl 2×2H 2 O,0.25g;蒸馏水,1,000.00ml)。在高压灭菌之前,在室温下用NH 2 SO 4将培养基的pH调节至3.5。S. solfataricus P2在不同温度(60℃,75℃,80℃)下培养。在对数生长期期间以OD600 = 0.6收获细胞。对于冷休克培养,S.solfataricus P2是在75℃下培养后,在4℃下暴露2小时。
克隆,表达和纯化重组S.so-HSP20
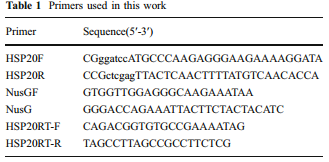
正向引物(HSP20F)含有BamH I位点(表示小写,表1)和反向引物(HSP20R)包含一个独特的XhoI站点(表示小写,表1)。用BamHI和XhoI消化PCR产物,并连接到用BamHI和XhoI消化的pET-28a载体中,产生pET-28a-S.so-HSP20,其编码具有N的S.so-HSP20。将pET-28a-S.so-HSP20转化到大肠杆菌BL21(DE3)中,通过加入异丙基-β-D-硫代半乳糖苷(IPTG; 1mM终浓度)诱导His6-S.so-HSP20。在含有50μg/ ml卡那霉素的Lauria-Bertani(LB)培养基中培养。His6标记的蛋白质通过Ni-NTA(Qiagen,USA)纯化。聚丙烯酰胺凝胶电泳后考马斯亮蓝染色。
用转化的大肠杆菌进行耐热性实验
对于耐热性实验,如上所述培养大肠杆菌(pET-28a-S.soHSP20)。
将IPTG(1mM)加入到对数中期培养物(OD600 = 0.8)中,并将细胞在30℃下培养2小时。 将培养物在50℃下培养15,30,45,60分钟,并在4℃下培养1,2,3和4天。然后将培养物稀释至5.0×1000000个细胞/ ml,并将50μl样品一式三份涂布在含有50μg/ ml卡那霉素的LB平板上。将平板在37℃温育过夜,然后对集落形成进行评分以确定存活者的百分比。对于每次处理,通过将处理的样品中每个平板的活细胞数除以未处理的样品(不暴露于热或冷休克)来计算存活的大肠杆菌菌落的比例。
结果
在不同生长温度和冷激条件下S.so-HSP20 mRNA在S. solfataricus P2中的表达
在不同的培养温度下测量S.so-HSP20 mRNA在S. solfataricus P2中的表达(图1)。
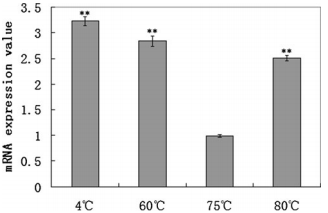
在远离最佳生长温度75℃的培养温度下,S.so-HSP20 mRNA表达强烈增加。较低(60℃)或更高的温度下(80℃)S.so-HSP20 mRNA表达的增加量是最佳培养温度(75℃)的2.83倍和2.5倍。对于4℃的冷冲击 S.so-HSP20 mRNA表达也增加了3.23倍。
在表达S.so-HSP20的大肠杆菌中的热应激后存活
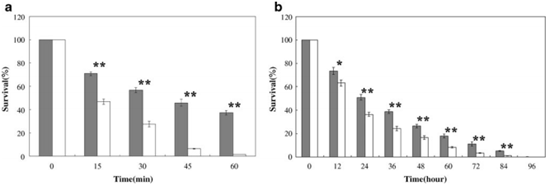
确定S.so-HSP20是否可以增强大肠杆菌的耐热性,热应激对大肠杆菌的影响。用S.so-HSP20转化的大肠杆菌细胞的生长存活率检测。
表达S.so-HSP20的大肠杆菌比仅含有pET-28a载体的细胞更耐热。
如图2所示,在暴露于50℃后,用pET-28a转化的细胞的存活率仅在1小时下降至约1.5%,而具有pET-28a-S.so-HSP20的细胞的存活率为37.9。%。 用S.so-HSP20转化也可以保护大肠杆菌免于暴露于寒冷(4°C),冷暴露3天后存活率为18.8%,而仅用pET-28a转化的大肠杆菌仅为1.2%。这些结果表明S.so-HSP20在大肠杆菌细胞中的表达增加了细胞的耐热性。
S.so-HSP20在体外表现出分子伴侣活性
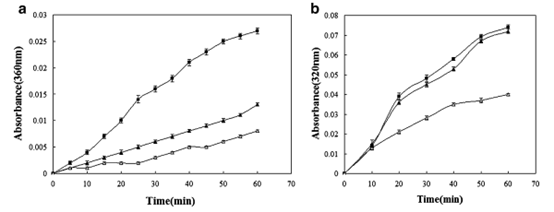
分子伴侣的一个关键特征是它们抑制非天然蛋白质聚集的能力。
为了测试S.so-HSP20是否表现出分子伴侣活性,我们使用柠檬酸合成酶和柠檬酸合成酶进行热去折叠测定。胰岛素B链作为模型底物(图3和4)。纯化的S.so-HSP20有效保护柠檬酸合成酶免受热诱导的变性。在浓度为150或300nM时,S.so-HSP20分别降低了由43℃培养60分钟导致的热诱导浊度48.1%和70.4%(图3a)。类似地,由S.so-HSP20在45℃下孵育60分钟导致的热诱导浊度降低了38.3%(图3b)。在40℃下24分钟后,S.so-HSP20使胰岛素B链的热诱导浊度降低47%(图4)。这些结果证明S.soHSP20在体外表现出分子伴侣活性。
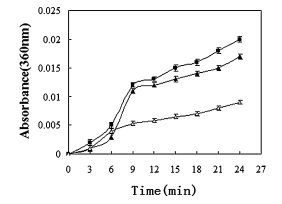
在目前的研究中,检测了S. solfataricus P2 sHSP,HSP20的耐热性和分子伴侣特性。将嗜热嗜热古细HSP20基因的编码区S. solfataricus P2克隆到质粒载体中并在细菌中过表达。重组蛋白用于结构和功能分析。我们分析了HSP20响应不同培养温度的mRNA表达。许多sHSP不是组成型表达的,并且它们的表达是特异性地响应于应激条件,例如升高的温度而诱导的。我们发现在远离最佳生长温度的温度下培养S. solfataricus P后,S.so-HSP20 mRNA的表达显着增加。该结果表明S.so-HSP20 mRNA表达是应激诱导的,并且可以保护S.solfataricus P2免受压力。 S.so-HSP20在大肠杆菌中的表达也保护这些细胞免受包括冷休克在内的温度胁迫。已经提出大肠杆菌HSP在保护细胞免受热杀伤中起主要作用。S.so-HSP20在大肠杆菌中的功能可能是促进通过增强大肠杆菌中的蛋白质合成来进行耐热性(包括HSPs)或通过其伴侣活动变性保护大肠杆菌蛋白免受热。我们在生理和热休克温度下证明了S. solfataricus P2的S.so-HSP20的分子伴侣活性。 S.so-HSP20保护免受热诱导的柠檬酸合酶和胰岛素B链聚集的能力表明S.so-HSP20具有分子伴侣活性和识别并结合未折叠蛋白质以防止其在体外聚集的能力。细胞耐热性与大肠杆菌表达系统中S.so-HSP20表达之间的关系以前没有报道过。该研究的结果提供了证据,证明S.so-HSP20可以保护大肠杆菌免受热应激并且在体外表现为伴侣蛋白。
https://wap.sciencenet.cn/blog-3404012-1159170.html