博文
以-奥-德-韩4国科学家联合发现2种癌症抑制蛋白(附原文)
 精选
精选
|||
以-奥-德-韩4国科学家联合发现2种癌症抑制蛋白(附原文)
诸平
以色列理工大学(Technion-Israel Institute of Technology)、以色列海法市兰巴姆医疗卫生园(Rambam Health Care Campus)、海法市卡梅尔医疗中心(Carmel Medical Center)、以色列内盖夫本·古里安大学(Ben-Gurion University of the Negev)、以色列希伯莱大学-哈达莎医学院(Hebrew University-Hadassah Medical School);奥地利科学院分子医学研究中心(CeMM Research Center for Molecular Medicine of the Austrian Academy of Sciences)、德国柏林马克斯·德尔布吕克分子医学中心(Max Delbrück Center for Molecular Medicine)、韩国首尔国立大学(Seoul National University)医学院等机构的研究人员合作,在尚在进行之中的泛素系统(ubiquitin system)研究中发现先前未被发现的2种抑癌蛋白,这是2种能控制癌细胞生长和发展的关键蛋白质。此项研究成果于2015年4月9日已经在《细胞》(Cell)杂志发表——Yelena Kravtsova-Ivantsiv, Inna Shomer, Victoria Cohen-Kaplan, Berend Snijder, Giulio Superti-Furga, Hedva Gonen, Thomas Sommer, Tamar Ziv, Arie Admon, Inna Naroditsky, Muhammad Jbara, Ashraf Brik, Eli Pikarsky, Yong Tae Kwon, Ilana Doweck, Aaron Ciechanover. KPC1-Mediated Ubiquitination and Proteasomal Processing of NF-κB1 p105 to p50 Restricts Tumor Growth. Cell, 2015; 161 (2):333-347. DOI: 10.1016/j.cell.2015.03.001.PIIS0092867415002548.pdf
该研究是在世界著名蛋白组学家、以色列科学院院士、美国科学院外籍院士、2004年诺贝尔化学奖得主阿龙•西查诺瓦(Aaron Ciechanover,1947-)的实验室完成的。该研究团队是由研究助理Yelena Kravtsova-Ivantsiv博士(也是Cell论文的第一作者)带领,不仅有以色列多家机构参加,而且也有来自德国、韩国以及奥地利从事肿瘤研究与治疗的专家。
KPC1是细胞生命中一个重要和关键的通路,负责降解有缺陷的蛋白,如果不去除有缺陷的蛋白就会对细胞造成伤害。泛素系统(ubiquitin system)可标记这些蛋白质,并将其运送到被称为蛋白酶体(proteasome)的细胞复合体内进行毁灭。该系统还能消除不再需要的功能性蛋白质以及健康蛋白质,从而调节这些蛋白所控制的过程。
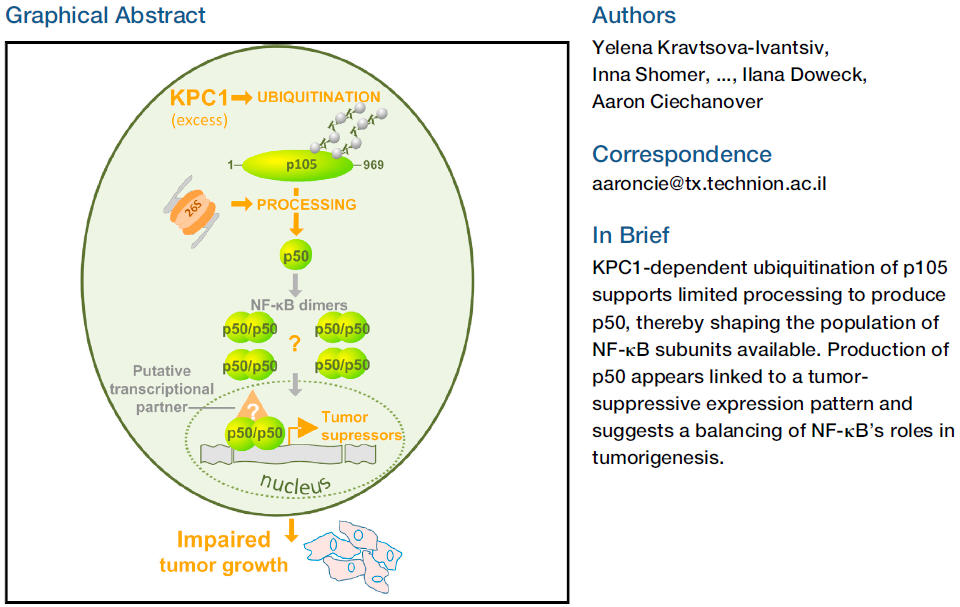
通常,达到蛋白酶体的蛋白质被完全分解,但也有一些例外,此研究检测了p105——细胞中一种关键调节器的长前体蛋白,称为NF-κB。原来,在某些情况下,p105在被泛素(ubiquitin)标记后可以完全分解,但其他情况下,它只是被切断并缩短,变成一种名为p50的蛋白质。
NF-κB已被确定为是炎症和癌症之间的一个联系。炎症过程和癌症之间存在联系的假设,是德国病理学家鲁道夫·魏尔啸(Rudolph Virchow,1821~1902)在1863年首次提出,并且多年来已有一系列的研究成功是其得以印证。自从NF-κB被发现近30年以来,已经发表了许多文章将其与恶性转化联系在一起。它以几种平行的方式,被卷入到多种器官肿瘤(如前列腺癌、乳腺癌、肺癌、头颈癌、大肠癌、脑瘤等),包括:抑制细胞凋亡,正常消除转化细胞;加速不受控制的癌细胞分裂;新血管形成(angiogenesis),这些对肿瘤的生长至关重要,并且增加了癌细胞对放疗和化疗的抵抗。
值得注意的是,前体p105是由泛素系统以2种平行而同样的普遍方式中的一种来“处理”的。它被完全毁坏,或者缩短并转换成p50。此研究破译了“决定哪个过程将应用于该蛋白”的决策机制:当一个称之为KPC1的泛素系统组件被卷入此过程,并使泛素附着于p105时,该蛋白被缩短变成p50。当泛素化由系统的另一无KPC1组件调停时,p105就会降解。
这2个选项之间的决策,对细胞有着重大影响,因为高水平KPC1(产生p50)和p50(此过程的产物)的存在——伴随着2个过程之间正常比率的破坏,可抑制恶性生长并明显保护健康组织。本研究是在小鼠模型中生长的人类肿瘤以及人类肿瘤样品上进行的,发现恶性抑制和2种蛋白质的水平之间存在一种强关联,从而清楚地表明,增加KPC1和/或p50在组织中的存在,可以保护其免受恶性肿瘤的影响(见上图)。
以色列癌症协会(Israel Cancer Society)主席阿龙•西查诺瓦(Aaron Ciechanover)教授指出:“建立研究并对肿瘤抑制机制获得一个坚实的理解,还需要很多年的时间。基于此发现开发一种药物是有可能的,但未必就是必然的,开发这样一种药物的道路漫长而艰难。”
更多信息请浏览原文:PIIS0092867415002548.pdf
也可以参考《科学日报》(ScienceDaily)网站相关报道:
http://www.sciencedaily.com/releases/2015/03/150304190120.htm
https://wap.sciencenet.cn/blog-212210-882269.html
上一篇:Nature报道:铹元素第一电离能为4.96 eV
下一篇:德一教师65,怀上四胞胎,即将成为17个孩子的母亲