博文
CETSA技术突破为研制好药铺平了道路
|||
CETSA技术突破为研制好药铺平了道路
诸平
CETSA不是羧乙基硫代丁二酸的缩写,它是cellular thermal shift assay(细胞热转变分析)的缩写。药物功效取决于药物与细胞目标(通常是一种蛋白质分子)的结合程度,以及由于过量的目标结合或者结合目标的解离而引起的副作用。细胞内的靶蛋白的衔接是受到有效药物浓度和调节蛋白质构象因素的影响,基于体外亲和力的研究难以对其有效性做出预测。但是,瑞典卡罗林斯卡医学院(Karolinska Institutet in Sweden)Martinez Molina等人,利用直接监测目标蛋白质与药物在细胞内的相互作用,由药物结合蛋白质引起蛋白质热稳定性的转变特征,来研究药物的作用机理,为研制更好的药物开辟了一条新途径。该方法可用于肿瘤细胞、小鼠肝脏和肾脏内的药物-目标衔接研究。
|
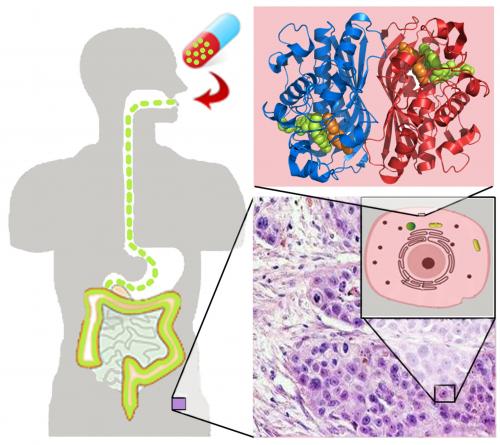
This illustration shows the path of a drug from a pill to a drug target. Credit: Daniel Martinez Molina |
图示是经口服药后,药物经过的路径和最终到达药物目标。卡罗林斯卡医学院的研究人员已经开发出直接测量药物达到目标细胞程度的首创方法。该方法在2013年7月5日出版的最新一期《科学》(Science)杂志上发表,这种方法对于提高开发新药物意义重大。详细内容见:Daniel Martinez Molina, Rozbeh Jafari, Marina Ignatushchenko, Takahiro Seki, E. Andreas Larsson, Chen Dan, Lekshmy Sreekumar, Yihai Cao, Pär Nordlund. Monitoring Drug Target Engagement in Cells and Tissues Using the Cellular Thermal Shift Assay. Science, 5 July 2013: Vol. 341 no. 6141 pp. 84-87. DOI: 10.1126/science.1233606.
通常使用的大多数药物是通过与一种或多种蛋白质相结合,影响其功能,达到治病之目的。但是有2个常见的瓶颈问题一直在困扰新药物开发,就是如何使药物能够正确识别目标蛋白质,是设计药物分子的过程中需要考虑的问题之一,识别目标之后能够有效地寻找到目标蛋白质并与其结合。在此之前,尚未出现可以直接测量药物分子定位和与靶蛋白结合效率的某种方法。现在, 卡罗林斯卡医学院的研究人员已经开发出一种新工具,称之为CETSA(即细胞热转变分析),它利用了当药物分子与目标蛋白质结合时,反而使其通常会变得更稳定这一概念。
卡罗林斯卡医学院医学生物化学与生物物理学系的首席研究员Pär Nordlund教授说,“我们已经表明,该方法适用于各种各样的目标蛋白质,而且允许我们直接测示药物分子在细胞内和动物模型体内是否达到其目标, 我们相信CETSA最终将有助于改善许多药物的效率,有助于更好药物分子的研发以及更有效的治疗方案的选择。”缺乏直接测量药物与靶蛋白结合的方法,已经在药物开发的许多阶段造成了一定程度的不确定性。在某些情况下, 候选药物在人体的临床试验结果并未达到预期效果,实际上就是出现了药物分子未能与适当的蛋白质结合所致。该研究小组认为,CETSA将是一个重要的控制阶段和对其他方法的补充。在目前已经发表的研究论文中,研究人员也考查了可能在细胞内导致耐药性的各种过程。研究团队认为,借助于CETSA的能力,确定现有药物是否适合个体患者,因此该方法对于开展个性化治疗的实践具有潜在应用价值。
卡罗林斯卡医学院医学生物化学与生物物理学系的Daniel Martinez Molina,也是将CETSA用于患者研究的负责人谈到,他们相信该方法可以为治疗癌症提供一个重要的诊断工具。例如,从原理上讲,CETSA可以使我们能够确定哪些药物对于肿瘤中的靶蛋白质是最有效的,这样完全有可能使临床医生确定初期治疗方案,对于肿瘤是否已经发展到产生某种抗药性以及何种类型的治疗可更适合特定病人无疑大有帮助。
https://wap.sciencenet.cn/blog-212210-705626.html
上一篇:戒烟新途径:纳米技术修复对尼古丁的依赖
下一篇:德国科学家解决了非经典2-降基碳正离子的结构问题(补充了C&EN)