博文
世界首次使用碱基编辑的CAR T细胞治疗耐药性白血病
 精选
精选
||
世界首次使用碱基编辑的CAR T细胞治疗耐药性白血病
诸平
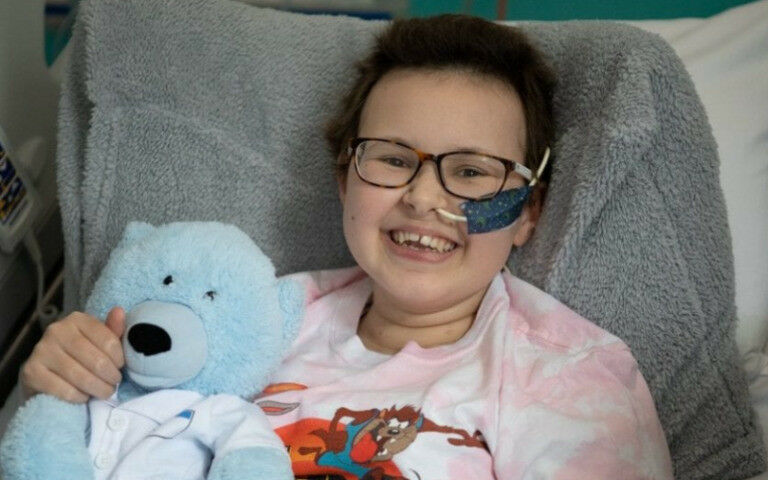


Fig. 1 Alyssa

Fig. 2 Professor Waseem Qasim (Professor Waseem Qasim's academic profile)
据英国伦敦大学学院(University College London简称UCL)2022年12月12日报道,世界首次使用碱基编辑的CAR T细胞治疗耐药性白血病(World-first use of base-edited CAR T-cells to treat resistant leukaemia)。上述图1(Fig. 1)就是在UCL接受碱基编辑的CAR T细胞治疗耐药性白血病的小患者艾丽莎(Alyssa)。
在UCL和大奥蒙德街儿童医院(Great Ormond Street Hospital for Children简称GOSH)之间的“从工作台到床边”的合作中,一名复发性T细胞白血病患者在世界首次使用碱基编辑细胞疗法中获得了碱基编辑的T细胞(base-edited T-cells)。
来自英国莱斯特(Leicester)的13岁患者艾丽莎于2021年被诊断出患有T细胞急性淋巴细胞白血病 (T-cell acute lymphoblastic leukaemia简称T'ALL)。她接受了目前治疗血癌的所有常规疗法,包括化疗和骨髓移植,但不幸的是,她的病又复发了,没有进一步的治疗选择。
艾丽莎是第一位参加 TvT 临床试验(TvT clinical trial)的患者,2022年5月,她被收入 GOSH的骨髓移植 (Bone Marrow Transplant简称BMT) 部门,接受从健康志愿捐助者身上预制的“通用”CAR T 细胞(‘universal’ CAR T-cells)。这些细胞已使用新的碱基编辑技术进行编辑,该技术由UCL的一组研究人员设计和开发,该团队由GOSH的名誉顾问(Honorary Consultant at GOSH)、UCL大奥蒙德街儿童健康研究所(UCL Great Ormond Street Institute of Child Health简称UCL GOS ICH)瓦西姆·卡西姆(Waseem Qasim)教授领导。
然后给她安装了嵌合抗原受体 (Chimeric Antigen Receptor简称CAR),使它们能够在不互相攻击的情况下追捕和杀死癌性T细胞。
仅 28 天后,艾丽莎病情缓解,并继续接受第二次骨髓移植以恢复她的免疫系统。现在,骨髓移植(BMT)后6个月,她在家里和家人一起恢复得很好,并继续在GOSH进行BMT后随访。如果没有这种实验性治疗,艾丽莎唯一的选择就是姑息治疗(palliative care)。
本周末(2022年12月16日),研究人员将在美国新奥尔良(New Orleans)举行的美国血液学会(American Society of Haematology)年会上首次展示这些数据。
伦敦大学学院大奥蒙德街儿童健康研究所 (UCL GOS ICH)细胞和基因治疗教授和GOSH的免疫学顾问瓦西姆·卡西姆教授说:“我们设计和开发了从实验室到临床的治疗方法,现在正在英国各地的儿童身上进行试验。这也是一种独特的从长凳上到床边的方法。艾丽莎的故事很好地展示了我们如何通过专家团队和基础设施,将实验室的尖端技术与医院为患者提供的实际结果联系起来。这是我们迄今为止最复杂的细胞工程,为其他新疗法铺平了道路并最终为患病儿童创造更美好的未来。我们在GOSH和伦敦大学学院拥有独特而特殊的环境,这使我们能够迅速扩大新技术的规模,我们期待着继续我们的研究并将其带给最需要它的患者。”
这种治疗的临床试验目前已经开始,旨在招募多达10名已用尽所有常规治疗方案的T细胞白血病患者。如果显示出广泛的成功,GOSH的骨髓移植和CAR T细胞治疗团队希望可以在儿童病情较轻的早期将其提供给儿童,并预计在2023年进一步应用于其他类型的白血病。英国国家医疗服务体系(NHS)专家管理来自全国各地的难以治疗的儿童白血病,他们讨论并将患者转介给此类试验。
GOSH骨髓移植和CAR T细胞治疗顾问罗伯特·谢莎(Robert Chiesa)博士说:“自从艾丽莎2021年5月患上白血病以来,她从未实现完全缓解。无论是通过化疗,还是在她第一次骨髓移植之后都未实现完全缓解。只有在她接受了CD7 CAR-T细胞疗法和在GOSH进行的第二次骨髓移植后,她才摆脱了白血病。这是非常了不起的,尽管它仍然是一个初步结果,需要在接下来的几个月内进行监测和确认。GOSH的整个团队都为艾丽莎和她的家人感到非常高兴,在过去的几个月里与他们一起工作是一种荣幸。她的勇敢给我们留下了深刻的印象,没有什么比看到她在医院外回到更正常的生活更让我高兴的了。”
GOSH和UCL GOS ICH的同一个团队于2015年首次实施了使用基因组编辑的T细胞 (CAR T-cells) 治疗B细胞白血病(B-cell leukaemia)和他们最近报告了使用 CRISPR/Cas9技术对儿童进行的试验。
2015年,在瓦西姆·卡西姆教授的带领下,GOSH和UCL GOS ICH的科学家们使用基因编辑技术创造了改良的T细胞,来治疗一名患有侵袭性B细胞急性淋巴细胞白血病的一岁儿童,该儿童化疗不成功,姑息治疗被认为是唯一的选择。这是世界上首次将基因编辑免疫细胞应用于人体。修改后的 T 细胞使用TALENs进行编辑,TALENs是一种早期的基因编辑形式。
2021年,进一步的试验证明了CRISPR/Cas9技术在B细胞急性淋巴细胞白血病(B-ALL)中的应用。相关研究结果于2022年10月26日已经在《科学转化医学》(Science Translational Medicine)杂志网站发表——Giorgio Ottaviano, Christos Georgiadis, Soragia Athina Gkazi, Farhatullah Syed, Hong Zhan, Annie Etuk, Roland Preece, Jan Chu, Agnieszka Kubat, Stuart Adams, Paul Veys, Ajay Vora, Kanchan Rao, Waseem Qasim, For The TT52 CRISPR-CAR Group. Phase 1 clinical trial of CRISPR-engineered CAR19 universal T cells for treatment of children with refractory B cell leukemia. Science Translational Medicine, 26 Oct 2022, 14(668). DOI: 10.1126/scitranslmed.abq3010. https://www.science.org/doi/10.1126/scitranslmed.abq3010
然而,以这种方式治疗其他一些类型的白血病更加困难,因为设计用于识别和攻击癌细胞的 T细胞在实验室的制造过程中最终也会互相残杀。需要多次额外的DNA改变才能为这项研究生成“通用”抗T细胞CAR T细胞库。
为了创建这些细胞,由安东尼·诺兰登记处(Anthony Nolan registry)安排的健康供体T细胞在大奥蒙德街医院(Great Ormond Street Hospital)洁净室设施中进行了四次单独更改。这些步骤是:
1 去除现有的受体,这样来自供体的T细胞就可以在不匹配的情况下被储存和使用——使它们“通用”。(Removing existing receptors so that T-cells from a donor can be banked and used without matching – making them ’universal’.)
2删除称为CD7的“标志”,将它们标识为 T 细胞(CD7 T 细胞标记)。如果没有这一步,被编程为杀死 T 细胞的 T 细胞最终只会通过“友军误伤”摧毁产品。(Removing a ’flag’ called CD7 that identifies them as T-cells (CD7 T-cell marker). Without this step T-cells programmed to kill T-cells would simply end up destroying the product through ’friendly-fire’.)
3删除称为CD52的第二个“标志”。这使得经过编辑的细胞对于治疗过程中给予患者的一些强效药物是不可见的。(Removing a second ’flag’ called CD52. This makes the edited cells invisible to some of the strong drugs given to the patient during the treatment process.)
4添加识别白血病T细胞上CD7 T细胞受体的嵌合抗原受体 (CAR)。这些细胞开始对抗 CD7,识别并对抗T细胞白血病。(Adding a Chimeric Antigen Receptor (CAR) which recognises the CD7 T-cell receptor on leukemic T-cells. The cells become armed against CD7 and recognise and fight T cell leukaemia.)
这些编辑是通过“碱基编辑”实现的——化学转换携带特定蛋白质指令的单核苷酸碱基(DNA 代码的字母)。例如,将CD7基因中的特定核苷酸碱基从胞嘧啶(cytosine)改变为胸腺嘧啶(thymine)会产生一个“终止密码子”( ‘stop codon’)——相当于基因句号——阻止细胞机器读取完整指令并终止CD7的产生。
结果是经过编辑的CAR T细胞可以提供给患者,以便他们快速找到并破坏体内的T细胞,包括白血病T细胞。如果成功,则患者将接受骨髓移植以恢复其衰竭的免疫系统。
以前的治疗依赖于称为TALENS或CRISPR/Cas9的技术,通过分子“剪刀”的切割来传递基因变化。新的碱基编辑方法不会导致DNA断裂,允许进行更多编辑,同时降低了对染色体产生不良影响的风险。该技术也正在研究中,以尝试纠正各种遗传疾病的DNA代码的有害变化。
英国医学研究委员会(Medical Research Council简称MRC)翻译负责人露易丝·琼斯(Louise Jones)博士通过他们的发展途径资助计划(Developmental Pathway Funding Scheme)资助了该项目。露易丝·琼斯博士说:“我们很高兴听到这种治疗的有希望的结果以及它为艾丽莎和她的家人带来的希望。先进的疗法——基于基因、组织或细胞的药物——有可能改变那些患有难以治疗的疾病的人的生活,并且仍然是MRC的优先考虑事项。如果被复制,这种“现成的”通用细胞疗法将标志着这些类型的疗法向前迈出了一大步,为更多患者带来了改变生活的益处。”
该试验由英国医学研究委员会资助。对更广泛的研究计划的支持还来自惠康(Wellcome)、血癌英国(Blood Cancer UK)和英国国家健康与护理研究所 (National Institute of Health and Care Research简称NIHR) 以及NIHR GOSH生物医学研究中心(NIHR GOSH Biomedical Research Centre)。
这些细胞的制造是伦敦大学学院大奥蒙德街儿童健康研究所瓦西姆·卡西姆教授领导的一项长期研究计划的一部分,他也是GOSH的名誉顾问。得益于大奥蒙德街医院儿童慈善机构 (GOSH Charity) 的早期资助,瓦西姆·卡西姆教授一直是使用创新基因编辑技术开发新型 CAR T细胞疗法的先驱。
研究团队要感谢安东尼·诺兰(Anthony Nolan)提供捐献者T细胞和所有捐献给登记处的捐助者。
艾丽莎的故事(Alyssa’s story)
据报道,艾丽莎是世界上第一位接受碱基编辑细胞疗法的患者,目前正在家中康复。艾丽莎和她的家人对现在无法检测到白血病感到乐观,但知道她需要密切监测一段时间。
13岁的阿丽莎一直是她护理决策的核心。她说:“一旦我这样做了,人们就会知道他们需要做什么,不管怎样,所以这样做会帮助人们——我当然会去做。”
艾丽莎于2021年5月被诊断出患有T细胞白血病,此前家人认为她经历了很长一段时间的感冒、病毒感染和全身疲倦。虽然她在莱斯特(Leicester)和谢菲尔德(Sheffield)的医院接受标准疗法(化学疗法和骨髓移植)治疗,但不幸的是,这些团队无法控制她的癌症并使其缓解。
由于唯一的选择是姑息治疗,艾丽莎和她的家人与GOSH的骨髓移植和CAR T细胞治疗专家广泛讨论了这项临床试验,并决定率先尝试对她的白血病进行实验性治疗。
艾丽莎的妈妈基奥纳(Kiona)说:“医生说头6个月是最重要的,我们不想变得太武断,但我们一直在想‘如果他们能摆脱它,就一次,她就会好的。’也许我们的选择是对的。”
“艾丽莎非常成熟,你可以忘记她只是个孩子,但希望这可以证明研究有效,他们可以将其提供给更多的孩子。如果所有这些都需要有目的,就感觉太无意义了。现在我们是试图在约定之间生活。艾丽莎想回到学校,这可能很快就会成为现实。她已经在取笑她的弟弟,因为他不得不回去参加秋季学期。”
“说实话,我们都飘飘欲仙了——能回家真是太棒了!”
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
Autologous chimeric antigen receptor T (CAR T) cells are a standard therapy for pediatric B cell acute lymphoblastic leukemia (B-ALL); however, this treatment requires time and personalization that can impede treatment. To overcome this, Ottaviano et al. used CRISPR-Cas9 editing to disrupt T cell receptor α chain and remove CD52 in CAR19 T cells (TT52CAR19 T cells) to create a universal cell therapy. They treated patients with CD19+ B-ALL in a phase 1 trial that reached primary safety objectives, providing evidence of the therapeutic potential of CRISPR-engineered cell therapy that will require further investigation.
Genome editing of allogeneic T cells can provide “off-the-shelf” alternatives to autologous chimeric antigen receptor (CAR) T cell therapies. Disruption of T cell receptor α chain (TRAC) to prevent graft-versus-host disease (GVHD) and removal of CD52 (cluster of differentiation 52) for a survival advantage in the presence of alemtuzumab have previously been investigated using transcription activator–like effector nuclease (TALEN)-mediated knockout. Here, we deployed next-generation CRISPR-Cas9 editing and linked CAR expression to multiplexed DNA editing of TRAC and CD52 through incorporation of self-duplicating CRISPR guide RNA expression cassettes within the 3’ long terminal repeat of a CAR19 lentiviral vector. Three cell banks of TT52CAR19 T cells were generated and cryopreserved. A phase 1, open-label, non-randomized clinical trial was conducted and treated six children with relapsed/refractory CD19-positive B cell acute lymphoblastic leukemia (B-ALL) (NCT04557436). Lymphodepletion included fludarabine, cyclophosphamide, and alemtuzumab and was followed by a single infusion of 0.8 × 106 to 2.0 × 106 CAR19 T cells per kilogram with no immediate toxicities. Four of six patients infused with TT52CAR19 T cells exhibited cell expansion, achieved flow cytometric remission, and then proceeded to receive allogeneic stem cell transplantation. Two patients required biological intervention for grade II cytokine release syndrome, one patient developed transient grade IV neurotoxicity, and one patient developed skin GVHD, which resolved after transplant conditioning. Other complications were within expectations, and primary safety objectives were met. This study provides a demonstration of the feasibility, safety, and therapeutic potential of CRISPR-engineered immunotherapy.
https://wap.sciencenet.cn/blog-212210-1367838.html
上一篇:全球临床实验性癌症治疗在70%以上的患者中获得成功
下一篇:西中研究人员合作发现唐氏综合症患者自发性大脑活动的差异