博文
[转载]早期呼吸道感染和免疫发育决定终生肺部健康
||

呼吸道感染在婴幼儿中很常见,会导致儿童经常出现哮喘、呼吸困难和呼吸窘迫,是5岁以下儿童住院的最常见原因。
在生命早期接触各种细菌和病毒是不可避免的,这对免疫系统的健康发育至关重要。随着孩子的成长,免疫系统也在发育和成熟,因此,在这段动态变化的时间里,感染的影响可能会产生长期的后果。
婴幼儿免疫系统的发育与呼吸道粘膜表面的微生物群具有相互作用。虽然病毒感染似乎是早期喘息/呼吸窘迫发作的关键触发因素,但暴露于某些细菌物种可以起到保护作用。
本文重点讲述生命早期呼吸道感染如何影响终生呼吸系统健康,结合了关于婴幼儿免疫成熟自然轨迹的最新数据,以及在这一关键发育时期发生的呼吸道感染的性质和类型如何影响免疫。
与呼吸系统疾病有关的术语表
阻塞性肺病——气道收缩或闭塞,使人难以呼出空气。与慢性阻塞性肺病、哮喘、支气管扩张、囊性纤维化和细支气管炎有关。
限制性肺病——肺部更硬,使肺部更难扩张以吸入空气。与肺纤维化、神经肌肉疾病和肥胖相关。
肺表面活性剂——由肺泡II型肺细胞产生的特定脂质、蛋白质和碳水化合物的复杂混合物,具有降低肺泡气液界面表面张力的功能。
气管吸入——一种非侵入性方法,从插管和通气的患者中获取含有气道分泌物的深层呼吸样本。
呼吸道吸入物——通常从鼻咽部获得,含有呼吸道分泌物。
支气管肺泡灌洗——通常在支气管镜检查中获得,在注入生理盐水后获得的下呼吸道液体样本。
支气管镜检查——一种微创手术,将一根带有摄像头和光源的细管(支气管镜)通过鼻子或喉咙进入气道,并进入气道进行采样。
毛细支气管炎——一种常见于婴幼儿的疾病,由一系列不同的病原体引起,但通常是呼吸道合胞病毒。伴有呼吸困难、喘息性咳嗽和粘液增多。
气液界面培养——将气道细胞三维培养的技术。培养物的基侧处于培养基中,液体从培养物的上部抽出,这促进了构成气道的不同上皮细胞的分化,包括那些有跳动的纤毛和产生粘液的上皮细胞。
生命早期呼吸道感染是终生肺部健康的一个指标
生命早期的呼吸道感染会对发育中的肺部和免疫系统产生深远的影响。
来自全球的各项研究证据表明,对一些儿童来说,生命早期呼吸道感染会导致严重的终生呼吸道疾病,并可能影响其他合并症的发生,如心血管疾病、糖尿病和抑郁症。
在英国,大约一半的儿童在6岁之前至少经历过一次哮喘,几乎所有的哮喘都是由呼吸道合胞病毒(RSV)或鼻病毒(RV)引起的下呼吸道病毒感染引起的。
注:在英国因急性哮喘发作而入院的患者中,6岁以下儿童占75%。至少有三分之一的6岁以下急性呼吸窘迫儿童在童年时有反复发作的喘息。
随着学龄前儿童呼吸道感染的不断增加,了解为什么一些儿童对常见的季节性病原体有严重的、异常的免疫反应,以及这些多重感染对儿童及以后的免疫和肺部发育的影响是至关重要的。
▼
生命早期感染和长期肺功能相关
√早期下呼吸道感染的儿童肺功能降低
来自欧洲150,090名儿童的个体研究数据显示,早期(6个月至5岁)下呼吸道感染儿童的肺功能明显较低,学龄期(中位7岁)患哮喘的风险也较高。
√肺功能模式与相关疾病
在塔斯马尼亚纵向健康研究(n=2422)中,对7岁学龄儿童至53岁的成年人进行了随访,确定了四种终生肺功能模式:
(1)阻塞性肺功能模式,与哮喘和慢性阻塞性肺疾病(COPD)等呼吸道疾病有关(25%);
(2)限制性肺功能模式,通常见于肺间质性和实质性疾病(10%);
(3)阻塞性和限制性混合(3.5%);
(4)肺功能正常(60%)。
53岁时慢性阻塞性肺疾病患病率以混合型最高,其次为阻塞性。这种混合模式与儿童呼吸道疾病和成人哮喘有关。
限制性模式的非呼吸系统疾病患病率最高,包括成人肥胖、糖尿病、心血管疾病、高血压和阻塞性睡眠呼吸暂停。
注:在低收入和中等收入国家的队列中也显示出对早期下呼吸道感染的不良影响。
√低肺功能与反复的喘息和严重的哮喘有关
在成年早期未能达到最大肺功能会导致慢性阻塞性肺疾病的风险增加。
英国两个大型队列(n=1046)的肺功能轨迹显示,从学龄前到成年的持续低肺功能可归因于反复发作的喘息和严重的哮喘发作;并且来自美国的独立队列显示,在生命的第四个十年中,低肺功能与早期呼吸道合胞病毒感染和儿童哮喘有关。
!
注意
到目前为止,没有证据表明在生命的前5年过后肺功能会恢复。此外令人担忧的是,现在有证据表明,持续的低肺功能会增加早期全因死亡率的风险。
从出生到成年的肺功能轨迹
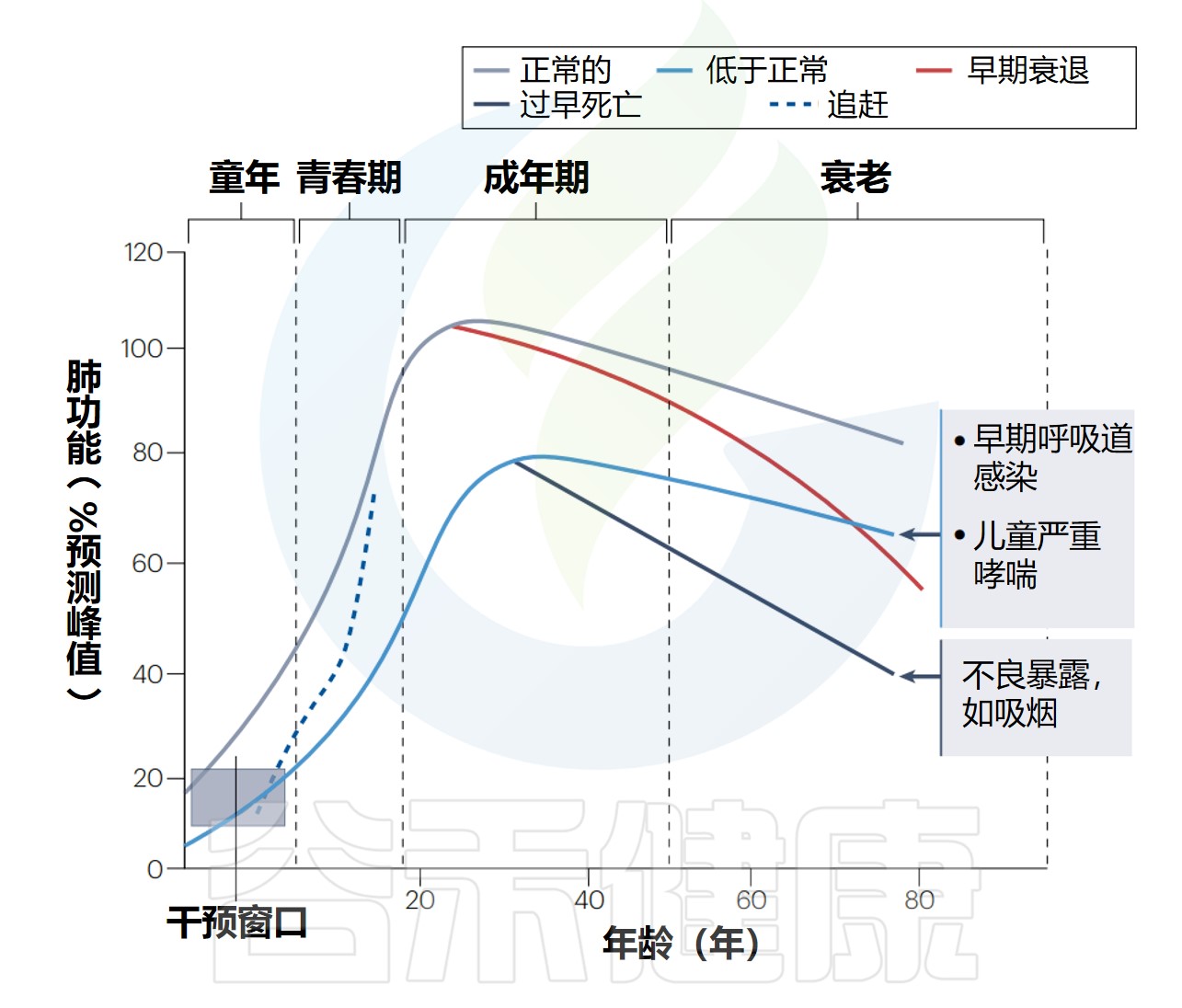
Lloyd CM,et al.Nat Immunol.2023
解读:肺功能发育正常的例子(灰线),在成年早期达到预期的峰值,随后在正常的衰老过程中缓慢下降。
成人接触不良环境(如吸烟)可能会加速下降。由于不良的早期生活事件,如复发性呼吸道感染和严重的儿童哮喘(蓝线),未能在成年早期(20岁)达到“正常”肺功能峰值,导致成年肺部疾病的风险增加,即使在成年期间肺功能可能没有任何加速下降。
免疫在生命早期的发育
现在人们普遍认为,免疫成熟是在出生后的几天和几个月内按照规定的过程发生的。
虽然大部分信息来自小鼠模型,但新方法和技术的出现促进了免疫细胞在非常小的样本中的蛋白质组学和转录组学细节,揭示了免疫发育的正常轨迹。
检查这种免疫发育轨迹是至关重要的,以便了解偏离标准如何导致呼吸系统健康状况不佳。
▼
胎儿的胎龄与免疫相关
将早产儿和足月儿纳入研究表明,他们的免疫状况在出生时有所不同。
“
早产儿的促炎信号更强烈
发现早产与强烈的促炎信号有关,其特征是趋化因子CXCL11和CXCL8的表达增强。
CXCL11是一小分子的细胞因子属于CXC趋化因子家族,又被称作“干扰素诱导的T细胞a趋化因子”
CXCL8是CXC趋化因子家族的一员,是炎症反应的主要介质编码的蛋白质
“
新生儿的免疫系统具有更多的个体差异
总的来说,与成年人相比,新生儿免疫系统表现出更多的个体差异,突出了这一关键窗口期免疫的动态性。
“
出生后免疫细胞组成发生变化
此外,出生后免疫细胞组成发生变化,中性粒细胞数量减少,CD4+和CD8+ T细胞比例增加。
出生前3个月是B细胞、自然杀伤细胞和树突状细胞表型发育的关键时期,这些表型受环境因素的影响。当单核细胞在出生后的第一个月扩充和收缩时,B细胞的数量从第一个月开始增加。
另一项研究分析了剖宫产足月婴儿血液中的免疫细胞成分。通过刺破脚跟获得的血液与匹配的脐带血进行比较,发现免疫细胞在出生后几小时内就发生了快速变化。
胎儿(脐带血)和新生儿(脚后跟刺破)样本的基本免疫表型比例相同。效应T细胞增殖增加,这些效应T细胞表现出增强的细胞因子分泌能力。
▼
免疫细胞与年龄相关的变化
研究人员通过检查器官捐献者的血液、淋巴组织和粘膜组织,绘制了60年来人类T细胞区隔化的空间图。他们揭示了与年龄相关的一些T细胞亚群在体内特定部位的比例变化。
“
淋巴组织中的T细胞发生了动态变化
淋巴结发生了动态变化,而粘膜部位的T细胞表型保持更稳定。表达组织驻留记忆T细胞(TRM)特征的效应记忆T(TEM)细胞亚群主要分布在粘膜部位,而淋巴组织内的效应记忆T细胞亚群在整个生命过程中都有变化。
“
儿童与成人之间的免疫细胞数量不同
对从婴儿器官供体收集的淋巴组织和粘膜组织中收集的T细胞进行的更系统的分析显示,T细胞分化和调节功能在生命的前2年进行早期划分。
调节性T细胞在儿童组织中占CD4+ T细胞的比例相对较高(30-40%),而在成人组织中则低得多(<10%)。
来自婴儿供体的T细胞可以抑制内源性T细胞活化,并且早期T细胞功能仅限于最低Treg:TEM细胞比率的粘膜部位,这表明早期生活中T细胞反应的局部控制。
▼
出生后暴露可增强先天免疫
产后暴露可导致先天免疫训练,从而通过表观遗传组蛋白修饰产生持久的程序,增强或减弱细胞因子反应。
产后暴露不仅包括环境因素,如感染史和污染,还包括生活方式,如营养、压力、吸烟、与兄弟姐妹一起生活等。这些因素一起影响发育中的新生儿免疫系统。
“
粘膜相关不变T细胞对免疫影响巨大
非常规T细胞,如粘膜相关不变T(MAIT)细胞,在生命早期对来自局部微生物群的信号有反应,这对组织免疫的调节具有终身影响。有证据表明,粘膜相关不变T细胞与皮肤局部微生物群之间的相互作用对于促进组织损伤后的伤口修复至关重要。
尽管我们知道粘膜相关不变T细胞细胞在成人肺中大量存在,并且被认为在控制呼吸道病毒感染中起重要作用,但尚未在儿童肺中进行研究。
由于先天免疫细胞对疫苗接种的成功至关重要,并且受每次接触的水平和性质的影响,因此了解这些不同的接触如何影响免疫系统的各个分支,以了解如何促进充分的免疫增强非常重要。
微生物群对肺免疫发育的影响
先进的测序技术揭示了人体是一个由细菌、真菌、病毒和寄生虫组成的复杂生态系统。这种微生物群普遍存在于包括肺在内的粘膜屏障部位,尽管其密度远低于肠道。
★ 微生物群与免疫系统的相互作用至关重要
微生物群与免疫系统的相互作用现在被认为对免疫发育和疾病预防至关重要。局部微生物群落和免疫细胞之间的密切相互作用促进了从对母体和自身抗原的耐受到对促进疾病的因子的保护的转变。
因此,生命早期可能是微生物生态失调破坏免疫发育的关键阶段。
▼
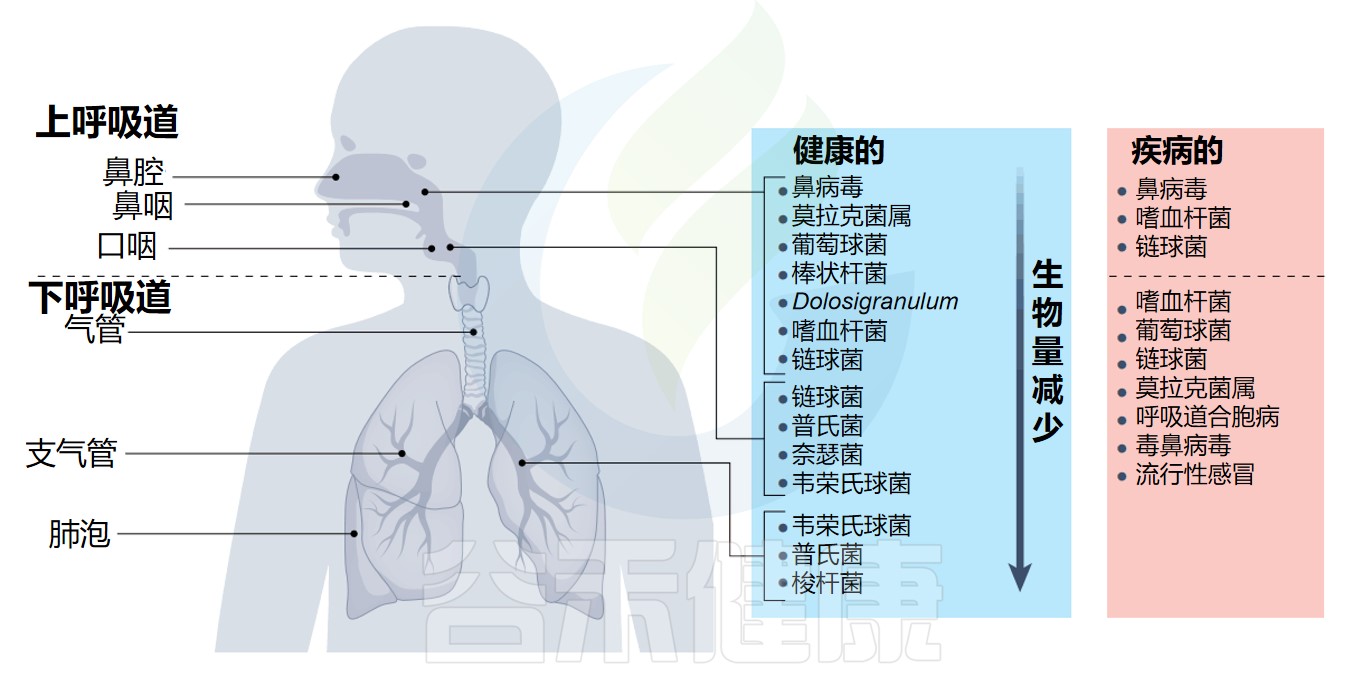
呼吸道的结构
呼吸道是一个复杂的系统,分为不同的区域:上呼吸道包括鼻腔、咽部和喉部,下呼吸道包括传导气道(气管和支气管)、小气道(细支气管)和肺泡。
在健康或疾病时,微生物群在呼吸道的不同区域定植
Lloyd CM,et al.Nat Immunol.2023
总的来说,这个大的表面积容纳了一系列不同的微生物群落,其中最高的细菌负荷位于上呼吸道内。
▼
肺部微生物群
一般认为,新生儿在出生时收集了其最初的微生物种类。这些微生物主要来源于母体,由阴道、肛门、直肠和皮肤微生物群组成,其组成取决于分娩方式。
根据解剖生态位和环境影响施加的局部选择压力,这种最初均匀的细菌物种“初始包”迅速多样化。在金黄色葡萄球菌(Staphylococcus aureus)最初占优势后,鼻咽微生物群迅速多样化,棒状杆菌(Corynebacterium)和狡诈球菌属( Dolosigranulum )的定植和生长。
从6周大开始,莫拉克菌属(Moraxella)开始繁殖,并最终在3个月大时占主导地位。微生物群在出生后7周在呼吸道中成熟,并建立了多样性。
▸ 上呼吸道的微生物群
口咽菌群是上呼吸道所有生态位中最多样化的,与鼻咽相比,幼儿和成人的微生物组成相似,由厌氧菌属组成,如链球菌(Streptococcus)、普雷沃氏菌(Prevotella)、奈瑟菌(Neisseria)和韦荣氏球菌(Veillonella)。
注:最近对出生第一周婴儿样本的分析显示,口咽和鼻腔代表着细菌和真菌的不同生态位。
▸ 下呼吸道的微生物群
下呼吸道环境特别专门化,反映了特定的环境。例如,肺表面活性剂的分泌有助于形成富含磷脂的环境,从而有助于维持更多样化的微生物群。
注:考虑到下气道的不可接近性,对这个生态位进行采样是具有挑战性的,研究使用气管吸入物作为细菌的来源。
虽然下呼吸道的总生物量较低,但健康婴儿的微生物群在出生后的前2个月内发育,并随着时间的推移而增加。
链球菌是下呼吸道的关键物种
观察到韦荣氏球菌属(Veillonella)、普雷沃氏菌(Prevotella)和梭杆菌(Fusobacterium),并确定链球菌(Streptococcus)是下呼吸道微生物群落结构的关键物种。
▼
肺部微生物群的作用
尽管人们普遍认为肠道微生物群在免疫发育中起着至关重要的作用,但对局部肺微生物群的作用却知之甚少。
✦防止不必要的免疫反应
研究认为,生命早期的微生物群在建立耐受原免疫途径中起着重要作用,以防止对自身抗原和无害的吸入抗原(如过敏原)产生不必要的免疫反应。
✦诱导调节性T细胞
对肠道共生体的分析表明,梭菌(Clostridia)通过转化生长因子-β在小鼠和人类结肠中诱导FOXP3+Treg细胞,而脆弱拟杆菌(Bacteroides fragilis)通过Toll样受体2的参与诱导Treg细胞
普雷沃氏菌(Prevotella)、罗氏菌属(Roseburia)和韦荣氏球菌(Veillonella)在下呼吸道的富集与典型TH17细胞因子谱呈正相关,白细胞介素-1α (IL-1α), IL-1β, IL-6和IL-17增加,并伴有TH17和中性粒细胞在肺部的募集。
✦肺部微生物多样性与长期肺部健康相关
对一组出生后最初几个月的儿童气道吸入物的检查显示,1个月时的微生物多样性与6岁时的哮喘有关。
具体来说,韦荣氏球菌(Veillonella)和普雷沃氏菌(Prevotella)的相对丰度与呼吸道免疫相关,其特征是CCL2和CCL17增加,肿瘤坏死因子和白细胞介素1β减少。
CCL2——趋化因子配体2,可招募单核细胞、记忆性T细胞和树突状细胞到组织损伤或感染引起的炎症位点。
CCL17——又称胸腺和激活调节趋化因子(TARC),是一种强大的趋化因子,通常与2型免疫反应相关,其编码基因在人类中位于16号染色体上。
小结
尽管大多数研究使用小鼠模型来检查呼吸道微生物生态系统与发育中的免疫系统之间的关系,但似乎很有可能呼吸道免疫弹性降低和肺部微生物群多样性沿着共同的轨迹发展,以促进肺部健康。
早期接触传染因子影响免疫发育
生命的最初几周是微生物在粘膜表面定植的关键时期。然而,理想的微生物丰富度和多样性可能会被感染或抗生素治疗等事件所破坏,这些事件会影响自然发育过程,有时会产生持久的影响。
出生时胎龄是微生物成熟和多样性的关键驱动因素,也是出生方式和喂养方式的关键驱动因素。微生物群结构的其他重要决定因素包括环境因素,如兄弟姐妹的存在,环境污染,以及感染史。
肺免疫和微生物组受到一系列内在和外在因素的影响
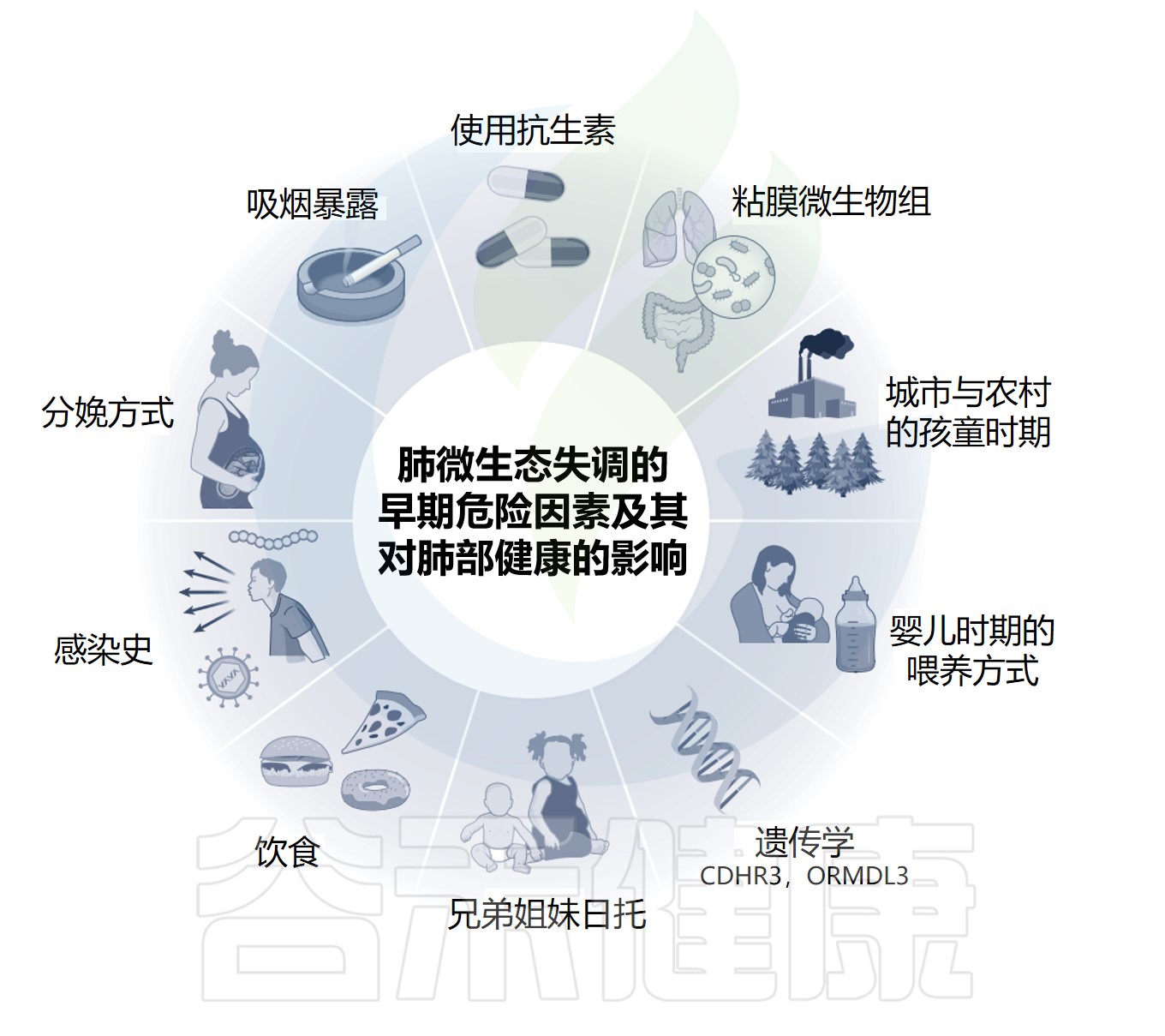
Lloyd CM,et al.Nat Immunol.2023
免疫力和微生物组在整个生命过程中可能遇到的各种因素的影响,但由于婴儿正处于紧张的发育期,他们特别容易受到影响。
免疫系统和微生物组之间的局部关系是高度动态的,外部刺激和生活方式的选择可能导致肺生态位内细胞和细菌群落的振荡,甚至可能对肺功能产生终身影响。
在生命的第一年导致下呼吸道疾病的两种最常见病原体包括呼吸道合胞病毒和人类鼻病毒。
▼
呼吸道合胞病毒导致哮喘增加
许多观察性研究报道,反复出现的病毒性下呼吸道感染,尤其是严重的下呼吸道感染,与儿童反复喘息和哮喘发作增加有关。
一项由35项研究组成的系统综述和荟萃分析估计,呼吸道合胞病毒下呼吸道感染对儿童喘息性疾病具有直接影响。
•免疫预防可能改变呼吸道细菌组成
在8项介入研究中评估呼吸道合胞病毒免疫预防对哮喘的保护作用时,虽然观察到保护作用,但效果并不显著。
接受呼吸道合胞病毒免疫预防的早产儿在1岁和6岁时的上呼吸道微生物组的特征是:在1岁时葡萄球菌(Staphylococcus)明显减少;在6岁时与更多的嗜血杆菌(Haemophilus)和明显减少的莫拉克菌(Moraxella)。
这表明呼吸道合胞病毒免疫预防与改变呼吸道细菌微生态失调之间的相互作用可能与疾病保护有关。
▼
早期感染鼻病毒与呼吸道疾病的易感性增加相关
另一个队列包括1304份鼻咽样本,这些样本是从连续11次定期采样中获得的,以及在生命第一年急性呼吸道感染期间获得的。
呼吸道病毒的定量PCR检测显示,早期无症状的鼻病毒与以后呼吸道感染的易感性增加和复发相关。
直到最近,鼻病毒被认为是一种只引起上呼吸道感冒症状的病毒,对下呼吸道疾病影响不大;然而,我们现在了解到三种鼻病毒 (RV-A, RV-B和RV-C)可能诱导不同的感染模式和毒力。
•个人因素影响呼吸道疾病的严重程度
个人因素,如肺功能和免疫,特别是与年龄相关的因素(例如干扰素)反应在幼儿中较低,可能部分解释了这个年龄组鼻病毒疾病的严重程度,并影响鼻病毒感染的下呼吸道结局。
鼻病毒的粘膜免疫反应至关重要;伴有变应性炎症的干扰素反应的质量影响鼻病毒喘息的风险。
几种宿主因素导致严重鼻病毒疾病和喘息的风险增加。年轻时易患喘息或发热性疾病,尤其是RV-C感染。遗传因素也会增加鼻病毒相关喘息的风险。17q12-21区单核苷酸多态性与急性喘息和哮喘发展相关。
▼
生命早期呼吸道感染与未来的呼吸道疾病相关
在调查生命早期呼吸道感染和未来的喘息/哮喘和肺功能影响的研究中,发现与特定病原体(鼻病毒或呼吸道合胞病毒)及细菌(莫拉氏菌、嗜血杆菌、链球菌、葡萄球菌)之间的关联有关。
•特定病原体和细菌与呼吸道疾病风险相关
与定义肺功能轨迹类似,在出生队列中也描述了微生物组轨迹,并与复发性喘息和哮喘的风险相关。
参与哮喘童年起源研究的儿童(N=285)在7个时间点提供了鼻咽粘膜样本,健康时相隔1-3个月,生命的头2年,急性呼吸道疾病期间提供了额外的样本。6岁、11岁、13岁和18岁时的发育微生物群轨迹与哮喘有关。
生命最初6个月的葡萄球菌优势菌群与3岁时复发性喘息和整个儿童期持续哮喘的风险增加有关。在急性喘息疾病中,鼻病毒的检测和莫拉菌的优势与整个儿童后期持续存在的哮喘相关。
▼
病毒、细菌、免疫相互作用影响呼吸道疾病风险
最近,一项包括美国247家医院婴儿的前瞻性研究证明了特定病毒、细菌种类、免疫反应和代谢后遗症之间相互作用的重要性:研究对象是因毛细支气管炎住院的婴儿(小于1岁)。
研究过程
在初次急性发作期间收集临床资料和鼻咽样本,以评估微生物组、呼吸道病毒、细胞因子和代谢组谱。
随后,对这些婴儿进行随访至5岁,并对病毒和微生物、炎症和代谢组学特征进行无偏见的综合分析,以确定与喘息和哮喘持续存在相关的不同感染模式,而不是症状缓解。
对13%经历过鼻病毒相关性细支气管炎的婴儿分析定义了一个特定的RV-C儿童亚组,莫拉菌优势加上2型高细胞因子反应,预测3岁时持续喘息和5岁时哮喘风险增加。
住院的呼吸道合胞病毒毛细支气管炎患儿中,IgE致敏和呼吸道合胞病毒/鼻病毒共感染比例高、链球菌/莫拉克菌共优势、IFNα和IFNγ反应高的组发生哮喘的风险明显更高。
!
注意
从一岁前采集的上呼吸道样本中出现了一种模式,将症状前病毒(鼻病毒和呼吸道合胞病毒优势)和微生物谱(莫拉克菌、嗜血杆菌、链球菌优势)与随后的喘息/哮喘风险联系起来。
在急性发作期间病原体生态失调,病毒和细菌谱的类似改变也与随后的呼吸道疾病有关。
上、下呼吸道微生态失调的关系
缺乏证据表明上呼吸道微生物群与病毒检测和下呼吸道微生物群之间存在关系。这一点至关重要,因为我们知道,长期的有害后果与生命早期出现的下呼吸道疾病密切相关,而与上呼吸道症状无关。
纵向收集儿童下呼吸道样本极具挑战性;因此,数据主要依赖于临床指征手术(如支气管镜检查)期间采集的横断面样本。
将同一患者的咽拭子与支气管肺泡灌洗液中的微生物组进行比较,发现同一患者的上下气道样本在α多样性(丰富度、均匀度或Shannon多样性指数)方面没有差异,而个体之间的差异大于上下气道样本之间的差异。
进一步支持上呼吸道和下呼吸道样本之间关系的是,在患有严重复发性喘息的学龄前儿童无症状稳定疾病期间,在支气管肺泡灌洗样本中发现了不同的簇。
从下呼吸道样本中描述的鼻病毒/莫拉菌属/特应性集群在患有严重喘息的儿童3岁时表现出与第一次下呼吸道疾病期间婴儿队列中发现的非常相似的呼吸道微生态失调,这是哮喘发生的最大风险。
生命早期对微生物群的操纵以调节免疫反应
在免疫和肺部发育的关键时期(生命的前5年),外部暴露(环境、病毒和细菌感染)之间的平衡决定了先天免疫反应和健康的肺功能,或导致肺功能下降和不可逆且长期预后不良的病理反应。
需要在这一免疫和肺部发育时期采取有针对性的干预措施,以便赶上肺部生长和疾病改变。
下图展示了早期呼吸道感染、环境暴露、宿主免疫反应与终生肺部健康之间的相互作用:
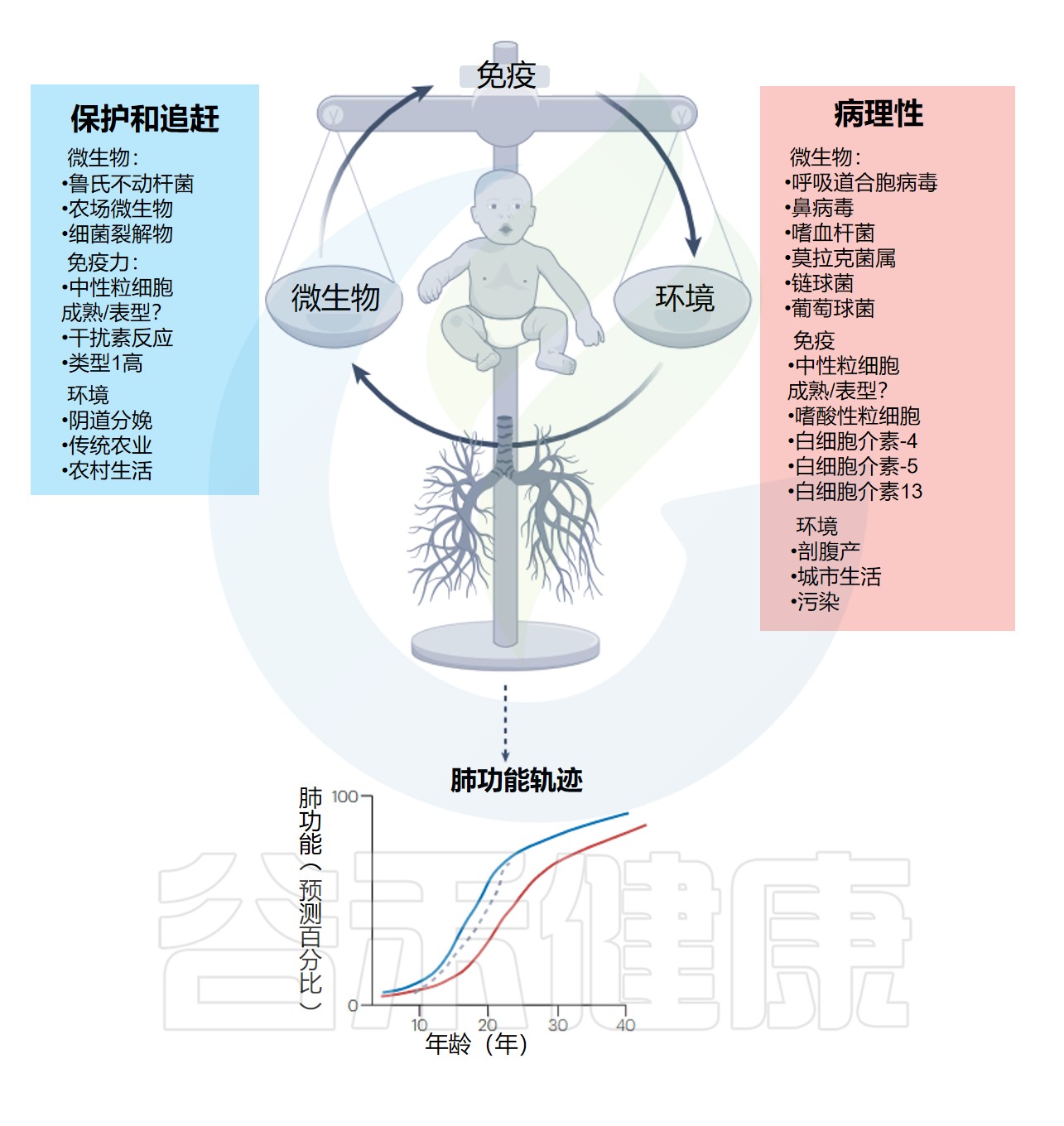
Lloyd CM,et al.Nat Immunol.2023
▷
特定的环境对儿童哮喘和过敏性疾病有保护
流行病学数据表明,特定的环境暴露对儿童哮喘和过敏性疾病提供了强有力的保护,并可能提高对感染性病原体的先天免疫反应的效率。
这种保护作用最好的例子也许是阿米什儿童和哈特派信徒儿童的比较。
阿米什实行传统农业,因此孩子们在整个童年时期,甚至在出生前,都与农场和动物密切接触。
相比之下,哈特派人使用工业化农业方法,因此家庭往往与他们的动物和农场分开居住。
阿米什儿童的哮喘和喘息的患病率要低4倍,而哈特派儿童的患病率与北美土著人口相同。
▷
不同环境下儿童先天免疫细胞存在显著差异
值得注意的是,两组儿童在先天免疫细胞的比例、表型和功能方面存在显著差异。
与动物接触密切的儿童中性粒细胞较高
具体来说,阿米什儿童有较高的循环中性粒细胞,其独特的表型表现为CXCR4和CD11b的表达减少,这可能是由于持续的环境微生物暴露导致的不成熟的表型。
趋化因子受体CXCR4是趋化因子基质细胞衍生因子-1(CXCL12)的特异受体。
与动物接触密切的儿童T细胞活性较高
对T细胞表型的分析表明,阿米什儿童表现出增强的活化调节性CD4+T细胞表型(CD45RO+ICOS+),而传统的CD4+T淋巴细胞表达较低水平的共刺激和活化标志物。
此外,阿米什儿童的CD28null CD8+细胞比例高于哈特派儿童,这与高T细胞干扰素γ产生和低血清IgE浓度相关。
阿米什儿童在外周血白细胞中也表现出更高的先天基因TNF和TNF诱导蛋白3 (TNFAIP3)的表达,并伴有抑制表型的单核细胞。
总的来说,传统的农场环境可以通过参与和塑造生命早期的先天和适应性免疫反应来预防哮喘。
▷
农场环境与呼吸道感染和肺功能相关
有趣的是,在农场长大也与呼吸道感染和肺功能低下呈强烈的负相关。因此,暴露于动物棚内不同的环境微生物群似乎是预防哮喘的关键。
农场环境下婴儿的肠道菌群与哮喘风险降低有关
在传统农业环境中长大的出生队列中,2至12个月大的婴儿肠道微生物组的成熟已经被建模。12个月大婴儿的估计微生物组年龄与先前的农场接触和学龄前患哮喘的风险降低有关。
微生物组年龄介导了19%的保护作用。粪便丁酸水平、预测丁酸产生的细菌分类群以及编码丁酰辅酶A:乙酸辅酶A转移酶基因的相对丰度与哮喘呈负相关。
这些数据表明,农场微生物对哮喘发展的保护机制可能是通过微生物代谢物改变和更成熟的肠道微生物群,以及代谢物通过肠-肺轴影响肺免疫反应。
▷
细菌裂解物有助于预防呼吸道感染
儿童口服混合细菌裂解物的临床试验进一步证明了保护性肠道微生物群在预防生命早期下呼吸道感染方面的重要性。
口服或舌下给药混合呼吸道致病菌的裂解物已被用于预防呼吸道感染,以及预防可能由呼吸道感染引起的喘息和哮喘加重。
一项关于细菌裂解物治疗对学龄前儿童喘息发作和哮喘加重效果的系统综述显示,儿童喘息发作(平均减少2.35次)和哮喘加重(平均减少0.90次)均有所减少。
// OM-85
细菌裂解液混合物OM-85包括呼吸道病原体混合物的21种细菌菌株的冻干组分。在感染鼻病毒前,对成人健康对照和哮喘或慢性阻塞性肺疾病患者培养的原代人支气管上皮细胞进行预孵育,结果显示,所有三组患者的干扰素γ分泌均显著增加。
也有体外证据表明OM-85能抑制鼻病毒和流感病毒对支气管上皮细胞的感染,从而增加上皮细胞的存活率。
// MV130
MV130是一种灭活的多细菌化合物,人舌下或小鼠鼻内给药,其作用机制是通过对小鼠骨髓祖细胞和体外人类单核细胞进行重新编程来诱导经过训练的免疫力,促进细胞因子产生(TNF)的增强,该增强依赖于通过增加乳酸产生的代谢转变。
注:该实验还没有在早期生命模型中进行,也没有在儿童的免疫细胞中进行。
呼吸道微生物组是一个尚未充分研究的治疗靶点,以促进良好的肺部健康结果。细菌代谢产物在调节免疫功能和保护过敏和哮喘方面的机制作用已被证明,但仅在肠道微生物组的背景下。
小结
微生物代谢产物,或在改变呼吸道微生物组以提供保护方面重要的特定分子的作用仍然未知。至关重要的是,农场提取物中提供保护的微生物是冻干和灭活的,因此不太可能产生代谢产物。
因此,未来干预措施的机制假设需要侧重于研究提供保护的吸入农场微生物的特定分子成分。
此外,与哮喘风险增加相关的共生细菌病原体(M.catarrhalis、肺炎链球菌、流感嗜血杆菌)和更具保护性的微生物(双歧杆菌、棒状杆菌)之间的相互作用也可能导致呼吸道代谢产物之间的不平衡,从而导致TH2偏斜的免疫反应。
结语
建立健康的呼吸系统,在正确的时间接触正确的微生物是关键。
肺部免疫在生命的最初几个月形成。婴儿通过呼吸道暴露于多种不同的病原体。如鼻病毒,呼吸道合胞病毒,莫拉菌属(Moraxella)、嗜血杆菌(Haemophilus)、链球菌(Streptococcus)都会引起呼吸道感染,进而导致反复的喘息和哮喘等呼吸系统疾病。
当然,也有一部分细菌对呼吸系统是有益的,例如普雷沃氏菌(Prevotella)、罗氏菌属(Roseburia)和韦荣氏球菌(Veillonella)。
这些不同病原体、发育中的免疫系统和成熟的呼吸系统以及环境之间的关系对于儿童时期的慢性呼吸系统疾病和建立具有终身影响的肺部免疫健康轨迹至关重要。
对健康呼吸系统分子机制的更深入了解,能够有效防止儿童喘息障碍发展为慢性哮喘和低肺功能直至成年。
主要参考文献
Lloyd CM, Saglani S. Early-life respiratory infections and developmental immunity determine lifelong lung health. Nat Immunol. 2023 Jul 6.
Sandall, J. et al. Short-term and long-term effects of caesarean section on the health of women and children. Lancet 392, 1349–1357 (2018).
Achten, N. B., van Rossum, A. M. C., Bacharier, L. B., Fitzpatrick, A. M. & Hartert, T . V . Long-term respiratory consequences of early-life respiratory viral infections: a pragmatic approach to fundamental questions. J. Allergy Clin. Immunol. Pract. 10, 664–670 (2022).
van Meel, E. R. et al. Early-life respiratory tract infections and the risk of school-age lower lung function and asthma: a meta-analysis of 150,000 European children. Eur. Respir. J. 60, 2102395 (2022).
Bose, S., Pascoe, C. & McEvoy, C. Lifetime lung function trajectories and COPD: when the train derails. Lancet Respir. Med. 11, 221–222 (2022).
Zar, H. J. et al. Early-life respiratory syncytial virus lower respiratory tract infection in a South African birth cohort: epidemiology and effect on lung health. Lancet Glob. Health 8, e1316–e1325 (2020).
Ariyakumar, G. et al. Activation of lymphocytes in healthy neonates within hours of birth. Front. Immunol. 13, 883933 (2022).
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1396490.html
上一篇:[转载]抑郁症与肠道微生物群有何关联
下一篇:[转载]用MiCoNE工具对16S序列数据进行共现网络分析