博文
Science:线粒体ROS的特快专线
||
撰文 | 程诗淼 高铭远 石丽 生茂正 郭盈盈 于剑
编辑 | 孟美瑶
校对 | 生茂正

背景介绍
线粒体电子传递链在ATP合成过程中,少数电子会泄漏并直接与氧分子反应,形成超氧阴离子,这是细胞内活性氧(ROS)的主要来源。这些ROS在生理浓度下参与细胞信号转导,但过量积累会导致氧化损伤。目前普遍认为线粒体氧化还原稳态的维持是一个区室化过程,即线粒体通过其内源性抗氧化系统清除电子传递链衍生的ROS。但长期研究也表明,过氧化物酶体功能缺陷会导致ROS介导的线粒体损伤。过氧化物酶体是普遍存在的膜结合细胞器(小编注:过氧化物酶体膜可与线粒体、内质网等形成膜接触位点(MCSs),直接交换脂质和钙离子,协调细胞器间功能),富含高浓度抗氧化酶,尤其是过氧化氢酶,这种强大的抗氧化能力使得过氧化物酶体能够维持比其他胞内环境更还原的氧化还原环境。
线粒体氧化应激是过氧化物酶体生物合成障碍的典型特征,表现为线粒体内ROS的异常积累及氧化还原稳态的失衡。研究表明,过氧化物酶体功能缺陷会导致线粒体功能障碍,具体表现为线粒体膜电位下降、ATP合成减少以及线粒体形态异常。这种功能障碍与过氧化氢酶的表达下调、酶活性丧失及其在过氧化物酶体中的定位缺失密切相关。这些发现暗示过氧化物酶体参与维持线粒体氧化还原稳态,但其具体机制尚不明确。鉴于过氧化物酶体的抗氧化能力,研究人员推测其可能作为线粒体ROS的回收站,直接调控线粒体氧化还原稳态。
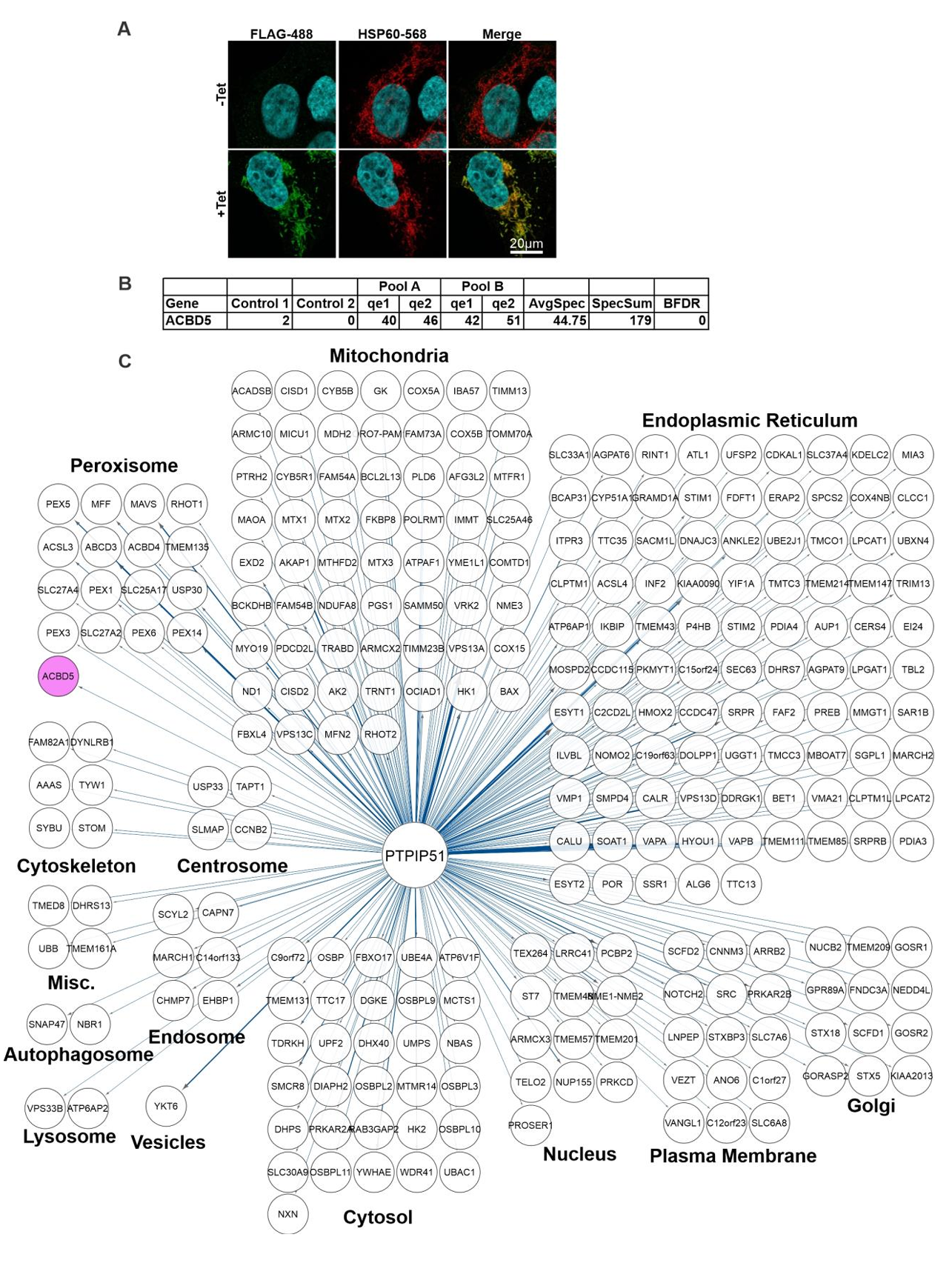
线粒体几乎能够与细胞内所有区室都能形成膜接触位点,这些接触位点促进脂质、代谢物和离子等分子的细胞器间转移,对维持线粒体代谢功能、脂质组成、分裂及定位至关重要。已知ROS可作为信号分子调控线粒体-内质网(ER)的接触位点。然而膜接触位点是否也能通过转移ROS实现抗氧化功能尚不清楚。基于此,加拿大多伦多大学Peter Kim团队进行相关研究,其成果“ROS transfer at peroxisome-mitochondria contact regulates mitochondrial redox”近期发表在Science杂志上,本研究发现过氧化物酶体在管理线粒体ROS中的直接作用,并鉴定出由过氧化物酶体膜蛋白ACBD5和线粒体外膜蛋白PTPIP51介导的PO-Mito接触位点,过氧化物酶体和线粒体之间的膜接触允许线粒体ROS直接转移到过氧化物酶体进行处理,为细胞提供了一种防御氧化损伤的方法。

敲黑板啦!
1、线粒体氧化应激触发PO-Mito接触
2、过氧化物酶体接触维持线粒体氧化还原稳态
3、PO-Mito接触缓解线粒体氧化应激
4、接触促进线粒体ROS向过氧化物酶体的转移
研究结果
1、线粒体氧化应激触发PO-Mito接触
研究人员开发了一种全时空尺度成像的方法来测量过氧化物酶体-线粒体(PO-Mito)接触。该方法通过高分辨率激光扫描共聚焦显微镜,采集转染了荧光过氧化物酶体和线粒体标记物的细胞的多层时间序列图像(小编注:线粒体使用mt-RFP进行标记,该标记物可表达融合到 E1α-丙酮酸脱氢酶前导序列上的 RFP,使得红色荧光蛋白RFP在线粒体体中表达。过氧化物酶体使用泛素化的Ub-GFP-SKL进行标记,该蛋白在细胞质中会被泛素-蛋白酶体系统快速降解,但当定位于过氧化物酶体时则受到保护从而形成GFP信号。),动态追踪每个过氧化物酶体边缘到最近线粒体的像素距离(图1A、图S1A)。对相邻事件(≤1像素)出现频率与接触时长的关系进行双组分指数衰减模型拟合,结果表明存在两种具有不同时间特征的过氧化物酶体—线粒体相邻事件(图1B)。研究人员推断持续性相邻事件可能代表真实接触,而短暂相邻可能源于非特异性相互作用或衍射极限成像的干扰,因此采用模型计算的慢时间常数τ将PO-Mito接触定义为持续>31秒且≤1像素的相邻事件。该测量结果与线粒体(图S1B)或过氧化物酶体体积(图S1C)均无相关性,表明细胞器密度不影响检测准确性。为验证这种接触定量方法的可靠性,研究人员在COS-7细胞中检测了过氧化物酶体-内质网接触。正如预期的那样,在通过siRNA敲除过氧化物酶体-内质网锚定蛋白相关的蛋白酰基辅酶A结合结构域蛋白5(Acyl-CoA Binding Domain Containing 5, ACBD5)、囊泡相关膜蛋白A(VAMP Associated Protein A, VAPA)和囊泡相关膜蛋白相关蛋白 B(VAMP Associated Protein B, VAPB)后(图S2A-D)(小编注:在2017年ACBD5 and VAPB mediate membrane associations between peroxisomes and the ER文章中就表明ACBD5 和 VAPB 介导过氧化物酶体和 ER 之间的膜结合),发现过氧化物酶体与内质网接触减少。而过表达人工锚定蛋白TOM20-Cer-PEX26(小编注:基于细胞器间天然互作机制的工程化改造:TOM20:线粒体外膜受体蛋白,负责识别并引导核编码的线粒体蛋白前体(含线粒体靶向信号肽);Cerulean (Cer):蓝色荧光蛋白变体,作为可视化标签便于追踪定位;PEX26:过氧化物酶体膜蛋白,参与过氧化物酶体生物发生及膜蛋白锚定。线粒体与过氧化物酶体通过内源性蛋白(如ACBD5-VAPB)短暂接触,而 TOM20-Cer-PEX26 通过共表达,从而形成稳定的“物理桥梁”,实现两细胞器的人工连接。)则显著增加PO-Mito接触(图S2E-H)。
接下来,研究人员用这个指标评估PO-Mito接触是否对线粒体氧化应激有反应。研究人员用鱼藤酮处理Huh7细胞后发现PO-Mito接触增加(图1C)。使用半乳糖或棕榈酸同样观察到该现象结果(图1D、图S3A、B)。邻近连接实验(Proximity Ligation Assay, PLA)证实了这一结果(图S3C、D)。当在添加半乳糖或棕榈酸的培养基中表达线粒体基质过氧化氢酶(mt-CAT),即删除其过氧化物酶靶向序列仅保留线粒体靶向序列后,这种接触增强效应被抵消(图1D、图S3B、图S4)。因此线粒体氧化应激水平升高可特异性促进PO-Mito接触形成。

图1.ACBD5和PTPIP51介导PO-Mito接触以响应线粒体氧化应激
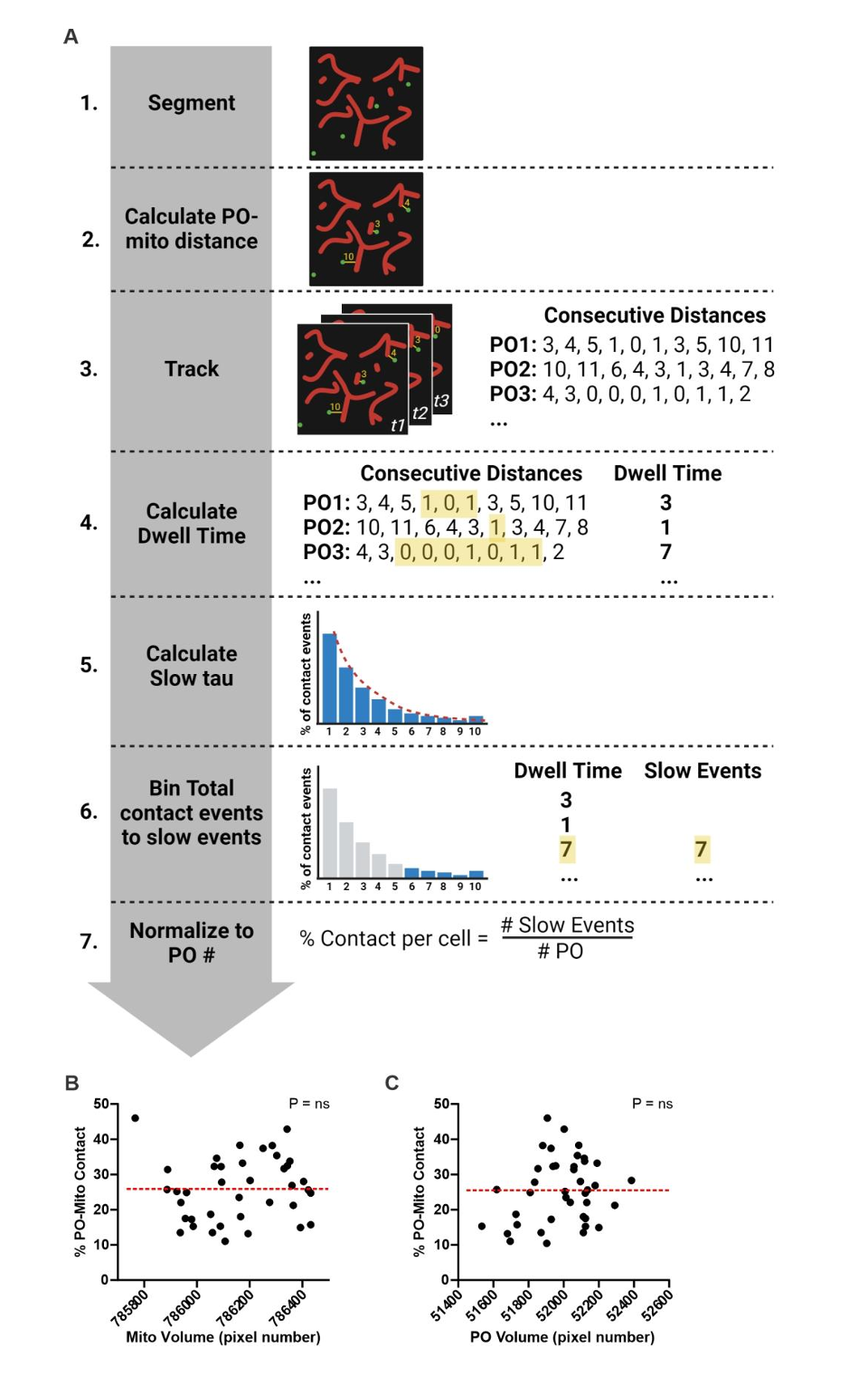
图S1.用于定量分析细胞器接触的成像信息学流程
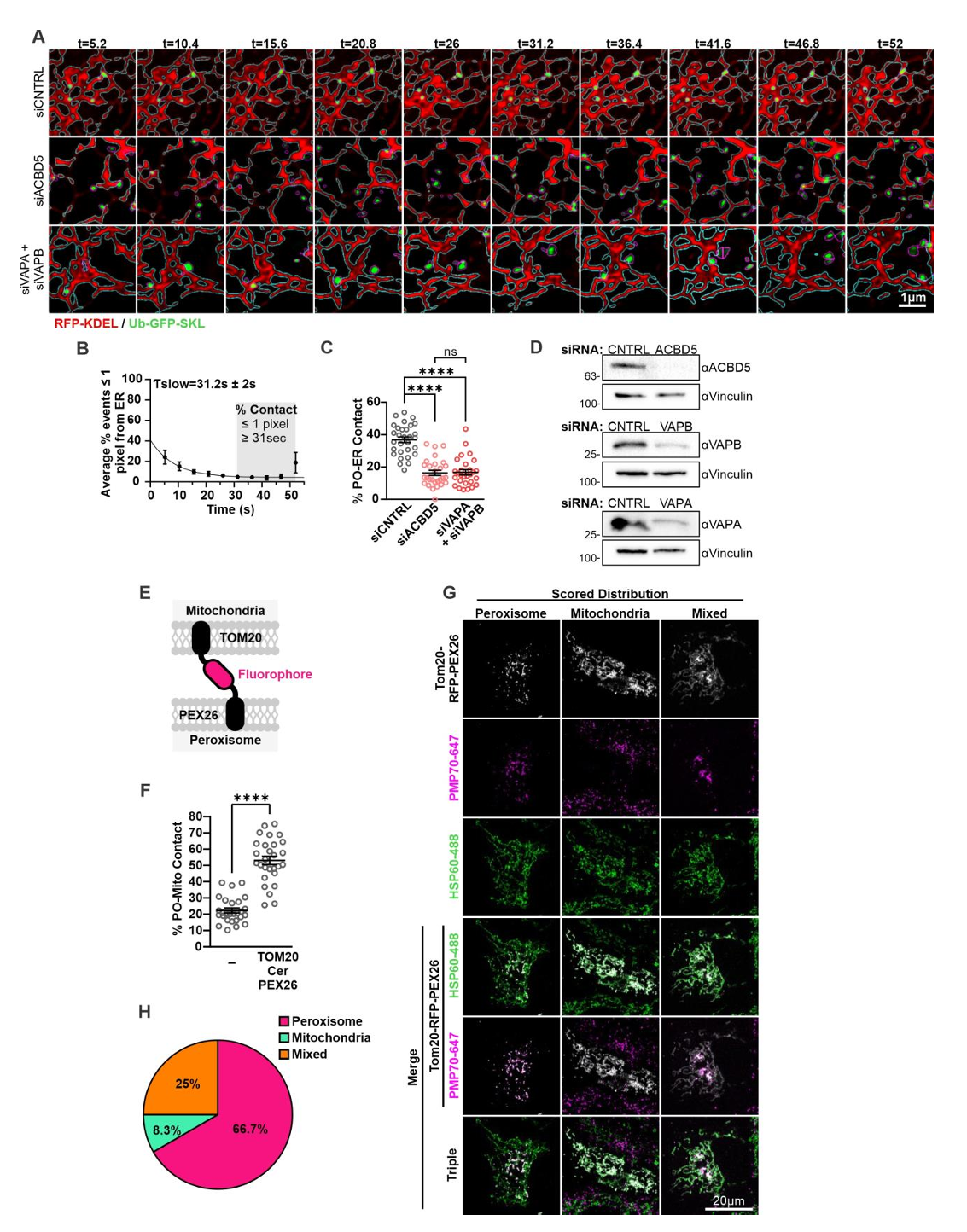
图S2.细胞器接触定量的验证

图S3.支持过氧化物酶体-线粒体接触对线粒体氧化应激反应的证据
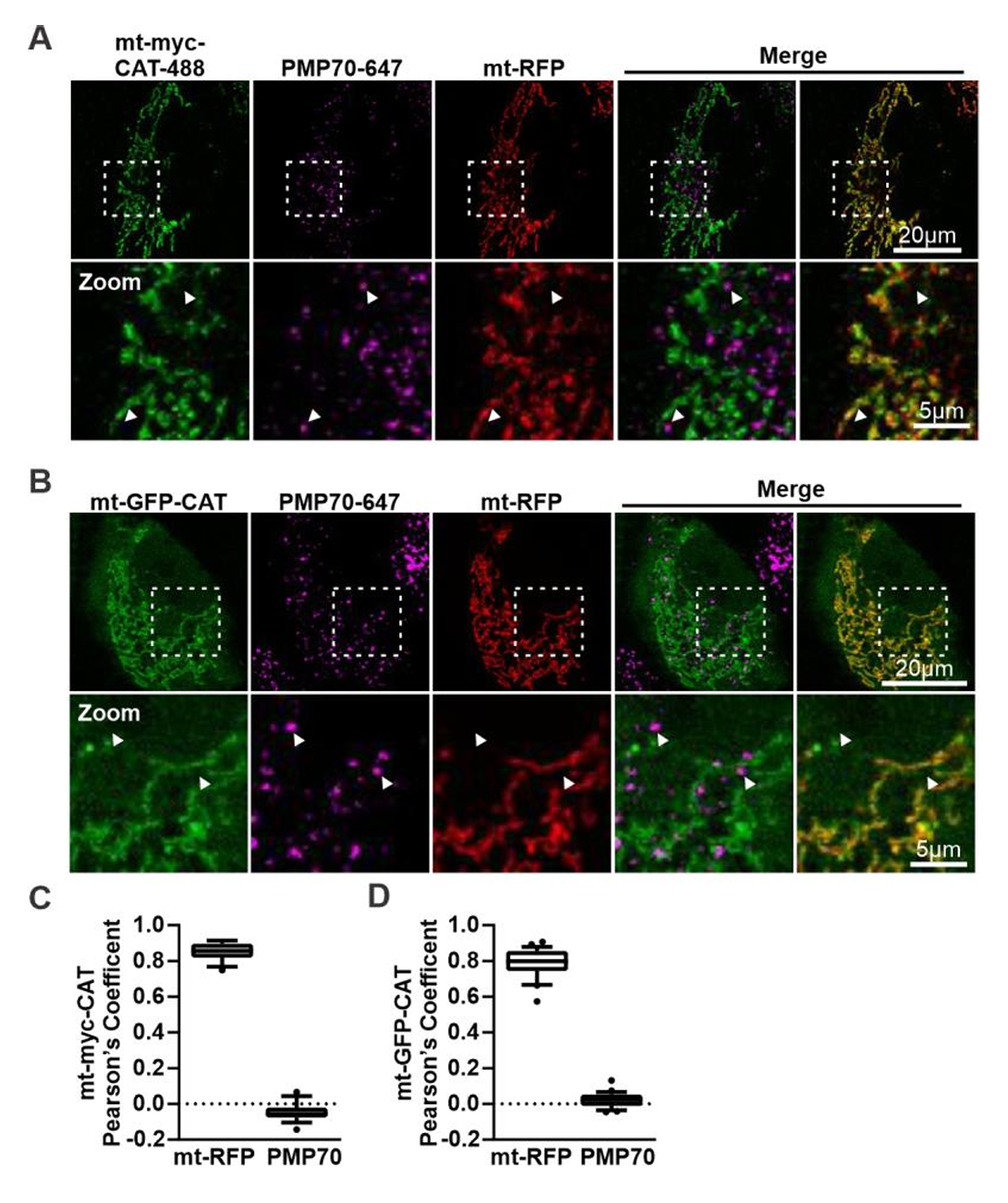
图S4.线粒体靶向过氧化氢酶的定位
2、ACBD5和PTPIP51介导过氧化物酶体-线粒体接触
尽管目前已有文献报道了哺乳动物细胞中过氧化物酶体与线粒体的接触现象,但相较于酵母中已鉴定的多个锚定组分,哺乳动物中PO-Mito接触的分子连接机制尚未阐明。为了鉴定和表征导致这种应激反应性接触的PO-Mito分子结构,研究人员对过氧化物酶体锚定蛋白ACBD5进行了BioID筛选,结果发现线粒体外膜蛋白酪氨酸磷酸酶相互作用蛋白51(Protein tyrosine phosphatase interacting protein 51,PTPIP51)被鉴定为ACBD5的潜在相互作用伴侣(图1E及图S5)。这一发现通过反向PTPIP51 BioID实验中对ACBD5的互作验证得到进一步支持,在PTPIP51的BioID筛选中同样检测到ACBD5(图S6)。
拓展阅读
ACBD5和PTPIP51
含酰基辅酶A结合结构域的蛋白(ACBD)是一个庞大且多样化的多基因蛋白质家族,含有保守的酰基辅酶A结合基序。ACBD蛋白在控制活性脂肪酸,调节脂质代谢和细胞信号传导等方面发挥重要作用。在哺乳动物中,已经发现了8种ACBD蛋白(ACBD1-8)。其中,ACBD5是C端尾锚定(TA)膜蛋白,定位于过氧化物酶体并将其N端酰基辅酶A结合结构域暴露于细胞质。ACBD5作为过氧化物酶体-内质网膜接触位点的一个组成部分,通过与ER驻留的VAPB(囊泡相关膜蛋白(VAMP)相关蛋白B)相互作用,参与过氧化物酶体与内质网的系留。此外,在缺乏 ACBD5 的细胞中还观察到极长链脂肪酸(VLCFA)水平升高以及疟原磷脂和胆固醇水平的改变。这些发现表明ACBD5-VAPB介导的过氧化物酶体-内质网接触在过氧化物酶体生物发生、膜脂转移和合作代谢中发挥作用。
PTPIP51属于与微管细胞骨架相互作用的蛋白质家族,也被称为微管相关蛋白。该家族由三个成员组成,统称为微管动力学调节因子(RMD)。PTPIP51蛋白表达的重要性体现在其广泛的进化保守性上——该蛋白不仅存在于小鼠、大鼠等多种哺乳动物中,甚至在秀丽隐杆线虫等较为原始的物种中也有发现。在最初的研究中,PTPIP51被认为是两种非受体酪氨酸磷酸酶,即蛋白酪氨酸磷酸酶1B(PTP1B)和T细胞蛋白酪氨酸磷酸酶的相互作用蛋白。后续研究中,研究人员发现PTPIP51主要定位在线粒体,其在内质网(ER)与线粒体之间的生理性相互作用中发挥关键调节作用,特别是在维持细胞内钙离子稳态方面具有重要功能。
参考文献:
[1]Costello JL et al.J Biol Chem. 2023 Aug;299(8):105013.
[2]Brobeil A et al. Cell Tissue Res. 2017 Jun;368(3):411-423.
外源表达的ACBD5和PTPIP51能够发生免疫共沉淀,并且在细菌表达系统中也证实了这些蛋白质之间的直接相互作用(图1F-H)。在HeLa细胞中使用siRNA敲低ACBD5或PTPIP51后PO-Mito接触减少,而同时敲低两者未观察到进一步减少(图1I、图S7A)。相反,过表达ACBD5或PTPIP51会导致PO-Mito接触增加,但这种效应会被互作蛋白的siRNA敲低所阻断(图1J、K)。用电子显微镜也观察到ACBD5和PTPIP51过表达后PO-Mito接触增加(图S7B-D)。这些结果表明ACBD5-PTPIP51的直接相互作用调控PO-Mito接触。
通过AlphaFold多聚体模拟预测,ACBD5与PTPIP51既能形成1:1异源二聚体(图S8C、D),也能形成2:2异源四聚体结构(图S8E、F),其卷曲螺旋结构域(CCDs)之间呈现高可信度定位,并在预测中呈现为反向平行的左手螺旋构象(图S8G)。与预测一致,ACBD5的CCD缺失突变体(ACBD5ΔCCD)在体外没有与PTPIP51相互作用,即使过量表达也无法恢复其与PTPIP51的相互作用(图1L、图S9A-E)。此外在HeLa细胞中,与全长蛋白相比,ACBD5ΔCCD与PTPIP51的CCD缺失突变体(PTPIP51ΔCCD)导致PO-Mito接触能力受损(图1M、N、图S9F)。因此,CCD结构域是介导ACBD5-PTPIP51相互作用的关键元件,对PO-Mito接触的形成至关重要。
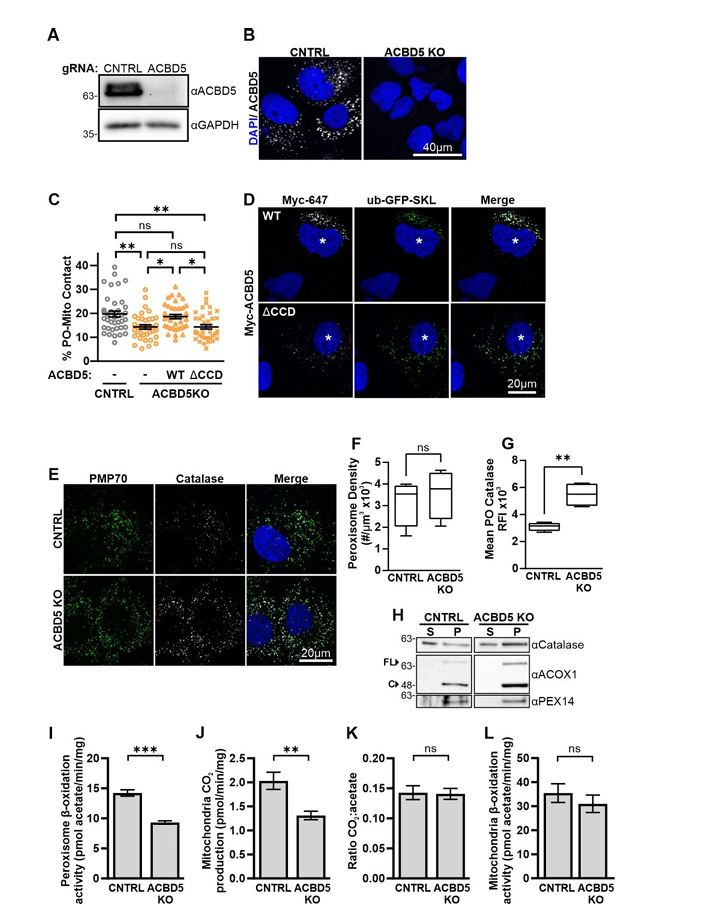
在ACBD5基因敲除的Huh7细胞系(ACBD5 KO)中,PO-Mito接触显著被抑制,回补全长ACBD5可恢复该接触,但回补ACBD5ΔCCD突变体则无此功能(图S10A-D)。ACBD5 KO细胞并未表现出过氧化物酶体密度或基质蛋白输入的异常,反而显示过氧化物酶体基质蛋白过氧化氢酶和ACOX1的定位增强(图S10E-H)。ACBD5 KO细胞对C16:0二羧基脂肪酸(16-DCA)的过氧化物酶体β-氧化能力略有下降(图S10I),这一现象与先前关于C26:0的报道一致(小编注:脂肪酸的β-氧化发生在线粒体还是过氧化物酶体,主要取决于其碳链长度。根据碳链长度脂肪酸可以分为短/中链脂肪酸(4-12碳)、长链脂肪酸(12-20碳)、超长链脂肪酸(≥22碳),其中短/中链脂肪酸可直接扩散进入线粒体或部分依赖于肉碱转运系统进入线粒体,长链脂肪酸需要先活化为脂酰-CoA,再通过肉碱转运系统进入线粒体,因此长链脂肪酸主要在线粒体中进行β-氧化同时过氧化物酶体可以辅助代谢部分长链脂肪酸。超长链脂肪酸由于疏水性极强,与肉碱棕榈酰转移酶1(CPT1)的亲和力低,而过氧化物酶体膜上有ABC转运蛋白,可直接摄取超长链脂酰-CoA,无需肉碱系统,因此超长链脂肪酸优先在过氧化物酶体中被氧化)。脉冲追踪实验显示,16-DCA代谢产生的乙酸盐/二氧化碳(acetate:CO2)比值无显著变化(图S10I-K),表明过氧化物酶体来源的β-氧化中间产物向线粒体的转运未受影响。同时棕榈酸的降解也未出现缺陷(图S10L),表明线粒体β-氧化没有受损。然而,与对照组不同,当半乳糖为主要碳源时,ACBD5 KO Huh7细胞中PO-Mito接触没有增加(图1O、图S3C、D),表明ACBD5-PTPIP51介导的接触响应于线粒体氧化代谢水平的升高而上调。
拓展阅读
线粒体肉碱转运系统的关键酶CPT1和CPT2对超长链脂肪酸亲和力极低,因此超长链脂肪酸需在过氧化物酶体启动β-氧化,当细胞需快速供能(如饥饿、高脂环境)时,过氧化物酶体产生大量中/短链脂酰-CoA(C6-C10)及乙酰-CoA,再需转运至线粒体完成ATP生成过程。
在过氧化物酶体中,超长链脂肪酸被过氧化物酶体酰基辅酶A氧化酶1(Acyl-CoA oxidase 1,ACOX1)催化作用下脱氢,该反应需要FAD作为辅因子,生成反式-2-烯酰辅酶A和过氧化氢。接着双功能酶烯酰辅酶A水合酶/3-羟酰辅酶A脱氢酶催化反式-2-烯酰辅酶A水合再脱氢形成3-酮酰辅酶A,同时消耗NAD+生成NADH。最后3-酮脂酰辅酶A硫解酶(3-ketoacyl CoA thiolase,3-KAT)催化硫解反应,缩短两个碳链,形成乙酰辅酶A和缩短了两个碳原子的脂酰辅酶A。缩短后的脂酰辅酶A可以再次进入过氧化物酶体β-氧化循环,经过数次循环缩短后,产生的较短链脂酰辅酶A会被转运到线粒体中,通过线粒体的β-氧化途径完全氧化成乙酰辅酶A,进入三羧酸循环产生能量。同时乙酰-CoA经柠檬酸-丙氨酸循环转化为柠檬酸进入胞质,再输入线粒体参与TCA循环。
该过程通过过氧化物酶体预处理缩短碳链,降低疏水性,减轻了线粒体代谢负担。同时过氧化物酶体的β-氧化不产ATP,因此需依赖线粒体实现能量转化。此外过氧化物酶体产生的过量乙酰-CoA输入线粒体,可以维持乙酰-CoA池平衡。

参考文献:
[1]Thoms S et al. Trends Mol Med. 2009 Jul;15(7):293-302.
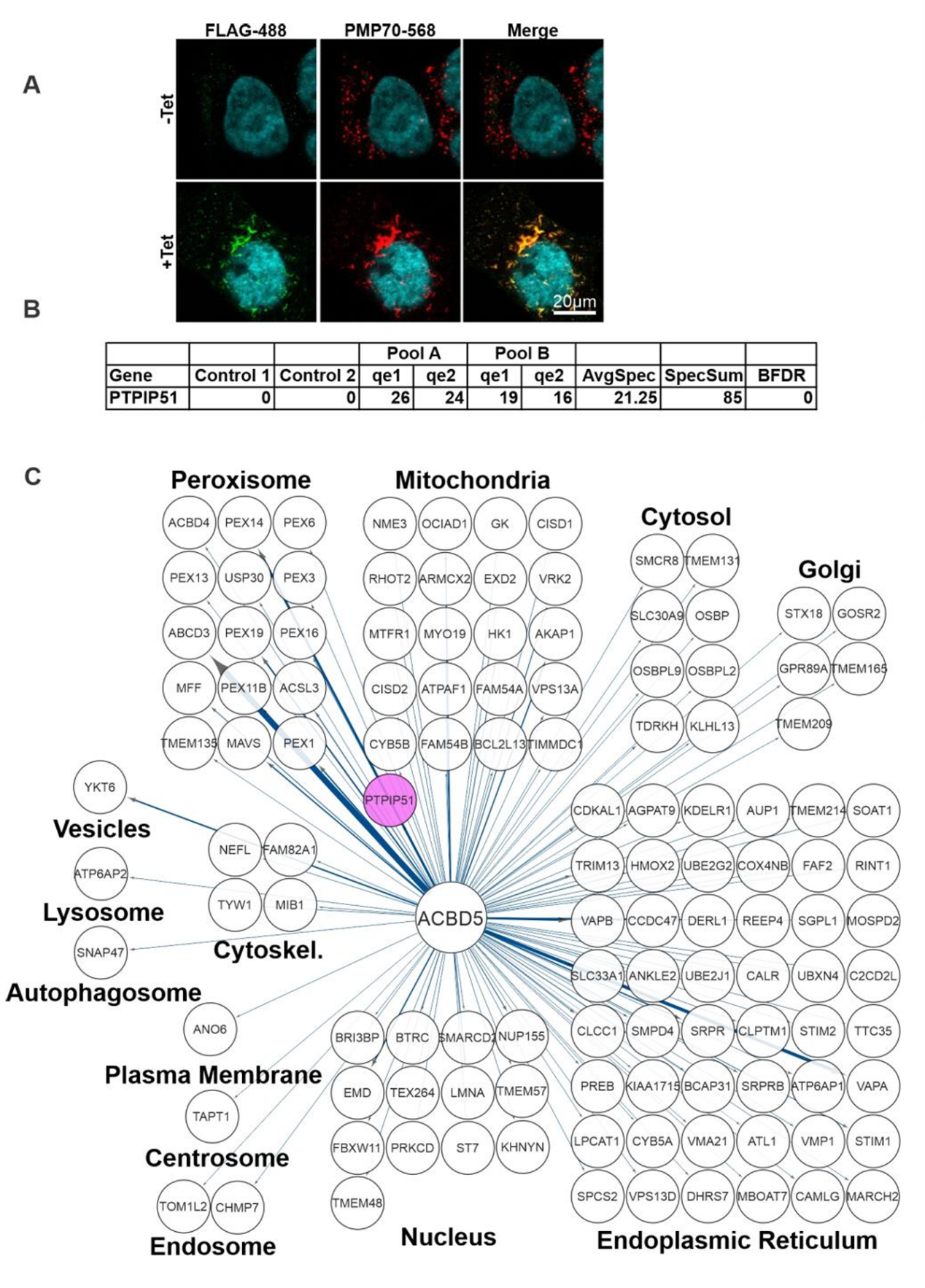
图S5.ACBD5的BioID
图S6.PTPIP51的BioID

图S7.支持ACBD5-PTPIP51介导过氧化物酶体-线粒体接触的证据

图S8.AlphaFold多聚体预测卷曲螺旋介导的ACBD5-PTPIP51相互作用

图S9.支持卷曲螺旋圈相互作用的证据有助于ACBD5-PTPIP51相互作用和PO-Mito接触
图S10.ACBD5 KO Huh7细胞的表征
3、过氧化物酶体接触维持线粒体氧化还原稳态
还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)之间的可逆转化是细胞催化过氧化氢还原的核心抗氧化系统,其稳态GSSG:GSH比值常被用作衡量细胞氧化还原状态的指标。通过细胞质定位的Grx1-roGFP2(一种GSSG:GSH比率的定量检测探针,可检测亚细胞氧化还原内源性变化),发现ACBD5KO细胞的胞质谷胱甘肽池比对照组呈现更显著的氧化态(图2A、B)。此外,ACBD5KO细胞中核因子红细胞2相关因子2(Nuclear factor-erythroid 2 related factor 2,NRF2)的核水平升高,该转录因子通过诱导抗氧化反应基因表达来响应氧化应激。NRF2的核转位特征表现大分子量N端条带表达增加,该现象与H₂O₂处理诱导的核定位响应一致(小编注:在细胞未受到氧化应激时,NRF2在胞质中与E3泛素连接酶KEAP1(Kelch-like ECH-associated protein 1)结合,通过KEAP1介导的泛素化降解,维持低水平。在细胞受到氧化应激刺激后,ROS氧化KEAP1的关键半胱氨酸残基改变了KEAP1构象,进而导致游离NRF2积累,游离的NRF2在N端结构域发生磷酸化、乙酰化等修饰,促进NRF2核转位,NRF2入核后结合抗氧化反应元件启动抗氧化基因(如谷胱甘肽合成酶、过氧化氢酶)表达)(图2C、D、图S11A、B)。这些数据表明,缺乏PO-Mito接触的细胞的细胞氧化状态普遍升高。
线粒体融合在线粒体氧化应激时被激活(小编注:当线粒体遭遇活性氧攻击时,ATP依赖性锌金属蛋白酶(ATP-Dependent Zinc Metalloprotease,YME1L)活性受到抑制,YME1L可把OPA1由长形态的L-OPA1切割成短形态的S-LPA1,其中L-OPA1对线粒体融合来说是必需的,因此氧化应激状态下L-OPA1降解减少,从而促进内膜融合。也有研究发现在心肌细胞中,SIRT3通过去乙酰化MFN2的K243位点增强其GTP酶活性,促进线粒体融合以抵抗过氧化氢诱导的损伤)。因此作为缺乏PO-Mito接触的细胞中线粒体氧化应激的指标,研究人员评估了ACBD5KO细胞中的线粒体形态是否发生改变。与CNTRL细胞相比,ACBD5KO细胞中的线粒体表现出细长的形态,如线粒体面积增加和线粒体数量减少(图2E-J)。研究人员发现对照组与ACBD5KO细胞间的线粒体密度无显著差异,表明线粒体生物合成未受影响(图S11C)。通过表达PO-Mito AT(TOM20-GFP-PEX26)恢复PO-Mito接触能够挽救ACBD5 KO细胞中的线粒体形态(图2E-G),表明细长形态是由于PO-Mito接触的丧失。同样,mt-CAT(mt-GFP-CAT-ΔKANL)的表达也挽救了线粒体形态,表明ACBD5 KO细胞中细长线粒体形态是由于线粒体氧化应激升高所导致。
线粒体通过轻度膜解偶联作为抗氧化机制。为此,研究人员使用四甲基罗丹明甲酯(TMRM)检测了ACBD5KO细胞的线粒体膜电位变化,以作为氧化应激加剧的指标(图S11D、E)。在基础生长条件下,与CNTRL细胞相比,ACBD5 KO细胞的线粒体膜电位显著降低。在响应半乳糖刺激时,ACBD5 KO细胞的膜电位损失程度也显著大于CNTRL细胞(图2K、图S11 F、G)(小编注:ROS可氧化线粒体ETC复合物I、III的Fe-S簇和半胱氨酸残基,抑制电子传递效率,导致线粒体膜电位降低,同时在氧化应激状态下,线粒体会激活解偶联蛋白或诱导质子漏,允许质子回流基质,降低了线粒体膜电位,减少电子在ETC堆积,抑制ROS生成,这同时也导致线粒体膜电位降低,因此线粒体膜电位丧失可作为氧化应激加剧的直接指标)。这种半乳糖诱导的膜电位下降可通过表达PO-Mito锚定蛋白或野生型ACBD5得到缓解,但CCD结构域缺失突变体(ACBD5ΔCCD)无此效果(图2L-O),表明ACBD5介导的PO-Mito接触对ROS诱导的膜电位丧失具有保护作用。而mt-CAT的表达未能显著改善此现象(图2L、M),这与既往研究一致,表明线粒体靶向抗氧化剂过表达后膜电位出现缺陷(小编注:低浓度过氧化氢是关键的线粒体功能调节信号,通过维持ETC复合物活性和诱导解偶联蛋白表达来维持线粒体轻度解偶联从而抑制ROS过量生成,而mt-CAT过度清除过氧化氢破坏了线粒体微环境,导致适应性解偶联不足,线粒体膜电位出现缺陷,说明过度清除活性氧不仅没有减轻线粒体氧化应激水平反而会破坏线粒体功能的氧化还原调控,导致膜电位异常。从而进一步证明了通过PO-Mito接触介导的跨细胞器协作来调控ROS比单纯抗氧化剂更符合生理调节逻辑),这可能是因为线粒体功能的氧化还原调节受损。因此,在缺乏PO-Mito接触的ACBD5 KO Huh7细胞中,线粒体氧化应激标志物水平显著升高。
拓展阅读
线粒体轻度膜解偶联作为抗氧化机制
线粒体通过电子传递链将电子从还原型辅酶(NADH、FADH2)传递给氧气形成水,在电子传递过程释放的能量,被用来将质子从线粒体基质泵到膜间隙,形成跨内膜的质子梯度。在正常情况下,电子传递与质子泵送紧密相连,质子回流则主要通过ATP合酶驱动ATP合成,这个过程紧密偶联。当质子梯度较高时,电子在复合物I和III停留时间变长,高能电子“泄露”出来,直接将单个电子交给分子氧形成超氧阴离子。
线粒体轻度解偶联通过解偶联蛋白、腺嘌呤核苷酸转运体或其他质子漏途径如线粒体通透性转换孔,允许少量质子不经ATP合酶回流,部分消散了质子梯度,降低了质子梯度。降低的质子梯度降低了还原型辅酶Q等电子载体的还原程度,减少了用于还原氧分子的底物浓度。最终线粒体通过轻度解偶联减少了电子泄露程度,降低了线粒体 ROS 水平,减轻线粒体氧化应激。

图2.过氧化物酶体接触维持线粒体氧化还原稳态

图S11.支持过氧化物酶体接触维持线粒体氧化还原稳态的证据
4、PO-Mito接触缓解线粒体氧化应激
研究人员通过线粒体基质靶向Grx1-roGFP2(mt-Grx1-roGFP2)检测发现,对照组CNTRL细胞与ACBD5 KO Huh7细胞的基础线粒体谷胱甘肽氧化还原状态无显著差异(图3A-C、图S12A、B)。这可能是由于上述减轻氧化应激的代偿性适应性变化,或者因为 PO-Mito 接触可能仅有助于氧化应激条件下的氧化还原稳态。为此,研究人员采用氧化应激与氧化还原探针组合策略,评估了ACBD5 KO细胞维持线粒体氧化还原稳态的能力(图3A)。发现在半乳糖培养条件下,ACBD5 KO细胞的线粒体谷胱甘肽氧化水平显著升高,而CNTRL细胞无此变化(图3B、C)。这种半乳糖诱导的mt-Grx1-roGFP2氧化增强现象,可通过表达PO-Mito锚定蛋白或野生型ACBD5消除,但CCD结构域缺失突变体无此功能(图3B-E)。这些数据证实,PO-Mito接触对缓解半乳糖代谢产生的线粒体ROS具有重要作用。PO-Mito接触有助于减轻半乳糖代谢产生的线粒体ROS,从而导致ACBD5 KO细胞对谷胱甘肽的依赖性增强,以维持氧化还原平衡。
通过线粒体靶向KillerRed(mt-KR)(小编注:KillerRed是一种具有独特的光敏特性的荧光蛋白,在特定波长照射下,KillerRed吸收光子能量并进入激发态,激发态KillerRed可以将能量转移至周围氧气分子,生成超氧阴离子和过氧化氢等活性氧,并且KillerRed的表达水平与ROS 产率呈线性正相关,且仅在光照区域激活,实现时空精准控制。mt-KR在KillerRed 基因序列前融合线粒体定位信号肽,从而引导蛋白定位于线粒体,将ROS生成精确限制在线粒体内,模拟生理性线粒体氧化应激,同时又严格避免对其他细胞区室(如胞质、过氧化物酶体)产生影响,实现靶向刺激)进行急性氧化刺激后也观察到类似现象。光漂白mt-KR诱导急性线粒体ROS生成后,通过比较漂白前后mt-roGFP2的变化来测定线粒体谷胱甘肽氧化还原状态的改变。研究人员发现mt-roGFP2随mt-KR表达的变化在ACBD5 KO细胞中大于CNTRL细胞,表明与CNTRL细胞相比,ACBD5 KO细胞需要消耗更多谷胱甘肽来清除等效水平的ROS(图S12C、D)。共表达PO-Mito锚定蛋白可逆转这种异常,证实PO-Mito接触确实有助于减轻线粒体产生的ROS。而这种增加能够被PO-Mito AT的共表达所挽救,表明PO-Mito接触有助于减少线粒体产生的ROS。
研究人员还利用靶向线粒体基质的HyPer7(mt-HyPer7)直接检测鱼藤酮诱导线粒体ROS产生后线粒体内过氧化氢水平。在鱼藤酮处理40分钟后,ACBD5 KO Huh7细胞中mt-HyPer7的氧化程度显著高于对照组CNTRL细胞(图3F、G)。研究人员还在通过siRNA敲低ACBD5的A549细胞中观察到这种增强的鱼藤酮诱导的应激(图S12E、F)。ACBD5 KO细胞中鱼藤酮对mt-HyPer7的氧化效应可被PO-Mito锚定蛋白和野生型ACBD5表达所缓解,但CCD结构域缺失突变体(ACBD5ΔCCD)无此作用(图3F、H)。这表明,线粒体缓解鱼藤酮诱导过氧化氢的能力依赖于ACBD5介导的接触。因此,ACBD5介导的PO-Mito接触是氧化应激条件下维持线粒体氧化还原稳态的关键机制。
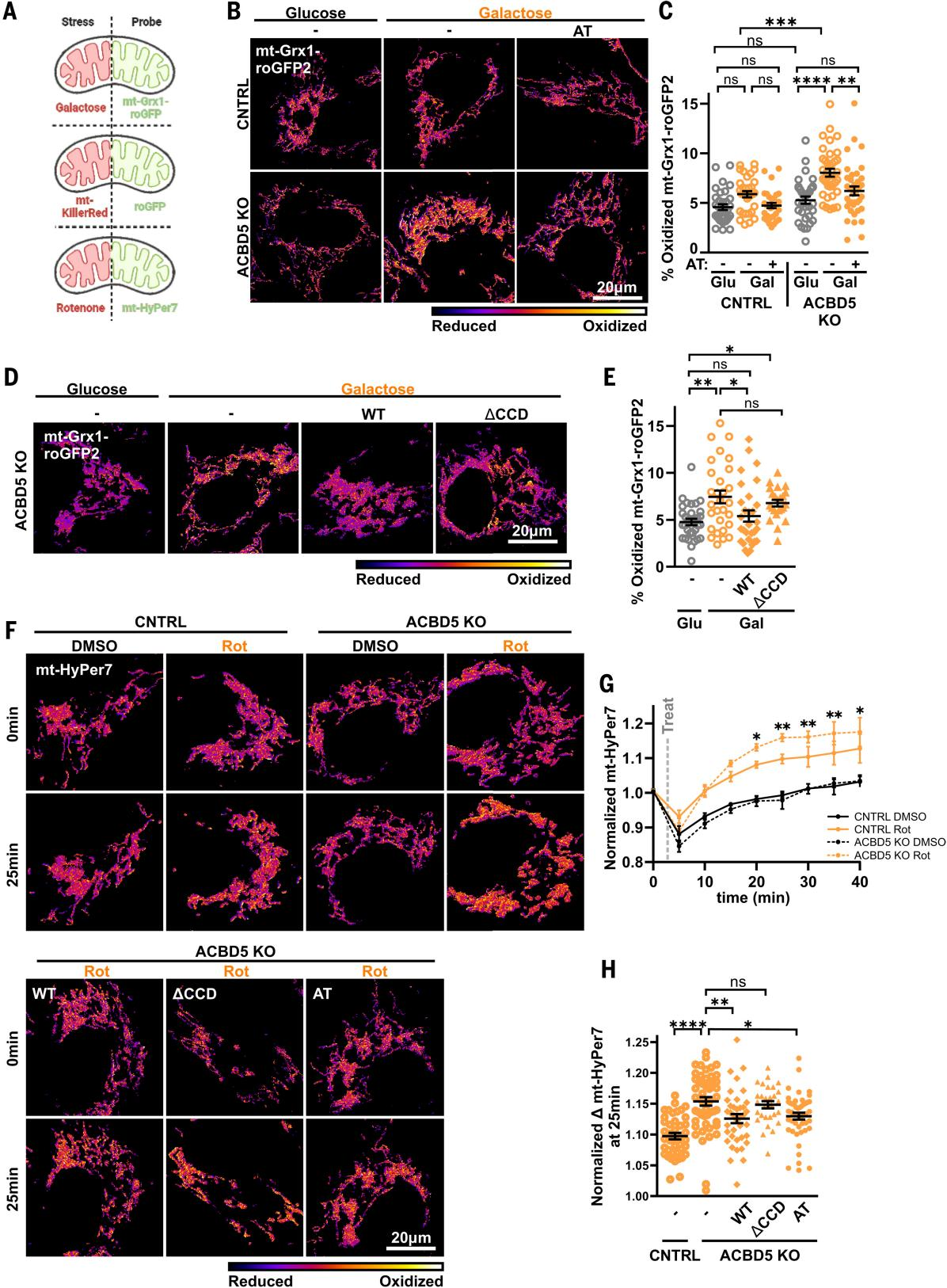
图3.过氧化物酶体接触可减轻线粒体氧化应激

图S12.支持过氧化物酶体接触减轻线粒体氧化应激的证据
5、接触促进线粒体ROS向过氧化物酶体的转移
研究人员假设PO-Mito接触促进了线粒体产生的ROS转移到过氧化物酶体,以减轻线粒体氧化应激。支持该模型的证据显示:在补充半乳糖的培养基中细胞过氧化氢酶在过氧化物酶体中显著富集,但总过氧化氢酶丰度没有变化(图S13A-F)。在用鱼藤酮处理后,过氧化氢酶在过氧化物酶体的富集程度也得到增强,并且当细胞首次在半乳糖中培养时变得更加明显(图S13G、H),这与鱼藤酮诱导的ROS形成对NADH:NAD+的依赖性一致(小编注:在正常培养基中细胞通过糖酵解产生ATP,而细胞在半乳糖培养基中半乳糖需经Leloir途径转化为葡萄糖-1-磷酸,再进入糖酵解,但转化效率低,导致糖酵解ATP产能不足,细胞被迫增强线粒体氧化磷酸化以满足能量需求,因此细胞在首次进行半乳糖培养时被迫从糖酵解突然转向OXPHOS依赖,而抗氧化系统未及适应。为了减轻突发性ROS负荷,细胞快速招募过氧化氢酶至过氧化物酶体,触发了过氧化物酶体更强烈的抗氧化代偿反应,因此富集程度显著高于已适应的细胞)。这种过氧化物酶体响应线粒体氧化应激,增强氧化还原能力的现象与过氧化物酶体作为线粒体ROS还原池的功能相一致。值得注意的是,CNTRL细胞中应激诱导的过氧化氢酶表型也类似于ACBD5 KO细胞中基础状态下观察到的过氧化氢酶的过氧化物酶体定位能力增强(图S10 E、G、H)。这表明ACBD5 KO细胞在基础条件下经历了更高水平的氧化应激,与之前的观察结果一致。
为直接验证过氧化物酶体作为线粒体ROS还原池的作用,研究人员检测了线粒体氧化应激诱导下的过氧化物酶体氧化还原状态变化(图4A)。通过靶向过氧化物酶体基质的Grx1-roGFP2,发现CNTRL Huh7细胞在半乳糖诱导线粒体氧化应激后,过氧化物酶体谷胱甘肽氧化水平显著升高(图4B、C、图S14A、B)。这种增加可以通过mt-CAT的表达来减弱,证实半乳糖诱导的过氧化物酶体氧化还原状态的变化与线粒体中ROS的产生直接相关。但遗憾的是,另一种靶向过氧化物酶体基质的Hyper7(图S14,C和D)不适合评估响应线粒体氧化应激的过氧化物酶体过氧化氢的变化,因为鱼藤酮处理后过氧化氢酶定位的变化(小编注:鱼藤酮通过干扰NADH脱氢酶的活性抑制电子传递链,导致线粒体产生大量ROS,从而触发过氧化氢酶从过氧化物酶体泄漏至胞质或向线粒体迁移,以清除高浓度的H2O2,而过氧化物酶体内的过氧化氢酶含量会显著降低)(图S13,G和H)会干扰HyPer7对过氧化氢的直接测量(图S15)。
为验证线粒体ROS是否通过PO-Mito接触转移至过氧化物酶体,研究人员检测了ACBD5 KO细胞中过氧化物酶体氧化还原状态变化是否对线粒体氧化应激的反应性产生了损害。研究发现尽管与CNTRL相比,ACBD5 KO细胞中的基础过氧化物酶体谷胱甘肽氧化升高,但在PO-Mito AT或mt-CAT的表达上没有观察到变化(图S16A-D),表明这种增加与PO-Mito接触和线粒体氧化还原无关。ACBD5 KO细胞过氧化物酶体中基础谷胱甘肽氧化升高可能是由于ACOX1升高,先前在ACBD5 KO小鼠中描述以及在本研究中观察到(图S10G),或在ACBD5 KO细胞中观察到的胞质谷胱甘肽氧化升高导致过氧化物酶体GSSG的胞质还原受损(图S2A、B)。
半乳糖诱导的过氧化物酶体谷胱甘肽氧化的增加在ACBD5 KO细胞中显著低于CNTRL细胞(图4D-E、图S16E),表明线粒体ROS向过氧化物酶体的转移在缺乏PO-Mito接触的细胞中受损。在ACBD 5 KO细胞中,过氧化物酶体氧化还原状态对半乳糖的反应可以通过表达PO-Mito AT和ACBD 5 WT而不是ACBD5 ΔCCD来挽救(图4D-G、图S16E、F)。因此,线粒体ROS向过氧化物酶体的转移是依赖于PO-Mito接触的机制发生。

图4.线粒体产生的ROS被转移到接触位点的过氧化物酶体

图S13.半乳糖处理后过氧化氢酶的过氧化物酶体靶向增强

图S14.过氧化物酶体靶向氧化还原探针的验证

图S15.鱼藤酮处理对过氧化物酶体过氧化氢的影响

图S16.支持线粒体产生的ROS在接触部位转移到过氧化物酶体的证据
总结
在本研究中,研究人员发现过氧化物酶体通过接触介导的ROS转移在维持线粒体氧化还原稳态中发挥直接作用。研究人员鉴定出由过氧化物酶体膜蛋白ACBD5和线粒体外膜蛋白PTPIP51介导的PO-Mito接触位点。并证实这种接触以及过氧化物酶体的氧化还原能力在线粒体氧化应激下受到动态调节,以促进ROS转移并维持线粒体氧化还原稳态。本项研究揭示了过氧化物酶体在线粒体氧化还原稳态维持中的直接功能作用,并揭示了过氧化物酶体疾病中的线粒体应激可能是由于接触介导的线粒体ROS向过氧化物酶体的转移丧失。通过描述细胞器腔和基质之间ROS交换的证据作为一种抗氧化机制,改变对细胞如何对氧化应激做出反应的理解,并表明氧化还原稳态是一个多细胞器过程。

原文链接:https://www.science.org/doi/10.1126/science.adn2804
https://wap.sciencenet.cn/blog-3483272-1505252.html
上一篇:Cell Metabolism:菌吃糖,人享瘦
下一篇:Cell Metabolism:FGF21:脂肪里的长寿因子