博文
我的研究风格和研究结果交流(二)水系锌电δ-MnO2中Zn2+嵌入机理重新审视
|
接上一篇博文(我的研究风格和研究结果交流(一))。我的研究工作的总体思路或者风格(称不上哲学):让研究生瞄准一个体系,从简单到复杂、从实验到理论,逐层递进,目标是发现新现象、建立新方法、揭示新机理,建立新规律,提出具有一定普适性的观点、方法、见解、理论。以上也是对博士生论文工作的要求。对硕士生而言,培养和提升研究能力更主要。研究方向:电池、材料电化学处理、石墨烯、扫描探针显微镜和表界面化学、半导体表面清洗和蚀刻、半导体器件制备和性能。
今天先介绍第一个研究:传统水系锌离子电池氧化锰电极反应机理的重新审视#

研究背景
水系锌离子电池因其高理论容量、低成本、高安全和生态友好性被认为是下一代最有潜力的储能设备之一。层状δ-MnO2因其较大的层间距(0.7 nm)和高理论容量(基于一个电子反应的理论容量为308 mAh g-1),被广泛应用于锌离子电池正极材料。δ-MnO2电极在锌离子电池中的电荷储存机理十分复杂。一方面,锰具有多种价态,充放电过程中锰价态的改变导致多种锰氧化物生成。另一方面,水系电解液中H2O、H+和OH-的参与使电池中的反应更加复杂。目前,文献中普遍认为δ-MnO2电极的反应机制为Zn2+的电化学嵌入/脱嵌。与其它晶型的MnO2相比,δ-MnO2具有优异的离子交换特性。然而,水系电解液中δ-MnO2的离子交换过程介导的Zn2+嵌入过程被严重忽视。
2. 研究内容
鉴于此,我们研究了水系锌离子电池体系中δ-MnO2电极的反应过程,首次提出δ-MnO2电极中的Zn2+嵌入是离子交换反应介导的化学过程,该反应对δ-MnO2电极的容量没有贡献。该文章重新审视了目前流行的Zn2+嵌入/脱嵌机理以及相关的性能提升策略。并且提出H+的嵌入/脱嵌、δ-MnO2的电化学溶解以及Vernadite的电化学溶解-沉积反应主导了δ-MnO2电极的电荷储存过程。研究该文章发表于Advanced Energy Materials*。
3. 研究亮点
(1)首次揭示了δ-MnO2电极中的Zn2+嵌入反应不是电化学过程,而是由离子交换反应介导的化学过程。
(2)离子交换介导的Zn2+嵌入反应不可逆,且对容量无贡献。因此,通过预嵌入阳离子的方式提升δ-MnO2电极电化学性能的策略需要重新审视。
(3)充放电过程中δ-MnO2电极的反应机理包括H+的嵌入/脱嵌、δ-MnO2的电化学溶解以及Vernadite的电化学溶解-沉积过程。
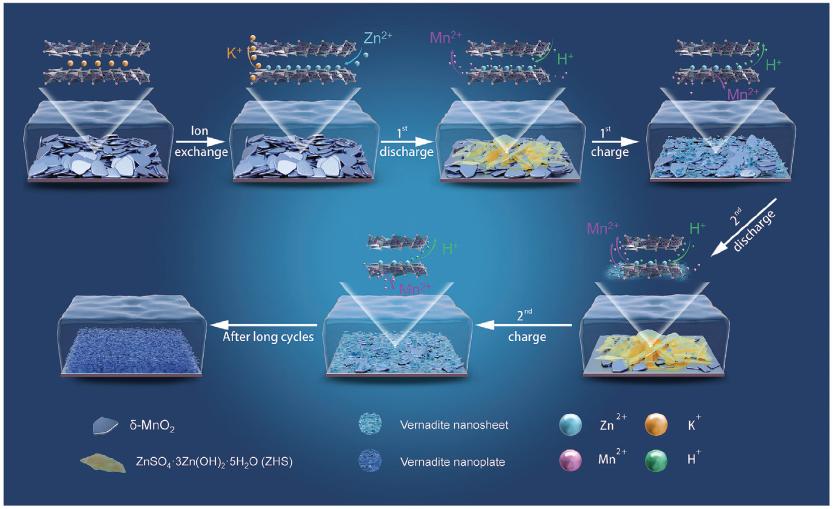
图1. 水系锌离子电池δ-MnO2电极的反应过程图示
4. 部分图文的导读
δ-MnO2的离子交换反应介导的Zn2+嵌入过程。在2 M ZnSO4电解液中,由于较大的浓度差,溶液中的Zn2+与δ-MnO2层间的K+发生自发的离子交换反应,Zn2+嵌入而K+脱出。该离子交换反应在短时间内达到平衡。离子交换后,Zn2+吸附在MnO6八面体表面,δ-MnO2的层间距和形貌保持不变。电池在充放电前一般会静置一段时间以保持电极充分浸润,静置过程中δ-MnO2的离子交换过程导致δ-MnO2的结构、组分发生改变。另外,在首次放电-充电过程中,δ-MnO2中的Zn2+含量基本不变,表明充放电过程中Zn2+没有通过电化学过程继续嵌入且离子交换介导的Zn2+嵌入过程不可逆。另外,实验证实δ-MnO2层间的Na+和Ca2+同样会与电解液中的Zn2+发生离子交换反应而脱出,因此需要重新审视δ-MnO2电极预嵌入阳离子策略。
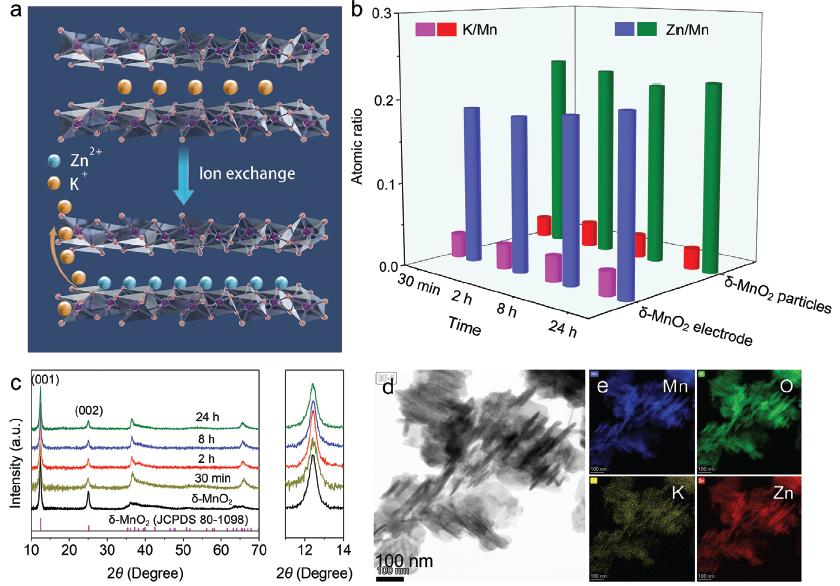
图2. (a)离子交换过程图示;(b)离子交换不同时间后δ-MnO2结构中K+和Zn2+含量;(c)离子交换不同时间后δ-MnO2的XRD图谱;(d)离子交换12 h后δ-MnO2的SEM和EDS Mapping图
δ-MnO2电极的H+嵌入/脱嵌反应。充放电过程中δ-MnO2电极发生了可逆的H+电化学嵌入/脱嵌反应。H+嵌入后与MnO6八面体中O2-的相互作用使δ-MnO2层间距减小,同时Mn被还原,Mn-O键键长增加,(110) 和(12)晶面间距增大。
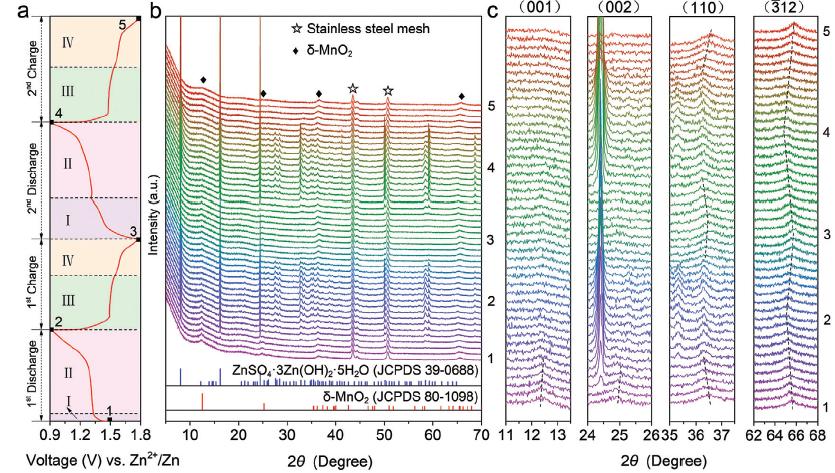
图3. δ-MnO2电极的原位XRD图谱
δ-MnO2的电化学溶解及vernadite的电化学溶解-沉积。放电时δ-MnO2发生电化学溶解,放电后电极质量降低,电解液中检测到大量Mn2+。同时,由于H+的嵌入过程和δ-MnO2的电化学溶解消耗了溶液中的H+,电极/电解液界面pH升高,导致电极表面生成大量ZnSO4·3Zn(OH)2·5H2O(ZHS)。充电时,ZHS和电解液中的Mn2+发生反应导致vernadite沉积。

图4. 首次充电后电极表面生成的vernadite的SEM和TEM表征
长循环过程中δ-MnO2转变为vernadite。初始充放电过程中vernadite的电化学溶解-沉积过程可逆。然而,随着循环次数增加,vernadite在电极表面不断沉积,缺乏与导电物质的充分接触,vernadite的电化学溶解-沉积可逆性变差。此外,电极表面生成的vernadite纳米片尺寸逐渐增大,厚度逐渐增厚并堆积。长循环过程中,δ-MnO2逐渐溶解,vernadite不断沉积,最后δ-MnO2完全转变为vernadite.
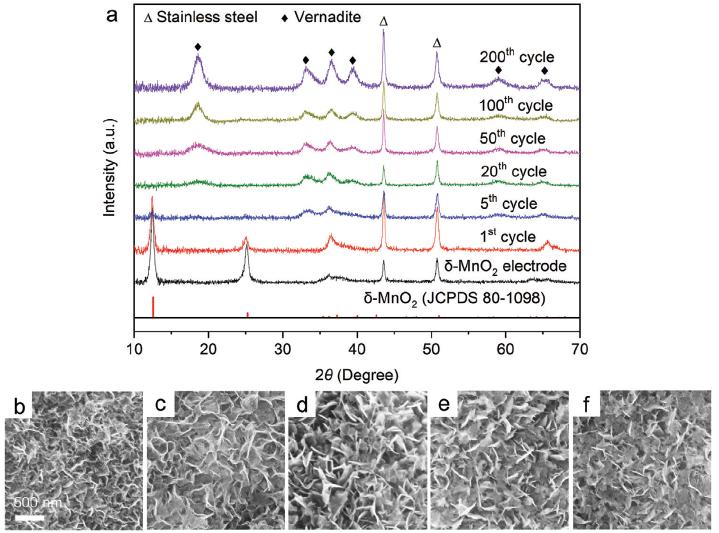
图5. 长循环过程中δ-MnO2电极的XRD谱图和SEM图像
5. 结论
本研究通过原位XRD、SEM、TEM、XPS和ICP等综合表征,并结合理论计算,揭示了𝛿-MnO2电极的反应过程。发现 Zn2+是通过离子交换反应不可逆地嵌入𝛿-MnO2中,而不是普遍认为的电化学过程。离子交换介导的 Zn2+ 在𝛿-MnO2中的不可逆插层对𝛿-MnO2电极的容量没有影响。𝛿-MnO2电极的电荷储存机理为H+的电化学嵌入/脱嵌、𝛿-MnO2的电化学溶解和vernadite的电化学溶解-沉积。长循环后,𝛿-MnO2 不可逆转地转化为vernadite。这些发现为δ-MnO2电极在水系多价离子电池中的反应过程提供了新的见解。
*S. Cui, D. Zhang, Y. Gan, Traditional Electrochemical Zn2+Intercalation/Extraction Mechanism Revisited: Unveiling Ion-Exchange Mediated Irreversible Zn2+ Intercalation for the δ-MnO2 Cathode in Aqueous Zn Ion Batteries, Advanced Energy Materials, 4 (2024) 2302655. DOI:10.1002/aenm.202302655
#注:本文全文原发表于水系储能公众号,此处有修改。
本系列第一篇:我的研究风格和研究结果交流(一):https://blog.sciencenet.cn/blog-1915402-1501292.html
相关博文:研究生从小白到高手的七项“硬实力”和“软技能”修炼,https://blog.sciencenet.cn/blog-1915402-1500114.html
https://wap.sciencenet.cn/blog-1915402-1501625.html
上一篇:我的研究风格和研究结果交流(一)
下一篇:我的研究风格和研究结果交流(三)巧用扫描电镜实现衬底支撑石墨烯的高质量成像