博文
Nano Res.[生物]│配体辅助的核-腔-冠等离子体立方结构实现血栓调节蛋白的超灵敏三模式传感  精选
精选
||

背景介绍
血栓调节蛋白(TM)是一种表达于血管内皮细胞的糖基化跨膜蛋白,通过与凝血酶结合促进蛋白C活化,抑制凝血酶生成并减轻其促凝、促炎和促纤维化作用。在弥散性血管内凝血、糖尿病微血管病变、高血压妊娠并发症、系统性红斑狼疮等多种内皮损伤及炎症相关疾病中,可溶性TM水平显著升高,因此成为评估内皮功能障碍和血栓事件的重要生物标志物。目前常用的检测手段包括ELISA、电化学发光、QCM、荧光光谱、Western blot和便携式血糖仪等,虽各具特色,但普遍存在仪器昂贵、操作繁琐、检测周期长、不适于快速高通量筛查等缺点,尚缺乏简便、快速的现场定量方法。
免疫层析法(ICA)以快速、操作简便、无需复杂设备而广泛应用,但基于胶体金(AuNPs)的传统比色信号亮度弱、灵敏度低,难以定量检测痕量TM。近年来,荧光、磁性、光热及表面增强拉曼散射(SERS)等多种新型信号模式被开发用于ICA,其中SERS-ICA兼具单分子灵敏度、背景低、光稳定性好和检测速度快等优势。此外,空腔多孔纳米笼材料因其比表面积高(较实心粒子可提升近20倍)、尖锐棱角带来的电磁场增强效应及轻质低密度优点,可显著提高抗体负载量和SERS信号强度,并改善侧向流迁移性能;疏水有机配体修饰则可进一步增强抗体物理吸附效率。由此,将空腔笼结构与疏水配体协同应用于SERS-ICA,有望实现TM的快速、灵敏、简便定量检测。
成果简介
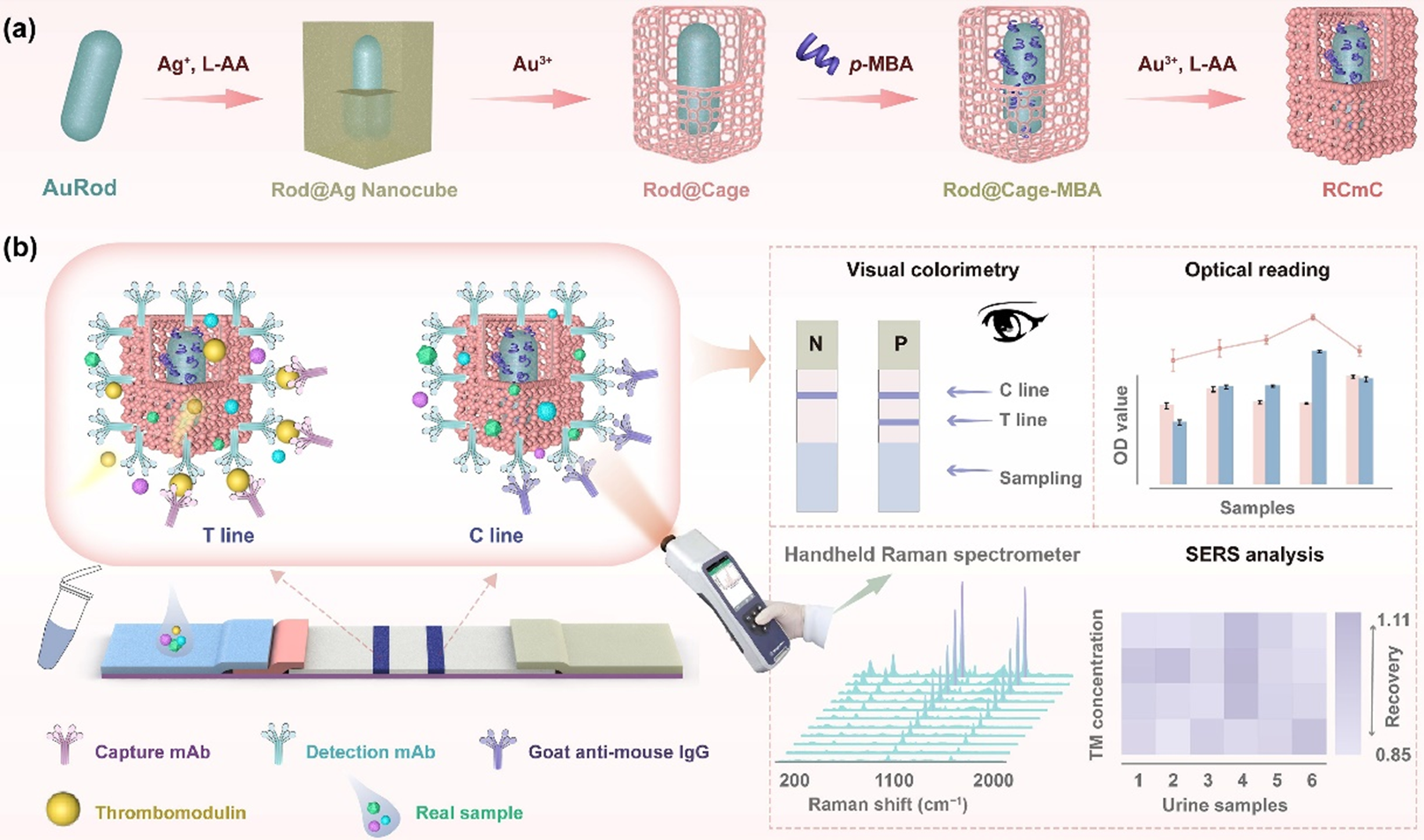
中国科学院苏州生物医学工程技术研究所尹焕才课题组成功开发了一种新型配体辅助核-腔-冠等离子体立方结构(RCmC),显著提升了免疫分析性能,实现了TM的超灵敏三模式(视觉/光学/SERS)检测。
RCmC以立方纳米笼为框架,其内部包封各向异性金纳米棒(AuNR)和p-巯基苯甲酸(p-MBA)分子,外部则生长有粗糙的冠状表面,形成独特的核-腔-冠立方纳米结构。该结构富含纳米边缘和尖端,能产生强烈的局部表面等离子体共振效应,形成高密度电磁热点,从而大幅增强纳米材料的SERS活性。此外,这种多级结构具有大的比表面积,可提供丰富的分子结合位点,用于偶联更多单克隆抗体或拉曼信号分子,进而显著提高ICA试纸条检测线的亮度和SERS信号强度。
研究团队首次利用十六烷基三甲基氯化铵(CTAC)配体的疏水相互作用,进一步增强了纳米颗粒与抗体的结合能力。与传统AuNPs体系相比,CTAC辅助的RCmC颗粒将抗体偶联效率提高了2.5倍,并使相应ICA检测的灵敏度提升约346倍,同时将检测时间缩短至5分钟以内。
在实际临床样本检测中,该方法所得结果与商业化ELISA试剂盒高度一致,展现出极高的准确性和稳定性。配体辅助的RCmC纳米材料显著增强了免疫层析分析的信号强度和定量能力,为生物医学诊断领域提供了一种更具可靠性和灵敏度的解决方案。
作者简介
中国科学院苏州生物医学工程技术研究所刘杰博士后为论文第一作者,尹焕才研究员、孙姣姣博士后为论文通讯作者。本研究得到国家自然科学基金项目、江苏省自然科学基金项目、苏州市基础研究项目和中国博士后面上基金项目的资助。
文章信息
Liu J, Li L, Li H, et al. Ligand-assisted core-cavity-corona cubic plasmonic nanostructures amplify immunoassays for ultrasensitive triple-mode sensing of thrombomodulin. Nano Research, 2025, https://doi.org/10.26599/NR.2025.94907661.

识别二维码或点击左下角“阅读原文”可访问全文

https://wap.sciencenet.cn/blog-3563286-1492184.html
上一篇:Oral Science and Homeostatic Medicine出版“稳态医学与衰老干预”专刊
下一篇:Nano Res.[单元]│湖南大学段曦东课题组通过氢辅助退火2H MoTe₂纳米片原位合成大面积六重取向Mo₆Te₆纳