博文
局部可见光催化产氢与温热联合治疗压疮
||
局部可见光催化产氢与温热联合治疗压疮
摘 要
压疮(PU)因反复压力诱导的严重缺血再灌注损伤(IRI)、微循环障碍和慢性炎症而难以治愈。氢分子(H₂)被证实是一种新兴的抗炎和抗IRI制剂,具有高生物安全性,而局部温热疗法已被证实能够改善组织微循环,促进伤口修复。本研究提出了一种可见光催化产氢/温热联合治疗压疮的新策略,并开发了钯纳米点沉积的掺氢二氧化钛纳米棒(HTON-Pd)作为新型多功能光催化剂,实现了可控且可持续的可见光催化产氢和产热。HTON-Pd封装的水凝胶敷料(HTON-Pd@Gel)在可见光照射辅助下每日给药,获得了显著的压疮治疗效果。经HTON-Pd@Gel治疗11天后,顽固的压疮伤口完全愈合。从机制上讲,HTON-Pd光催化产生的氢气和温热通过协同促进皮肤细胞的增殖和迁移、抑制细胞凋亡、减轻炎症反应并促进新血管生成,改善了压疮伤口微环境,从而支持伤口愈合。
本文来自上海交通大学氢科学中心何前军教授团队。
1 引言
压疮(PU),又称褥疮,由皮肤持续受压引起,导致严重的缺血再灌注损伤(IRI)、组织微循环不良和慢性炎症[1-4]。随着人口老龄化的发展,压疮发病率不断上升,给患者和医疗系统带来了沉重负担。目前,临床压疮治疗方法主要包括药物治疗、手术治疗和物理治疗[1,5-7]。尽管这三种治疗方法在缓解压疮患者的疼痛和不适方面有一定效果,但由于无法有效解决反复IRI、微循环不良和慢性炎症问题,难以完全治愈压疮。因此,迫切需要开发安全、高效的压疮新治疗方法/药物[8-10]。
近年来,氢分子(H₂)已被证明是一种高生物安全性的生理调节剂,可在多种炎症相关疾病中发挥抗氧化、抗炎和抗凋亡作用[11-16]。此外,研究发现H₂在线粒体中铁卟啉的催化下,可通过有效清除细胞毒性活性氧(ROS)来减轻IRI,显示出治疗压疮的潜力[17-20]。此外,氧化应激的缓解可通过Nrf2、AMPK、PI3K/Akt等特定信号通路支持炎症减轻并促进损伤组织修复[21-28]。最近,我们已证实吸入H₂气体在一定程度上可通过其抗IRI和抗炎功能抑制压疮的形成[28]。但吸入H₂气体的压疮治疗效果仍不令人满意,因为从肺部到皮肤的长距离运输导致压疮皮肤的H₂生物利用度相当低。因此,向压疮伤口部位局部、持续、有效地递送H₂对压疮的高效治疗至关重要。光催化产氢为压疮治疗提供了一种理想的解决方案,目前尚未见相关报道。
作为经典物理治疗方法,红外灯照射组织局部温热已被临床证实可通过热休克蛋白通路扩张血管并促进组织微循环,有利于伤口修复[7,29,30]。但温热疗法的压疮疗效仍然有限,因为温热无法直接清除细胞毒性ROS,其对抗炎和抗IRI的贡献非常微弱。因此,氢疗法与温热疗法的结合可能是压疮治疗的潜在有效策略,但至今尚未见报道。这可能是因为难以有效结合这两种治疗模式。
在本研究中,我们提出了一种将光催化氢疗法与温热疗法相结合治疗压疮的创新策略,并开发了钯纳米点沉积的掺氢二氧化钛纳米棒(HTON-Pd)作为新型多功能治疗平台。在HTON上沉积钯纳米点不仅可以提高可见光催化产氢效率,还能实现可见光光热治疗,从而实现可控且可持续的光控产氢和产热。将HTON-Pd封装到水凝胶中构建新型敷料(HTON-Pd@Gel),通过氢气/温热协同改善压疮伤口微环境,展现出优异的压疮治疗效果(图1)。
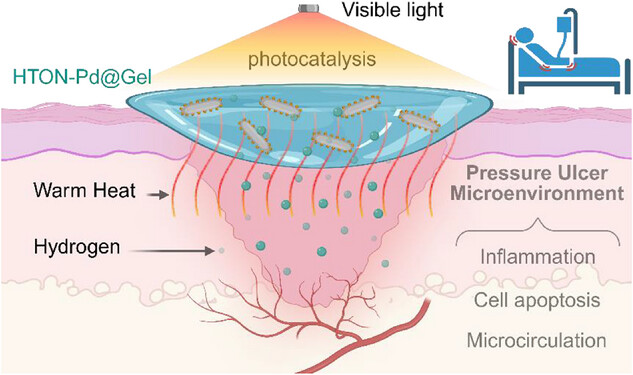
图1
可见光催化产氢/温热联合治疗压疮策略的示意图。在HTON-Pd@Gel覆盖的压疮伤口每日可见光照射下,可见光催化产生的氢气和温热协同改善压疮伤口微环境,包括抗炎、抗凋亡、促增殖、促迁移和促血管生成以改善微循环,支持加速压疮伤口愈合。
2 结果与讨论
2.1 HTON-Pd的合成与结构表征
二氧化钛(TON)是一种典型的药用辅料和防晒乳液添加剂,具有高紫外线吸收能力、紫外光催化能力和良好的生物安全性,目前在化妆品中广泛用作白色无机颜料。然而,TON仅吸收短波长的紫外线,对细胞和组织具有显著毒性,长期暴露于紫外线会增加皮肤癌风险。为此,本研究尝试将TON的吸收波长从紫外区转移到可见光区,并通过全溶液法向TON中掺杂氢,制备用于产氢的可见光光催化剂。首先通过水热法制备金红石单晶TON,然后在室温下的乙二胺溶液中通过锂掺入与锂/氢交换相结合的方法合成HTON。此外,为了赋予纳米颗粒光热功能,并增强电子/空穴分离以提高可见光催化产氢效率[31],通过紫外光催化沉积法[32-34]将Pd纳米点以高比例局部沉积在HTON纳米棒表面(HTON-Pd)。
如图S1(支持信息)所示,制备的TON呈棒状形态,长度为80‒200 nm,直径为26‒45 nm,在水溶液中具有良好的分散性。从图S2(支持信息)的X射线衍射(XRD)数据和图S3(支持信息)的高分辨率透射电镜(TEM)图像可以看出,合成的TON具有金红石单晶结构(PDF73-1232)。这种TON的金红石单晶相有利于稳定氢掺入TiO₂晶格[35]。从图S3(支持信息)的高分辨率TEM图像可知,氢的掺入导致结晶度降低,这与图S2(支持信息)的XRD结果一致。从扫描电镜(SEM,图2a)、透射电镜(TEM,图2b,c)和高角度环形暗场(HADDF,图S4,支持信息)图像及元素映射图(图2d,e)可以清楚地看到,大量直径约5 nm的Pd纳米点均匀附着在HTON-Pd纳米棒表面。图S5(支持信息)的能量色散X射线光谱(EDX)结果进一步表明,根据Pd/Ti摩尔比0.049,Pd在HTON上的沉积量达到6.5%。
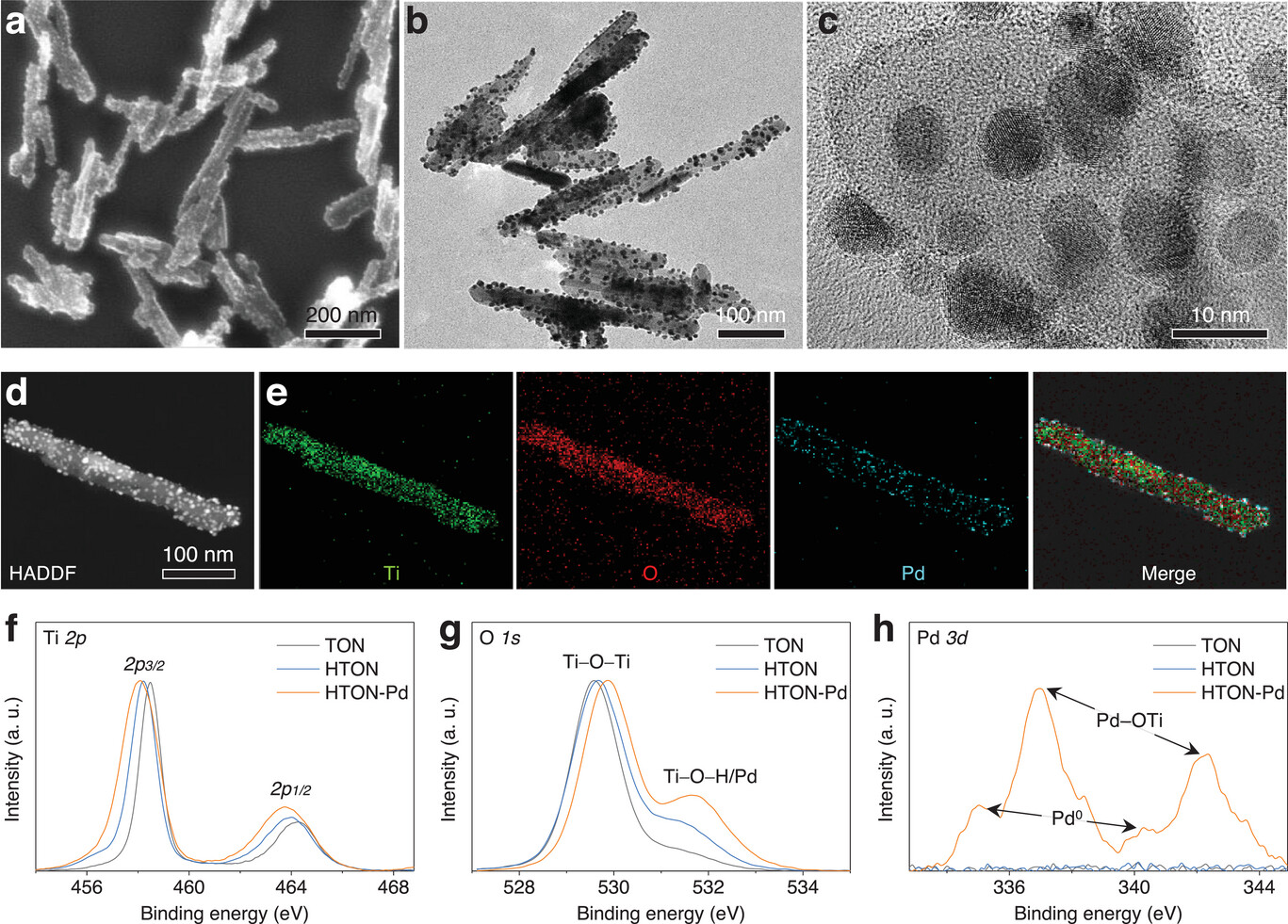
图2
HTON-Pd的形貌、组成和结构表征。HTON-Pd的SEM图像(a)、低倍TEM图像(b)和高分辨率TEM图像(c),HTON-Pd的HADDF图像(d)及相应的元素映射图(e),HTON-Pd的XPS图谱(f–h)。
图2f和图S6(支持信息)的X射线光电子能谱(XPS)显示,与TON相比,HTON的Ti 2p峰略微向低能方向移动,这是由Ti─H键引起的,表明氢掺杂成功。此外,在≈531.6 eV处,HTON-Pd和HTON的O 1s峰远高于TON(图2g),表明成功掺入氢并沉积Pd,形成桥接羟基(Ti─OH─Ti)和表面Ti─O─Pd键。除了界面Ti─O─Pd键的形成外,Pd主要以Pd(0)纳米点形式存在(图2h)。结果表明,由于局部紫外光催化还原作用,Pd纳米点通过界面键合稳定沉积在HTON表面。此外,动态光散射(DLS)结果显示,合成的Pd-HTON在水溶液中具有良好的分散性(图S7,支持信息),这确保了其可在水凝胶中均匀分布。
2.2 可见光催化产氢/产热性能
图3a中TON、HTON和HTON-Pd的吸收光谱显示,TON仅能吸收紫外光,而HTON由于氢掺杂在可见光至近红外区域表现出强烈的吸收。同时,由于Pd纳米点的局部表面等离子体共振(LSPR)效应,HTON-Pd的吸光度普遍强于HTON(图3a)。此外,我们检测了HTON-Pd的电子能带结构,以确认其是否适用于可见光催化产氢。根据图3b中的XPS价带光谱,通过以下公式计算HTON-Pd相对于标准氢电极(NHE)的价带最大值(VBM):VBM(相对于NHE) = F + VBM(相对于XPS) − 4.44,其中F为仪器的功函数(4.20 eV),计算得VBM为1.96 eV。根据图3c中的莫特-肖特基曲线,测得HTON-Pd相对于Ag/AgCl的导带最小值(CBM)为−0.36 eV,再通过公式E(NHE) = E(Ag/AgCl) + 0.197计算出相对于NHE的CBM为−0.163 eV。图3d展示了HTON-Pd纳米棒的光催化产氢/产热机制:HTON-Pd的CBM电位低于H+/H₂的还原电位(0 V),支持可见光催化产氢;其VBM电位高于GSH/GSSG的氧化电位(0.32 eV),因此我们将GSH封装到HTON-Pd@Gel中作为空穴牺牲剂。在相同的可见光照射时间和功率下,HTON-Pd的光催化产氢效率显著高于HTON(图3e),表明Pd在HTON表面的沉积可通过增强电子/空穴分离来提高光催化产氢效率。从图3e可见,在0.2 W·cm⁻²光照下,Pd纳米点沉积使HTON的光催化产氢效率提高了0.14 μmol·min⁻¹;在0.5 W·cm⁻²光照下,提高了0.49 μmol·min⁻¹。从图3f的光热曲线可知,在相同的照射条件和Pd浓度下,HTON-Pd的可见光热效应明显强于Pd纳米颗粒,这可能归因于HTON上Pd纳米点的LSPR效应。此外,可见光热效应还依赖于HTON-Pd的浓度(图S8,支持信息)。另外,在重复可见光照射过程中,尽管可见光功率密度不同,光催化产氢和产热仍保持稳定,且H₂和热量的生成与可见光照射时间呈线性相关(图S9,支持信息)。通过线性拟合计算得出,在0.5 W·cm⁻²光照下,产氢效率为0.31 μmol·min⁻¹,而产热效率为1.04 °C·min⁻¹(与光密度无关,图S9,支持信息)。
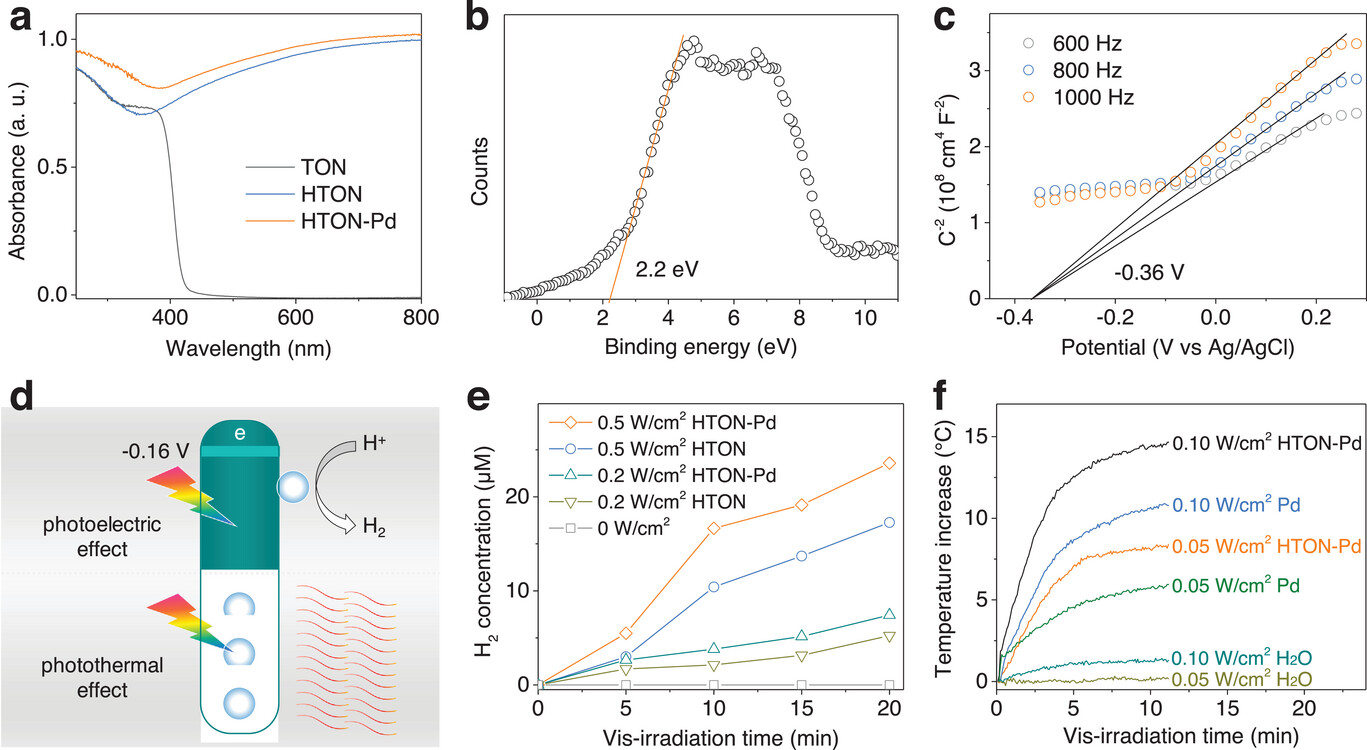
图3
电子能带结构表征及可见光催化产氢/产热性能测试。TON、HTON和HTON-Pd的紫外-可见吸收光谱(a),HTON-Pd的XPS价带电位(b),HTON-Pd的莫特-肖特基曲线(c),HTON-Pd可见光催化产氢/产热机制示意图(d),HTON-Pd的可见光催化产氢行为(e),HTON-Pd的可见光热性能(f)。
2.3 HTON-Pd的体外光催化氢气/温热联合治疗性能
在验证HTON-Pd可实现可见光催化产氢和产热的基础上,进一步在细胞水平探索氢气与温热联合治疗的效果。在0–200 μg·mL⁻¹浓度范围内,Pd-HTON对人皮肤成纤维细胞(HSF)和人永生化角质形成细胞(HaCaT)未表现出明显的细胞毒性,表明HTON-Pd具有高细胞相容性(图S10,支持信息)。为消除GSH对细胞实验的干扰,将不同浓度的GSH与HSF和HaCaT细胞共孵育,结果显示在0–250 μg·mL⁻¹浓度范围内,GSH不影响HSF和HaCaT细胞的活力(图S11,支持信息)。
此外,我们检测了HTON-Pd在细胞内的可见光催化产氢能力。从图4a可见,对HTON-Pd(200 μg·mL⁻¹)处理的HSF细胞进行可见光照射(0.05 W·cm⁻²,15 min)可在细胞内有效产H₂。从图4b和图S12(支持信息)可知,单独氢气(HTON+VIS)和温热(Pd+VIS)处理均可促进HSF和HaCaT细胞的增殖,而单独HTON-Pd或VIS处理则不能。H₂O₂处理30 min后,HaCaT细胞因氧化损伤出现明显凋亡,而氢气和温热可抑制HaCaT细胞的凋亡(图4c,d)。同时,氢气和温热还能促进HSF和HaCaT细胞的迁移(图5;图S13,支持信息)。与单一治疗相比,氢气/温热联合治疗可实现更高的促增殖、促迁移和抗凋亡效果。这些结果表明,HTON-Pd介导的可见光催化产氢和产热非常有利于修复如压疮等氧化损伤的皮肤伤口。
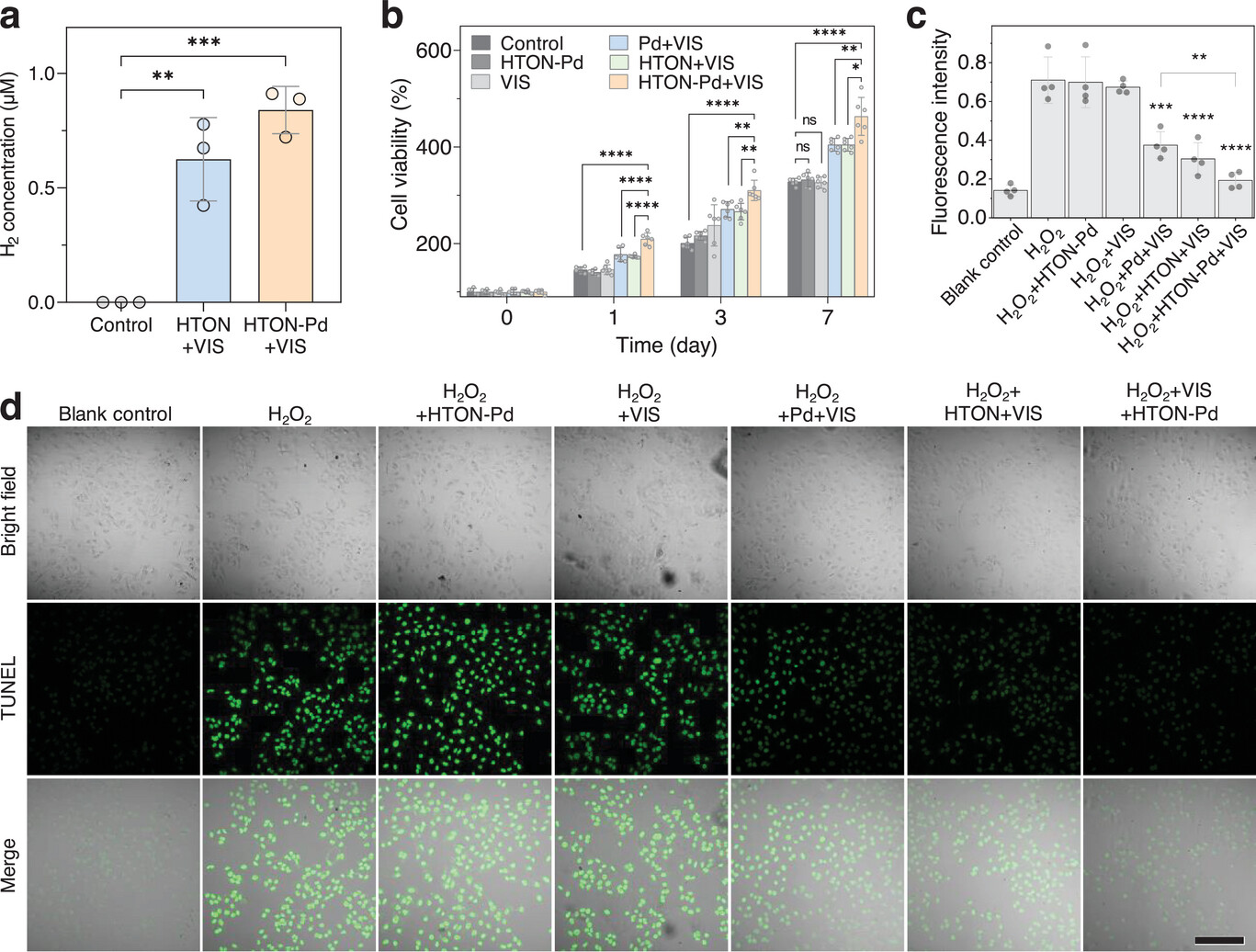
图4
可见光催化产氢/温热对皮肤细胞增殖及氧化应激诱导凋亡的体外影响。细胞内可见光催化产H₂(n=3个生物学独立样本)(a),氢气和温热处理对HSF细胞增殖的影响(n=6个生物学独立样本)(b),氢气和温热处理对氧化应激诱导的HaCaT细胞凋亡的影响(比例尺,200 μm)(d)及相应统计分析(n=4个生物学独立样本)(c)。p<0.05被认为存在显著差异(*p<0.05,**p<0.01,***p<0.001,****p<0.0001;ns,无显著差异)。
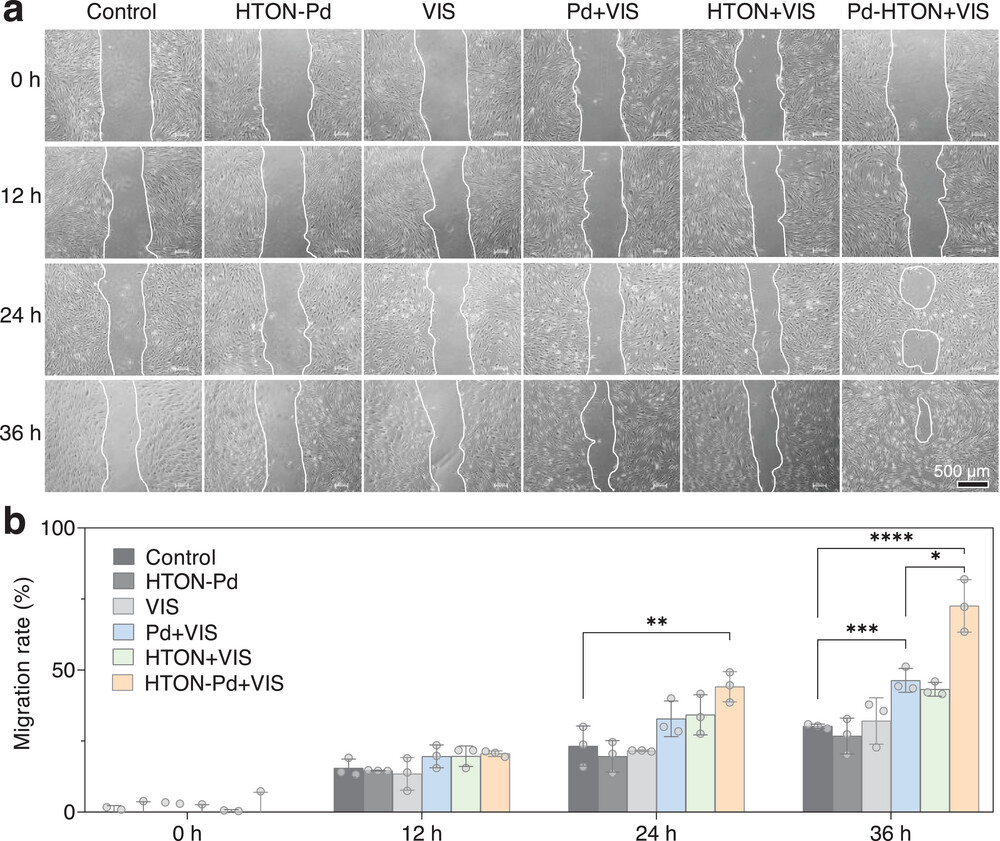
图5
可见光催化产氢和温热对皮肤细胞迁移的体外影响。不同处理后HSF细胞模拟伤口的数码照片(a)及相应统计分析(n=3)(b)。p<0.05被认为存在显著差异(*p<0.05,**p<0.01,***p<0.001,****p<0.0001;ns,无显著差异)。
2.4 体内光催化氢气/温热治疗效果
基于上述体外实验结果,我们进一步在压疮伤口模型中评估氢气/温热联合治疗对伤口愈合的效果。为治疗压疮,将HTON-Pd纳米棒混入壳聚糖/盐酸水凝胶中制备混合敷料(HTON-Pd@Gel),该敷料可粘附在压疮伤口表面。此外,15 min可见光照射(0.05 W·cm⁻²)未明显改变HTON-Pd@Gel水凝胶的微观结构(图S14,支持信息)和流变行为(图S15,支持信息),这有利于稳定的光催化治疗。
如图6a所示,通过用两个圆形磁板夹持小鼠背部皮肤12 h后释放12 h来构建压疮模型,此夹持/释放循环重复三次,最终在小鼠背部形成两个圆形伤口。建模后,在压疮伤口表面涂抹HTON-Pd@Gel敷料,然后用氙灯局部照射(0.05 W·cm⁻²,每次15 min,每天三次)。根据图S16(支持信息),照射15 min后,HTON-Pd@Gel组小鼠压疮伤口温度升高约5°C,表明HTON-Pd@Gel具有良好的可见光响应温热性能,满足温热治疗需求。此外,暴露于可见光24 h后,HTON-Pd@Gel的吸附性能(图S17,支持信息)和晶相(图S18,支持信息)均保持不变,表明HTON-Pd@Gel稳定性高,无光诱导降解及HTON和Pd的浸出。值得注意的是,与一般利用组织深层血管作为光热发射源的近红外光热治疗不同[36],本研究使用的可见光无需穿透水凝胶敷料甚至组织深层来产热。在本研究使用的1 mg·mL⁻¹封装比例下,可见光可轻松穿透HTON-Pd@Gel敷料(图S17a,支持信息),确保HTON-Pd介导的光催化产氢和产热。此外,该治疗系统可使用高便携性可见光源,这将增强其临床转化相关性和患者依从性。

图6
氢气/温热联合治疗压疮的体内效果。压疮模型构建及HTON-Pd@Gel治疗流程示意图(a),治疗期间压疮伤口的代表性数码照片(b)。图b中的红色饼图对应伤口愈合百分比。
从图6b和图S19(支持信息)可以看出,HTON-Pd@Gel+VIS治疗第7天,伤口痂皮脱落,伤口愈合率高达79%,而其他治疗组小鼠的痂皮未脱落。治疗第9天,对照组、Pd@Gel+VIS组、HTON@Gel+VIS组和HTON-Pd@Gel+VIS组的压疮伤口愈合率分别达到55%、74%、73%和96%。这表明温热和氢气分子均能促进压疮修复,但HTON-Pd@Gel+VIS的氢气/温热联合疗法促进压疮伤口愈合的效率最高,展现出氢气和温热的协同治疗效果。清晰可见的是,HTON-Pd@Gel+VIS治疗11天后,压疮伤口几乎完全愈合,而未使用任何敷料的对照组远未愈合(图6b)。
2.5 光催化产氢/温热改善压疮伤口微环境
皮肤持续受压会导致严重的氧化应激和损伤、慢性炎症、组织微循环不良及血管生成不足,共同形成严重的压疮微环境,阻碍皮肤自我修复。基于上述优异的治疗效果,我们进一步研究了光催化氢气/温热联合疗法对压疮微环境的影响。CD68是巨噬细胞促炎活性的生物标志物,采用免疫组织化学方法分析压疮伤口部位CD68的表达。从图7a、b和图S20(支持信息)可知,单独温热(Pd@Gel+VIS组)和单独氢气分子(HTON@Gel+VIS组)均可轻微降低压疮伤口部位CD68的表达,但HTON-Pd@Gel+VIS的氢气/温热联合治疗可通过降低CD68的表达更有效且持续地阻断炎症。从图7c可以看出,与单独氢气和温热治疗相比,氢气/温热联合治疗也更明显地抑制了压疮伤口部位IL-6的表达,这与CD68的结果一致。此外,联合治疗的抗炎效果在压疮早期更强(图7c;图S21,支持信息),可能是由于初期炎症表型更为明显。Caspase-3是细胞凋亡过程中的执行分子,不同的凋亡途径可激活Caspase-3并导致细胞凋亡。从图7d可知,Gel和HTON-Pd@Gel均不能显著降低压疮伤口部位Caspase-3的表达,但氢气和温热的联合作用比单独氢气和温热治疗对Caspase-3的抑制作用更大,表明氢气/温热联合治疗可抑制压疮伤口处的细胞凋亡。类似地,HTON-Pd@Gel+VIS组中HSP90蛋白的表达更显著增强(图7e),从而促进细胞免受凋亡的保护作用。血管生成在伤口愈合和组织再生中至关重要,CD31是内皮细胞分化的生物标志物,VEGF是经典的血管内皮生长因子。因此,我们在治疗6天后对压疮伤口部位进行CD31免疫组织化学染色并测量VEGF水平。从图7f可以发现,氢气和温热治疗均可诱导VEGF的表达,而Gel在一定程度上可以,HTON-Pd@Gel和Gel+VIS则不能,而氢气/温热联合作用更为显著。这种联合作用在促进CD31的表达方面似乎更为明显(图7g,h)。
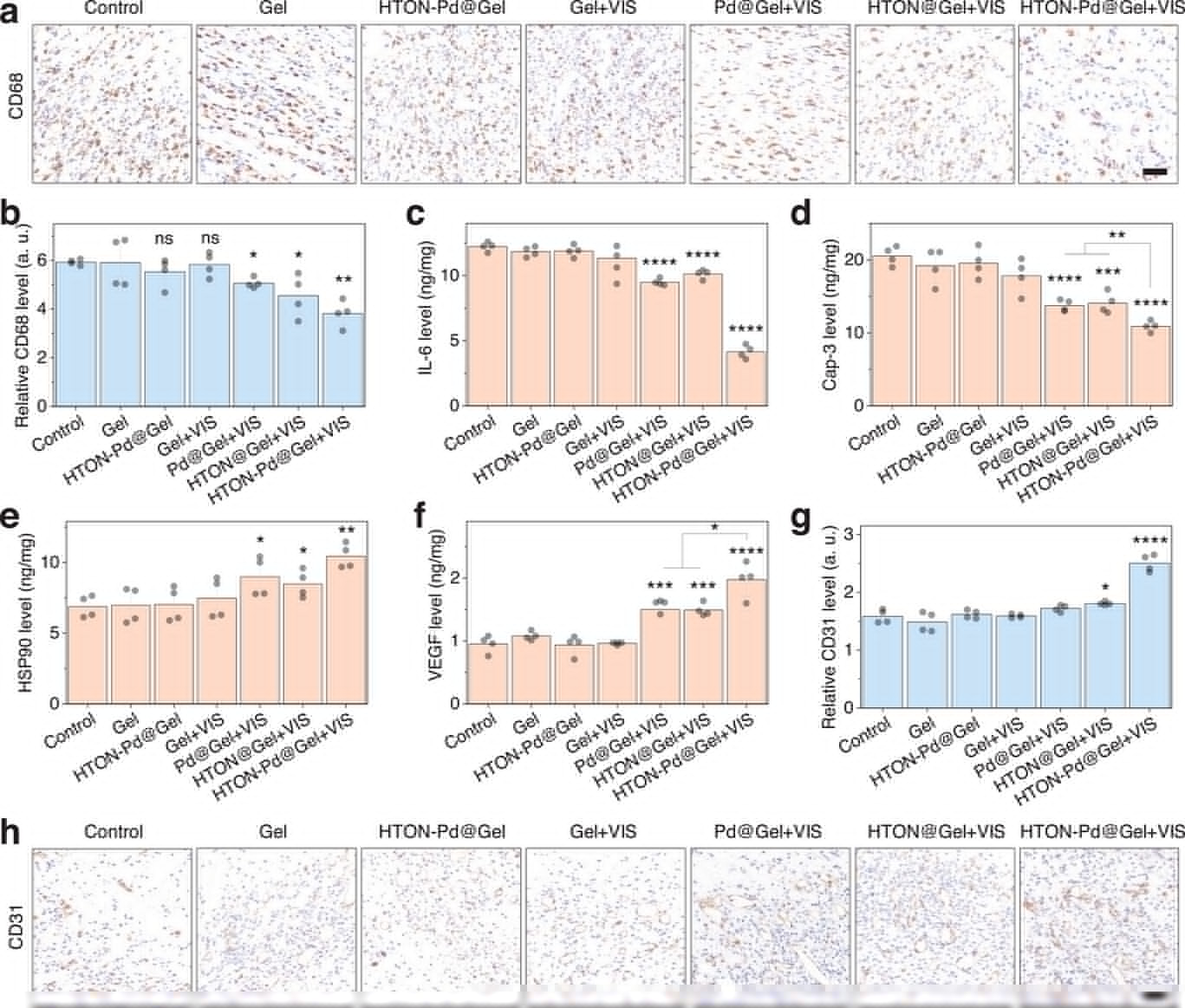
图7
氢气和温热对因子表达的调节作用。治疗6天后CD68表达的免疫组织化学染色(a)及相应统计结果(n=3个生物学独立样本)(比例尺,50 µm)(b),治疗6天后压疮伤口部位IL-6(c)、Caspase-3(d)、HSP90(e)和VEGF(f)表达的ELISA分析(n=4个生物学独立样本),治疗6天后CD31表达的免疫组织化学染色(g)及相应统计分析(n=3个生物学独立样本)(比例尺,50 µm)(h)。p<0.05被认为存在显著差异(*p<0.05,**p<0.01,***p<0.001,****p<0.0001;ns,无显著差异)。
结果显示,HTON-Pd@Gel+VIS治疗更及时有效地改善了压疮伤口愈合过程中的纤维化,并诱导了皮肤再生(图S22和图S23,支持信息)。这些结果一致表明,HTON-Pd@Gel+VIS的氢气/温热联合治疗可更有效地阻断组织炎症、抑制细胞凋亡并促进血管再生,从而支持伤口加速愈合。
此外,为了验证HTON-Pd@Gel+VIS的氢气/温热联合疗法在体内的生物安全性,在整个治疗过程中监测小鼠体重,并在治疗结束时采集血液样本进行生化检测。图S24(支持信息)显示,所有治疗组的体重均无显著差异。从图S25和图S26(支持信息)可以看出,所有血液样本的代表性指标均维持在正常范围内,表明氢气/温热联合治疗具有高生物安全性。此外,治疗后对小鼠实施安乐死,收集心、肝、脾、肺和肾进行H&E染色。从图S27(支持信息)可以观察到,所有实验组均未对这些主要器官造成显著损伤。同时,HTON-Pd@Gel+VIS治疗两周后,收集压疮伤口处的新生组织,评估ROS水平和各种炎症细胞因子。从图S28(支持信息)可知,与无压疮伤口的正常小鼠相比,HTON-Pd@Gel+VIS治疗两周后未显著影响ROS和各种炎症细胞因子的水平,表明HTON-Pd@Gel在压疮伤口完全愈合后具有高生物安全性。此外,ICP测量结果表明,HTON-Pd主要分布在痂皮中,而非血液和主要器官(图S29,支持信息),这表明HTON-Pd可能在伤口愈合过程中被包含在痂皮中,并随着痂皮的脱落而排出体外。这些结果进一步证实了HTON-Pd@Gel+VIS治疗的高生物安全性。
3 结论
总之,针对压疮伤口的病理特征,我们开发了HTON-Pd纳米棒封装的水凝胶作为可见光光催化剂,其在可见光照射下可在压疮伤口中产生氢气和温热。在氢气和温热的联合作用下,压疮伤口部位的炎症得到良好控制,血管生成得到促进,有利于组织微循环的改善。本研究提出了氢气和温热联合治疗策略,解决了当前压疮治疗中的诸多问题,为压疮治疗提供了一种简单、安全、高效的解决方案。
https://wap.sciencenet.cn/blog-41174-1489398.html
上一篇:氢气对烧伤后脓毒症治疗效应
下一篇:减肥新时代,如何维持体重反弹?